© Borgis - Postępy Nauk Medycznych s1/2014, s. 33-42
Krzysztof Pastewka
Łagodny rozrost gruczołu krokowego

Schorzenie gruczołu krokowego przebiegające pod postacią postępującego z wiekiem rozrostu cew gruczołowych i zrębu stercza (hyperplasia prostata – BPH) i doprowadzające do anatomicznego powiększenia narządu wraz z następstwami jest najczęstszym i powszechnym schorzeniem populacji męskiej powyżej 45 roku życia. Poniżej 30 roku życia nie spotyka się histologicznego rozrostu cew gruczołowych w sterczu, od 45 roku życia proces ten postępuje. W VI dekadzie życia zapadalność na BPH wynosi ok. 50%, w VIII dekadzie obejmuje prawie 90% populacji męskiej. Gruczoł krokowy (stercz) jest narządem układu płciowego i miejscem powstawania wydzieliny nasiennej, w której zawieszone są gamety męskie (plemniki). Gruczoł krokowy otacza podpęcherzowy odcinek cewki moczowej męskiej, tworzy mechanizm zwieraczowy wewnętrzny cewki. Poniżej stercza funkcjonuje zwieracz zewnętrzny. W obrębie cewki sterczowej uchodzą kanaliki wytryskowe odpowiedzialne za ejakulację powstającą przy udziale sąsiadujących z gruczołem krokowym pęcherzyków nasiennych (vesicula seminalis). Wydzielina sterczowa stanowi środowisko pozwalające utrzymać aktywność plemników poza organizmem, zawiera enzym upłynniający nasienie (prostatic specific antygen – PSA) umożliwiający ruch plemników. Wartość kliniczna PSA oznaczanego w surowicy okazała się niezwykle istotna w wykrywaniu i ocenie chorób gruczołu krokowego (zapalenie, rozrost, nowotwory). Ponadto w pęcherzykach nasiennych wytwarzane są hormony tkankowe (prostaglandyny PGE PGF) o skurczowym działaniu miejscowym, wpływającym na ruchliwość plemników. Embriologicznie stercz tworzy się z elementów mezechymalnych przegrody moczowo-odbytowej w miejscu wnikania przewodu śródnerczowego (Wolffa) do zatoki moczowo-płciowej. Embriogeneza stercza zbiega się z tworzeniem trójkąta pęcherza moczowego, ujść moczowodów, wzgórka nasiennego z kanalikami wytryskowymi z dystalnego odcinka przewodu Wolffa. Gruczoł krokowy stanowi centralny punkt męskiego układu moczowo-płciowego, w którym koncentrują się mechanizmy prawidłowej mikcji i ejakulacji. Schorzenia gruczołu krokowego zagrażają w sposób bezpośredni lub pośredni narządom moczowo-płciowym od nerek po jądra.
Anatomia stercza
Gruczoł krokowy wykazuje budowę strefową (ryc. 1). Wyróżnia się strefę obwodową, centralną, przejściową i spoidłową. W okolicy okołocewkowej tzw. strefa przejściowa jest miejscem właściwego rozrostu kanalików gruczołowych i zrębu wywołujących BPH. Powiększanie strefy przejściowej stającej się gruczolakiem stercza (adenoma prostatae) oraz aktywność mięśniowa cewki i szyi pęcherza moczowego poprzez ucisk wywołują przeszkodę podpęcherzową (pp) w odpływie moczu. Istnienie pp w przebiegu BPH jest podstawowym wskazaniem do leczenia farmakologicznego, a następnie zabiegowego. Rozciąganie i modelowanie szyi pęcherza moczowego wywołuje objawy podrażnieniowe na poziomie pęcherza i cewki (lower urinary tract symptoms – LUTS) oraz wtórną nadreaktywność mięśnia wypieracza pęcherza moczowego (overactive bladder – OAB). Objawy te mogą być skutecznie leczone farmakologicznie. Strefa obwodowa gruczołu krokowego dostępna poprzez ścianę odbytnicy w badaniu per rectum (digital rectal examination – DRE) jest najczęstszym miejscem powstawania nowotworu z powodu dużej podatności elementów zrębowych tej strefy na dyshormonemię: oddziaływaniem testosteronu i estrogenizacją związaną z wiekiem. Strefa obwodowa stercza w dużych gruczolakach tworzy tzw. torebkę chirurgiczną, gdyż spychana i uciskana ku obwodowi stanowi niewielki odsetek jego masy. Strefa ta jest również dostępna badaniu ultrasonograficznemu wykonanemu sondą przezobytniczą (transrectal ultrasound – TRUS). W ten sposób można ujawnić podejrzane ogniska przebudowy tkankowej, szczególnie położone śródmiąższowo oraz poddać je biopsji w diagnostyce raka stercza. Strefa centralna o przeważającej budowie mięśniowej, położona doodbytniczo i powyżej strefy obwodowej, znajduje się w miejscu wnikania kanalików wytryskowych łączących gruczoł krokowy z pęcherzykami nasiennymi. Jest to miejsce odpowiedzialne za ejakulację. Część przednia spoidłowa (głównie łącznotkankowa i mięśniowa) dopełnia stercz od przedniej części cewki moczowej i jest obszarem o najmniejszej podatności na zmiany chorobowe.
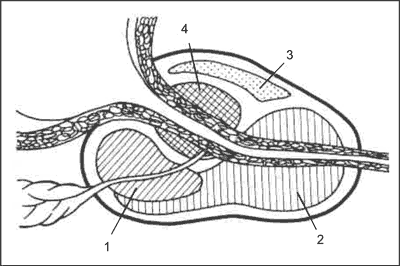
Ryc. 1. Strefowa budowa gruczołu krokowego. 1 – strefa centralna, 2 – strefa obwodowa, 3 – spoidło, 4 – strefa przejściowa
Etiologia bph
Przyczyną powstawania gruczolaka powodującego BPH jest zaburzenie równowagi hormonalnej, postępującej z wiekiem, wynikającej ze zmniejszenia aktywności testosteronu i względnej estrogenizacji. Do dyshormonemii dochodzi z powodu zmniejszenia aktywności podwzgórza i przysadki, w mniejszym stopniu gonad i nadnerczy. Estrogenizacja stercza powoduje rozrost elementów stromalnych (podścieliskowych). Testosteron na poziomie komórkowym przekształca się w dihydrotestosteron (DHT) przy pomocy enzymu 5 alfa reduktazy, uaktywniając czynniki wzrostu (growth factors), powodujące przewagę proliferacji nad zaprogramowaną śmiercią komórkową (apoptosis). Brak jest potwierdzonych danych dotyczących profilaktyki w BPH. Z danych epidemiologicznych wynika, że o wielkości gruczolaka decydują predyspozycje genetyczne, można jednak spowalniać jego wzrost poprzez redukowanie wartości kalorycznej pokarmów, obniżanie zawartości tłuszczów w diecie i wzbogacanie jej produktami sojowymi. Cukrzyca sprzyja rozwojowi BPH, głównie z powodu wcześniejszego występowania objawów czynnościowych (LUTS), będących następstwem neuropatii w zakresie receptorów czuciowych pęcherza i cewki.
Definicja, objawy, klasyfikacja bph
W teorii BPH definiujemy jako proces łagodnego histologicznego rozrostu cew gruczołowych i zrębu. Jest to więc przyrost masy stercza przez histologicznie prawidłowe elementy gruczołowe, łącznotkankowe i mięśniowe w różnej konfiguracji procentowej. Z tego względu, iż nie wykonuje się badań histologicznych we wczesnym okresie rozwoju, łagodny rozrost stercza w praktyce oznacza obecność gruczolaka o objętości powyżej 20-25 ml (ocenianej na podstawie badań obrazowych lub badania per rectum – DRE), objawy kliniczne powyżej 7 punktów w wystandaryzowanym kwestionariuszu (International Prostatic Symptoms Score – IPSS) oraz trwałe osłabienie strumienia moczu manifestujące się przepływem cewkowym niższym niż 15 ml/s w badaniu uroflowmetrycznym.
Pełny kliniczny obraz BPH opisywany jest jako niezależny zbiór zjawisk anatomicznych, czynnościowych i klinicznych. Obejmuje on:
1. powiększenie stercza (E – enlargement),
2. przeszkodę w odpływie moczu (O – obstruction) z następstwami wymienionymi w punkcie 7,
3. objawy czynnościowe (tzw. podrażnieniowe) z dolnych dróg moczowych (LUTS), w tym najczęściej występującą nadreaktywność wypieraczową (OAB – overactive bladder),
4. zaburzenia seksualne (ED – erectile disfunction): osłabienie libido, erekcji i zaburzenia ejakulacji,
5. zaburzenia wynikające z niestabilności pęcherza (BD – bladder destability), np. przerost masy mięśniowej w wyniku przeszkody podpęcherzowej,
6. objawy psychologiczne, emocjonalne związane ogólnie ze starzeniem się,
7. wtórne następstwa przeszkody podpęcherzowej (pp): zakażenia, zapalenie pęcherza, zapalenie gruczołu krokowego, zapalenie najądrza i dróg nasiennych, kamica pęcherza, uchyłki pęcherza, zastój w górnym piętrze układu moczowego, niewydolność nerek.
BPH przebiega w czterech fazach zaawansowania (wg Alkena/Vahlensiecka):
I° – bezobjawowa (obecny rozrost anatomiczny i histologiczny),
II° – z przewagą objawów podrażnieniowych LUTS,
III° – z przewagą objawów przeszkody podpęcherzowej,
IV° – z obecnością następstw przeszkody podpęcherzowej.
Dla lekarza rodzinnego szczególnie istotne jest uchwycenie początkowych objawów podrażnieniowych (LUTS) przy pomocy kwestionariusza objawów, które uzasadniają wdrożenie leczenia farmakologicznego. Objawy te to: częstomocz dzienny i nocny (nocturia), parcia na mocz, nietrzymanie moczu z parcia, wykapywanie moczu po mikcji. Do objawów przeszkodowych należą: osłabienie strumienia moczu, wydłużenie czasu mikcji i wyczekiwanie na nią, oddawanie moczu z wysiłkiem, uczucie zalegania moczu w pęcherzu po mikcji, aż do całkowitego zatrzymania moczu (retentio urinae completa – RUC; ang. acute urinary retention – AUR), czyli konieczność odprowadzenia moczu przy użyciu cewnika.
Szczególną sytuacją kliniczną w przebiegu BPH jest całkowite zatrzymanie moczu. Świadczy ono o progresji BPH i często stwarza konieczność leczenia zabiegowego. Niezależnymi czynnikami podwyższonego ryzyka zatrzymania moczu są: wiek powyżej 65 lat, PSA wyższe niż 2,5 ng/ml, objętość stercza przewyższająca 40-50 ccm (ml) oraz objawy oceniane na 19 i więcej punktów w skali IPSS. Całkowite zatrzymanie moczu zaopatrywane jest najczęściej przy użyciu miękkiego, samoutrzymującego się cewnika Foleya. Rozmiary cewników numerowane są co 2 stopnie w tzw. skali Charierre (Ch) nazywanej też skalą francuską (F); najczęściej używane cewniki to 14-18 F.
Diagnostyka bph
W diagnostyce BPH wykorzystuje się wywiad kliniczny (kwestionariusz IPSS), badanie fizykalne (w tym per rectum), badania obrazowe (np. USG), czynnościowe (badanie przepływu cewkowego – uroflowmetria lub pełne badanie urodynamiczne) oraz laboratoryjne (badanie ogólne moczu, poziom PSA w surowicy, poziom mocznika i kreatyniny). Celem diagnostyki jest ustalenie stopnia rozwoju BPH, potwierdzenie istnienia przeszkody podpęcherzowej oraz określenie wymiarów gruczołu krokowego.
Pacjent kierowany przez lekarza rodzinnego do konsultacji specjalistycznej powinien być przez niego zbadany per rectum, powinien mieć wykonaną USG z oceną zalegania moczu po mikcji, oznaczony poziom kreatyniny w surowicy oraz badanie ogólne moczu.
Kwestionariusz objawów mikcyjnych – IPSS, przyjęty przez Europejskie Towarzystwo Urologiczne (EUA) jest najbardziej rozpowszechnionym w Europie zwięzłym sposobem oceny charakteru objawów klinicznych BPH i ich gradacji (tab. 1). IPSS stanowić może pomoc przy wyborze postępowania leczniczego (obserwacja, farmakoterapia, leczenie zabiegowe) oraz w prognozowaniu progresji choroby (zatrzymania moczu). Słabszą stroną kwestionariusza jest możliwy brak pełnego zrozumienia pytań przez pacjentów oraz podkreślany przez wielu autorów możliwy brak korelacji z obiektywnymi badaniami, jak przepływ cewkowy czy też zaleganie moczu w pęcherzu po mikcji.
Tabela 1. Kwestionatriusz IPSS – międzynarodowa skala objawów towarzyszących chorobom gruczołu krokowego.
| 1 – Jak często w ostatnim miesiącu miał Pan: | nigdy | sporadycznie | rzadko | co drugi raz | często | prawie zawsze |
| uczucie niepełnego opróżnienia pęcherza moczowego? | 0 | 1 | 2 | 3 | 4 | 5 |
| częstomocz dzienny częstszy niż co 2 godziny | 0 | 1 | 2 | 3 | 4 | 5 |
| przerywany strumień moczu | 0 | 1 | 2 | 3 | 4 | 5 |
| nagłe parcie na mocz | 0 | 1 | 2 | 3 | 4 | 5 |
| słaby strumień moczu (w ocenie własnej) | 0 | 1 | 2 | 3 | 4 | 5 |
| utrudniony początek oddawania moczu | 0 | 1 | 2 | 3 | 4 | 5 |
| konieczność nocnych oddawań moczu | 0 razy | 1 raz | 2 razy | 3 razy | 4 razy | 5 razy lub więcej |
| 2 – Jak ocenia Pan ogólnie swoje oddawanie moczu | bardzo
dobre | raczej dobre | dobre | średnie | złe | bardzo
złe |
Pacjent odpowiada na 7 pytań i punktuje każdą odpowiedź w zależności od częstości danego zjawiska od 0 do 5 punktów. Dodatkowe pytanie dotyczące jakości życia w aspekcie oddawania moczu jest pytaniem kwalifikującym do zmiany taktyki postępowania leczniczego, np. do zastosowania leczenia zabiegowego.
Lekarz rodzinny powinien posiadać i używać kwestionariusz IPSS, gdyż pomaga on zobiektywizować ocenę mikcji dokonywaną przez pacjenta. Niski wynik IPSS (do 7 punktów) umożliwia podjęcie decyzji o obserwacji lub leczeniu lekami ziołowymi. Wynik 7-19 punktów świadczy o znamiennym występowaniu objawów mikcyjnych i wskazaniu do konsultacji urologicznej lub wdrożeniu leczenia farmakologicznego, powyżej 19 punktów świadczy o podwyższonym ryzyku progresji choroby i nakazuje rozważenie leczenia zabiegowego.
Badanie per rectum (digital recital examinatio – DRE) ma na celu określenie orientacyjnych wymiarów gruczołu krokowego i jego konsystencji oraz wykrycie ewentualnych zmian ogniskowych w zakresie torebki stercza wskazujących raka lub stan zapalny. Badanie umożliwia również rozpoznanie patologii w zakresie odbytu. Dlatego powinno być wykonywane przesiewowo u pacjenta powyżej 45-50 roku życia zgłaszającego się do lekarza urologa lub lekarza POZ, niezależnie od zgłaszanych objawów klinicznych. Średnica gruczołu krokowego oceniona na ok. 3 cm w badaniu DRE ujawnia brak powiększenia stercza, czyli jest równoznaczna z objętością stercza poniżej 20 ccm (ml). Stercz o średnicy 4-5 cm to najczęściej stwierdzany stan powiększenia gruczołu krokowego u badanych pacjentów po 60 roku życia. Średnica powyżej 6 cm na ogół uniemożliwia palpację głębiej położonych obszarów torebki stercza, dlatego uzupełnieniem badania bywa ultrasonografia. Prawidłowy gruczoł krokowy ma spoistość dojrzałej mandarynki lub pomarańczy, jest elastyczny i sprężysty po uciśnięciu. Wszelkie odchylenia w zakresie spoistości, asymetria wymiarów obu płatów względem bruzdy pośrodkowej, zmiany ogniskowe pod postacią zgrubień i stwardnień (rak) lub – przeciwnie – ognisk miękkich (stany zapalne) powinny być powodem konsultacji urologicznej. DRE w przypadku stanu zapalnego może być szczególnie bolesne.
Dla lekarza rodzinnego badanie per rectum powinno być obowiązkiem, dostarczającym podstawowych informacji o stanie gruczołu krokowego, w tym przede wszystkim o wyczuwalnych zmianach nasuwających podejrzenie nowotworu.
Ultrasonografię w diagnostyce BPH wykorzystuje się w celu oznaczenia wymiarów gruczołu krokowego i obliczenia objętości moczu zalegającego po mikcji oraz zobrazowania następstw przeszkody podpęcherzowej (kamicy pęcherza, uchyłków, wodonercza, itp.). Wykorzystuje się dwa rodzaje ultrasonografii: przezpowłokową (transabdominal ultrasonography – TAUS) oraz przezodbytniczą (transrectal ultrasonography – TRUS). TAUS jest badaniem uniwersalnym układu moczowego. Służy do oceny nerek, nadnerczy, moczowodów, pęcherza moczowego, gruczołu krokowego, zalegania po mikcji oraz umożliwia badanie pozostałych narządów jamy brzusznej. Badanie TRUS polega na ocenie gruczołu krokowego i przylegających do niego tkanek poprzez użycie sondy doodbytniczej. Badanie umożliwia dokładne obliczenie masy stercza, zobrazowanie podziału strefowego, wykrycia zmian ogniskowych podejrzanych o nowotwór lub stan zapalny. Ultrasonografia (TAUS i TRUS) nie pozwala różnicować BPH i raka stercza, a jedynie wykazuje odchylenia prawidłowej echostruktury i symetrii (ryc. 2A, B). Podejrzane ogniska, szczególnie hipoechogenne w strefie obwodowej są wskazaniem do biopsji diagnostycznej przezobytniczej lub przezkroczowej. Pomocne w tym zakresie jest użycie funkcji Color-Doppler, umożliwiającej ocenę unaczynienia podejrzanych obszarów. Ultrasonografia pomimo swojego statycznego charakteru dostarcza informacji świadczących o istnieniu przeszkody podpęcherzowej. Pogrubiała ściana pęcherza, obecność beleczkowania (tzw. trabekulacji) i uchyłków, zaleganie moczu po mikcji to ultrasonograficzne cechy pp. Należy podkreślić, że warunkiem dobrego badania jest odpowiednie wypełnienie (ale nie przepełnienie) pęcherza. Nie należy zatem polecać pacjentowi picia zwiększonej ilości płynów, wystarczy bowiem powstrzymanie się od mikcji przez okres 2-3 godzin przed badaniem. Zaleganie po mikcji przekraczające 150-200 ml grozi całkowitym zatrzymaniem moczu i jest złym czynnikiem rokowniczym przy kontynuacji leczenia farmakologicznego.
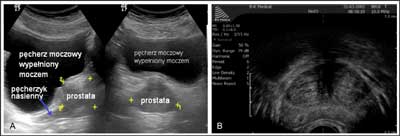
Ryc. 2. Obraz badania ultrasonograficznego stercza. A. TAUS – przezpowłokowa w dwóch projekcjach: bocznej i strzałkowej. B. TRUS – doodbytnicza obrazującą gruczoł krokowy z podziałem strefowym.
Uroflowmetria (UFM) – badanie przepływu cewkowego służy do zobrazowania naturalnej mikcji pacjenta w postaci wykresu, a głównym celem badania jest wykrycie przeszkody podpęcherzowej w sposób nieinwazyjny. Badanie polega na oddaniu moczu do urządzenia mierzącego prędkość wypływu moczu z cewki moczowej, jest częścią pełnego badania urodynamicznego i dotyczy fazy opróżniania pęcherza. Uroflowmetr umożliwia obliczenie maksymalnego i średniego przepływu cewkowego, czasu mikcji, objętości moczu wydalonego, a ponadto obrazuje krzywą mikcji w czasie i w niektórych przypadkach automatycznie określa istnienie lub brak przeszkody podpęcherzowej (ryc. 3). Maksymalny przepływ cewkowy (Qmax) ponad 25 ml/s praktycznie wyklucza pp, niższy niż 15 ml/s, a zwłaszcza niż 5 ml/s świadczy o znamiennie osłabionym strumieniu moczu i dużym podejrzeniu pp. Qmax poniżej 5 ml/s u pacjentów leczonych farmakologicznie jest często powodem kwalifikowania ich do zabiegowego leczenia BPH. Prawidłowa interpretacja wyniku przepływu cewkowego wymaga objętości co najmniej 150 ml wydalonego moczu.
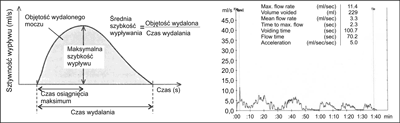
Ryc. 3. Uroflowmetria. Wykres przepływu cewkowego prawidłowy (po lewej) oraz przy istniejącej przeszkodzie podpęcherzowej.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł



