© Borgis - Postępy Fitoterapii 3/2015, s. 172-176
*Bogdan Kędzia, Elżbieta Hołderna-Kędzia
Występowanie metyloglioksalu w miodzie manuka i jego oddziaływanie na organizm człowieka
Occurence of methylglyoxal in manuka honey and its influence on human body
Instytut Włókien Naturalnych i Roślin Zielarskich w Poznaniu
Dyrektor Instytutu: prof. dr hab. Grzegorz Spychalski
Summary
Synthesis of methylglyoxal in manuka honey and its content in the different honey varieties and some food products has been ascribed. Moreover, the methylglyoxal toxicity in experimental animals was assessed. Possible effects on human body after oral intake and especially results of treatment of diabetic wounds using manuka honey were also established. Based on toxicological studies it can be assumed that methylglyoxal content in manuka honey does not have harmful effects on person health.

Badania z ostatnich lat, dotyczące wysokiej aktywności antybiotycznej miodu manuka wykazały, że za tę właściwość odpowiedzialny jest metyloglioksal, związek występujący w nektarze rośliny Leptospermum scoparium. Na tym tle powstaje szereg pytań, a mianowicie: w jaki sposób tworzy się metyloglioksal w tej odmianie miodu, jaka jest jego toksyczność, a także oddziaływanie na organizm człowieka, zarówno po podaniu doustnym, jak i zastosowaniu miejscowym. Niniejsze opracowanie ma na celu wyjaśnienie powyższych zagadnień w oparciu o dotychczasowe dane z piśmiennictwa.
Tworzenie się metyloglioksalu w miodzie manuka
Yadav i wsp. (1) podają, że metyloglioksal jest produktem pośrednim w przemianie metabolicznej fosforanów trioz (trójwęglowych pochodnych cukrów prostych, m.in. glukozy i fruktozy), takich jak fosforan dihydroacetonu i 3-fosforan aldehydu glicerynowego. Związki te powstają w komórkach organizmów wyższych (roślin, zwierząt i ludzi). Mogą one także gromadzić się wewnątrz komórek pod wpływem działalności enzymów: izomerazy fosforanowej trioz oraz syntazy metyloglioksalowej.
Według Adamsa i wsp. (2) metyloglioksal występuje w nektarze nowozelandzkiego miodu manuka wraz z dihydroksyacetonem. Nazywane są one związkami 1,2-karbonylowymi. Autorzy w 9 próbkach świeżego dojrzałego miodu manuka stwierdzili obecność od 139 do 491 mg/kg metyloglioksalu, a także od 1192 do 5099 mg/kg dihydroksyacetonu. Okazało się, że w trakcie przechowywania tych próbek miodu w temp. 37°C poziom metyloglioksalu na przestrzeni 30 tyg. systematycznie wzrastał, podczas gdy poziom dihydroksyacetonu jednocześnie w tym czasie malał (ryc. 1).
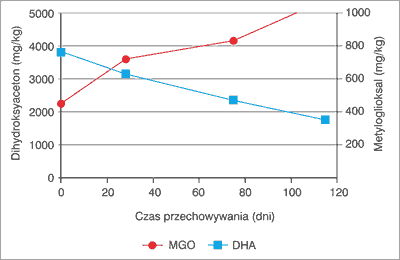
Ryc. 1. Wpływ przechowywania próbki miodu manuka M165 na tworzenie się metyloglioksalu z dihydroksyacetonu (1).
DHA – dihydroksyaceton, MGO – metyloglioksal
Ponadto dihydroksyaceton dodany do miodu koniczynowego (zawierającego 31 mg/kg metyloglioksalu) w ilości 6190 mg/kg, po 30 tyg. przechowywania w temp. 37°C zawierał 1107 mg/kg metyloglioksalu.
Na tej podstawie autorzy doszli do wniosku, że metyloglioksal w miodzie manuka, przechowywanym przez dłuższy okres czasu, tworzy się dodatkowo na skutek reakcji odwodnienia z dihydroksyacetonu (ryc. 2).
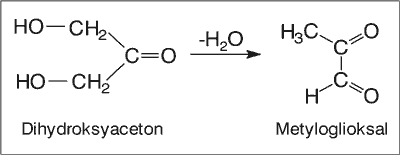
Ryc. 2. Tworzenie się metyloglioksalu w miodzie manuka na drodze reakcji odwodnienia dihydroksyacetonu.
Skąd jednak w miodzie manuka znajduje się tak duża zawartość metyloglioksalu w porównaniu z innymi miodami nektarowymi? Dotyczy to zarówno innych miodów nowozelandzkich, jak i wszystkich znanych miodów nektarowych na świecie.
Yadav i wsp. (1) zaobserwowali, że niektóre rośliny, m.in. transgeniczny tytoń oraz różne odmiany ryżu, pod wpływem zwiększonego zasolenia gleby, suszy i zimna zawierają w korzeniach, liściach i pędach nadziemnych od 2 do 6 razy więcej metyloglioksalu niż w trakcie normalnych warunków uprawy.
Dla przykładu w korzeniach odmiany ryżu IR64 w normalnych warunkach uprawy znajdowało się 1980 mg/kg metyloglioksalu, podczas gdy w warunkach zwiększonego zasolenia gleby wartość ta wzrosła do 8960 mg/kg, suszy – do 13730 mg/kg, a zimna – do 5290 mg/kg. Uważa się, że metyloglioksal jest dla roślin wskaźnikiem stresu, jaki towarzyszy niekorzystnym warunkom ich rozwoju. Autorzy sądzą, że pod wpływem stresu zostaje zaburzony proces usuwania tego związku z rośliny, polegający na rozkładzie enzymatycznym metyloglioksalu za pośrednictwem glioksalazy I i II, przy współudziale zredukowanego glutationu. W wyniku tego procesu powstaje D-mleczan (ryc. 3).
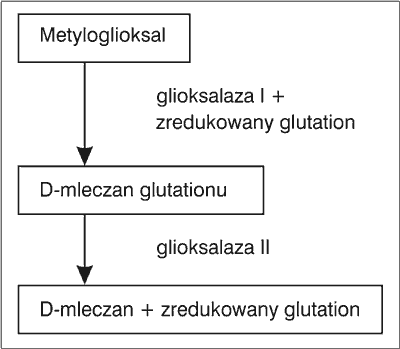
Ryc. 3. Enzymatyczny rozkład metyloglioksalu zachodzący w tkankach roślinnych (2).
Na tej podstawie można przypuszczać, że wysoki poziom metyloglioksalu w miodzie manuka jest wynikiem braku enzymów rozkładających ten związek w nektarze wytwarzanym przez kwiaty Leptospermum scoparium lub powstaje na drodze innych zaburzeń tego procesu detoksykacyjnego. Metyloglioksal usuwany jest z komórek roślinnych ze względu na jego działanie cytotoksyczne (2).
Zawartość metyloglioksalu w miodzie manuka i innych odmianach miodu
Badania Mavrica i wsp. (3), Adamsa i wsp. (4) oraz Atrotta i Henlego (5) wyraźnie wskazują, że miód manuka zawdzięcza swoją nienadtlenkową aktywność antybiotyczną (po unieczynnieniu enzymu oksydazy glukozy, powodującego powstawanie nadtlenku wodoru z glukozy) obecności metyloglioksalu.
Mavric i wsp. (3) ustalili, że zawartość metyloglioksalu w 6 próbkach miodu manuka wynosiła od 38 do 761 mg/kg. Adams i wsp. (4) w 49 próbkach miodu manuka oznaczyli poziom metyloglioksalu w granicach od 38 do 709 mg/kg. Z kolei Atrott i Henle (5) podają, że zawartość tego związku w 61 próbkach miodu manuka mieściła się w przedziale od 189 do 835 mg/kg. Biorąc pod uwagę wszystkie badania, jako przeciętną wartość można przyjąć 410 mg/kg metyloglioksalu w omawianej odmianie miodu.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Yadav SK, Siugla-Pareek SL, Ray M i wsp. Methylglyoxal levels in plants under salinity stress are dependent on glyoxalase I and glutathione. Biochem Biophys Res Commun 2005; 337:61-7. 2. Adams CJ, Manley-Harris M, Molan PC. The origin of methylglyoxal in New Zealand manuka (Leptospermum scoparium) honey. Carbohydr Res 2009; 344:1050-3. 3. Mavric E, Wittmann S, Barth G i wsp. Identification and quantification of methylglyoxal as the dominant antibacterial constituent of manuka (Leptospermum scoparium) honeys from New Zealand. Mol Nutr Food Res 2008; 52:483-9. 4. Adams CJ, Boult CH, Deadman BJ i wsp. Isolation by HPLC and characterization of the bioactive fraction of New Zealand manuka (Leptospermum scoparium) honey. Carbohydr Res 2008; 343:651-9. 5. Atrott J, Henle T. Methylglyoxal in manuka honey – correlation with antibacterial properties. Czech J Food Sci 2009; 27:S163-5. 6. Weigel KU, Opitz T, Henle T. Studies on the occurrence and formation of 1,2-dicarbonyls in honey. Eur Food Res Technol 2004; 218:147-51. 7. Hayashi T, Shibamoto T. Analysis of methylglyoxal in foods and beverages. J Agric Food Chem 1985; 33:1090-3. 8. Revel de G, Bertrand A. A method for the detection of carbonyl compounds in wine: Glyoxal and methylglyoxal. J Sci Food Agric 1993; 61:267-72. 9. Vasdev S, Ford CA, Longerich L i wsp. Aldehyde induced hypertension in rats: Prevention by N-acetyl cysteine. Artery 1998; 23(1):10-36. 10. Golej J, Hoeger H, Radner W i wsp. Oral administration of methylglyoxal leads to kidney collagen accumulation in the mouse. Life Sci 1998; 63(9):801-7. 11. Ankrah N-A, Oppiah-Opong R. Toxicity of low levels of methylglyoxal: Depletion of blood glutathione and adverse effect on glucose tolerance in mice. Toxicol Lett 1999; 109:61-7. 12. Ghosh M, Talukdar D, Ghosh S i wsp. In vivo assessment of toxicity and pharmacokinetics of methylglyoxal. Augmentation of the curative effect of methylglyoxal on cancer-bearing mice by ascorbic acid and creatine. Toxicol Appl Pharmacol 2006; 212:45-58. 13. Lapolla A, Flamini R, Vedora AD i wsp. Glyoxal and methylglyoxal levels in diabetic patients: Quantitative determination by a new GC/MS method. Clin Chem Lab Med 2003; 41(9):1166-73. 14. Majtan J. Methylglyoxal A potential risk factor of manuka honey in healing of diabetic ulcers. Erid Based Complement Alternat Med 2011; 2011:295494. 15. Gethin G, Cowman S. Case series of use of manuka honey in leg ulceration. Int Wound J 2005; 2(1):10-5. 16. Chong SAC, Lee W, Arora PD i wsp. Methylglyoxal inhibits the binding step of collagen phagocytosis. J Biol Chem 2007; 282 (11):8510-20. 17. Goova MT, Li J, Kislinger T i wsp. Blockade of receptor for advanced glycation end-products restores effective wound healing in diabetic mice. Am J Pathol 2001; 159(2):513-25. 18. Peppa M, Brem H, Ehrlich P i wsp. Adverse effects of dietary glycotoxins on wound healing in genetically diabetic mice. Diabetes 2003; 52:2805-13. 19. Peppa M, Stavroulakis P, Raptis SA. Advanced glycoxidation products and impaired diabetic wound healing. Wound Rep Reg 2009; 17:461-72. 20. Berlanga J, Cibrian D, Guill?n I i wsp. Methylglyoxal administration induces diabetes-like microvascular changes and perturbs the healing process of cutaneous wounds. Clin Sci 2005; 109:83-95. 21. Kamaratos AV, Tzirogiannis KN, Iraklianou SA i wsp. Manuka honey-impregnated dressings in the treatment of neuropathic diabetic foot ulcers. Int Wound J 2012; 2012:1082.x.



