© Borgis - Postępy Nauk Medycznych 2/2016, s. 97-99
Agata Gieleżyńska1, 3, *Jadwiga Fabijańska-Mitek1, Marzena Dębska2
Wykrywanie przecieku płodowo-matczynego przy użyciu aglutynacyjnego testu mikrokolumnowego
1Department of Immunohaematology, Centre of Postgraduate Medical Education, Warsaw
Head of Department: Jadwiga Fabijańska-Mitek, PhD, Associate Professor
2II Department of Obstetrics and Gynaecology, Centre of Postgraduate Medical Education, Warsaw
Head of Department: Romuald Dębski, MD, PhD, Associate Professor
3Regional Blood Donation and Therapy Centre in Warsaw
Head of the Centre: Dariusz Piotrowski, MD
1Department of Immunohaematology, Centre of Postgraduate Medical Education, Warsaw
Head of Department: Jadwiga Fabijańska-Mitek, PhD, Associate Professor
2II Department of Obstetrics and Gynaecology, Centre of Postgraduate Medical Education, Warsaw
Head of Department: Romuald Dębski, MD, PhD, Associate Professor
3Regional Blood Donation and Therapy Centre in Warsaw
Head of the Centre: Dariusz Piotrowski, MD
Streszczenie
Wstęp. Ilościowa ocena przecieku płodowo-matczynego krwinek czerwonych ma istotne znaczenie w doborze dawki Ig anty-D w profilaktyce choroby hemolitycznej płodu/noworodka. Wykonuje się ją zazwyczaj za pomocą testu mikroskopowego oraz z zastosowaniem cytometrii przepływowej.
Cel pracy. Celem badań było wdrożenie i ocena aglutynacyjnego testu kolumnowego ID-FMH Screening-Test (DiaMed, Szwajcaria) do wykrywania krwinek RhD dodatnich płodu w krwi RhD ujemnej matki.
Materiał i metody. Próbki krwi dawców: 10 RhD dodatnich i 12 RhD ujemnych, z których sporządzono 54 mieszaniny o procentowości: 0,1%; 0,2%; 0,4% i > 0,4% (0,5-1,0%) oraz 14 firmowych zestawów: 0% (kontrola ujemna); 0,1%; 0,2%; 0,4% (łącznie 110 próbek).
Wyniki. W 54% próbek niezawierających krwinek RhD dodatnich uzyskano reakcje nieswoiste, które fałszywie sugerowały obecność 0,1% lub 0,2% takich krwinek. W 50% próbek o stężeniu 0,4% krwinek RhD dodatnich i we wszystkich próbkach zawierających > 0,4% takich krwinek reakcje były zgodne z oczekiwanymi.
Wnioski. Aglutynacyjny test na obecność krwinek płodowych RhD dodatnich w krwi matki może być testem przesiewowym do wykrywania dużego przecieku płodowo-matczynego (> 0,4%, czyli > 9 ml krwinek). W takich przypadkach, w celu zastosowania odpowiedniej dawki Ig anty-D konieczne jest dalsze badanie z użyciem cytometrii przepływowej.
Summary
Introduction. Quantitative evaluation of fetomaternal haemorrhage is important for the selection of the dose of anti-D Ig in the prevention of haemolytic disease of the fetus/newborn. It is usually performed using the microscopic test and flow cytometry.
Aim. The aim of this study was to implement and evaluate column agglutination method ID-FMH Screening-Test (DiaMed, Switzerland) for the detection of RhD positive fetal RBCs in the blood of RhD negative mothers.
Material and methods. Blood samples of donors: 10 RhD positive and 12 RhD negative used to prepare 54 mixtures: 0.1%; 0.2%; 0.4% and > 0.4% (0.5-1.0%) and 14 commercial sets of mixtures: 0% (negative control); 0.1%; 0.2%; 0.4%.
Results. In 54% of the samples without the RhD positive RBCs non-specific reactions were obtained, which falsely suggested the presence of 0.1% or 0.2% of such cells. In 50% of the samples with the concentration of 0.4% RhD positive blood cells and in all the samples containing > 0.4% of such cell reactions were as expected.
Conclusions. The agglutination test for the presence of fetal RhD positive RBCs in the mother’s blood may be a screening test for the detection of a large fetomaternal haemorrhage (> 0.4% means > 9 ml RBCs). In such cases, in order to apply an appropriate anti-D Ig dose further tests are necessary using flow cytometry.

Introduction
Antibodies that cause haemolytic disease of the fetus and newborn (HDFN) are IgG antibodies made in response to exposure of fetal red blood cells (RBCs) during pregnancy and delivery. The most common antibodies found to cause HDFN are directed against D, c, K, C, E, Fya antigens on the fetal RBCs. There are the following severe symptoms of HDFN: anaemia, hepatic dysfunction, hydrops fetalis, heart failure, brain damage by the unconjugated bilirubin crossing the blood--brain barrier and even death. In such cases, intrauterine transfusions are needed to save the fetus (1-4). Mothers can be alloimmunised to RBC antigens because of spontaneous haemorrhage of fetal RBCs into the maternal circulation. The volumes of fetomaternal haemorrhage (FMH) are usually small, about 0.5 ml of erythrocytes. In 1% of mothers FMH is bigger than 3 ml and in 0.3% bigger than 15 ml. Number of HDFN cases due to anti-D has been reduced since specific immunoprophylaxis was introduced in the ‘70s. Anti-D immunoglobulin (Ig) neutralizes RhD positive fetal RBCs in the circulation of mother and protects her against alloimmunization (4-8). The postpartum standard dose of anti-D Ig in Poland is 150 μg, which can neutralize 7.5 ml of fetal RhD positive RBCs. In other countries, anti-D Ig doses vary from 100 to 300 μg. Despite of the use of immunoprophylaxis, from 1 to 2% women produce allo-anti-D. In some countries (for example United Kingdom, Ireland), all RhD negative mothers are tested after labour for detection and quantification of FMH and if it is necessary, the dose of anti-D Ig is increased. Microscopic or flow cytometry tests usually base on detection of the cells containing fetal haemoglobin (HbF) between cells with adult haemoglobin (HbA). If a test for the detection of RhD antigen is used, it is applicable only when the mother is RhD negative and the fetus is RhD positive. Results from flow cytometry tests with anti-HbF or anti-RhD have very good sensitivity and specificity but these methods require special expensive equipment (9-16). Gel agglutination technique to screen the FMH could be used in many serological laboratories, where serological gel microcolumn tests for grouping, crossmatching and antibody screening (DiaMed, Switzerland) are routinely performed. It is semiquantitative method based on the consumption of anti-D antibodies by RhD positive fetal RBCs, indirectly measured by the use of RhD positive indicator RBCs. When fetal RhD positive RBCs are absent or their percentage is smaller than 0.1%, the reaction with indicator cells is strong (4+), but when in mother’s blood sample there is > 0.4% of fetal cells, all anti-D bind to fetal antigens and reaction with indicator cells is negative (fig. 1).
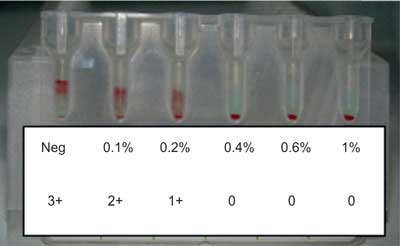
Fig. 1. Example of the results for FMH Screening-Test
Aim
The aim of this study was to implement and evaluate column agglutination method ID-FMH Screening-Test (DiaMed, Switzerland) for the detection of RhD positive fetal RBCs in the blood of RhD negative mothers.
Material and methods
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Butch SH: Hemolytic disease of the fetus and newborn. [In:] Quinley ED (ed.): Immunohematology: Principles and Practice. Ed. 3. Wolters Kluwer/Lippincott Williams and Wilkins, 2011: 283-296.
2. Kennedy MS: Perinatal issues in transfusion practice. [In:] Roback JD, Combs MR, Grossman BJ, Hillyer CD (ed.): Technical Manual. Ed. 16. AABB 2008: 625-638.
3. Klein HG, Anstee DJ: Haemolytic disease of the fetus and newborn. [In:] Klein HG, Anstee DJ: Mollison's blood transfusion in clinical medicine. Ed. 12. Wiley Blackwell 2014: 522-527.
4. de Haas M, Thurik FF, Koelrwijn JM et al.: Haemolytic disease of the fetus and newborn. Vox Sang 2015; 109: 99-113.
5. Sebring ES, Polesky HF: Fetomaternal hemorrhage: incidence, risk factors, time of occurance, and clinical effects. Transfusion 1990; 30: 344-357.
6. Royal College of Obstetricians and Gynaecologists: The use of anti-D immunoglobulin for rhesus D prophylaxis. Green Top Guideline 2011; 22: 1-14.
7. Royal College of Physicians of Ireland: The use of anti-D immunoglobulin for the prevention of RhD haemolytic disease of newborn. Clinical Practice Guideline 2012; 13: 1-18.
8. BCSH guideline for the use of anti-D immunoglobulin for the prevention of haemolytic disease of the fetus and newborn. Transfus Med 2014; 24: 8-20.
9. Chen JC, Davis BH, Wood B et al.: Multicenter clinical experience with flow cytometric method for fetomaternal hemorrhage detection. Cytometry 2002; 50: 285-290.
10. Janssen WCM, Hoffmann JML: Evaluation of flow cytometric enumeration of fetal erythrocytes in maternal blood. Clin Lab Haem 2002; 24: 89-92.
11. Fernandes BJ, von Dadelszen P, Fazal I et al.: Flow cytometric assessment of feto-maternal hemorrhage; a comparison with Betke-Kleihauer. Prenat Diagn 2007; 27: 641-643.
12. Fong EA, Finlayson J, Robins F et al.: Evaluation of a new rapid anti-HbF FITC assay, Trillium QuickQuant for detection and quantitation of foetomaternal haemorrhage. Int J Lab Hem 2013; 35: 106-110.
13. Pourazar A, Homayouni V, Rezaci A et al.: The assessment of feto-maternal hemorrhage in an artificial model using anti-D and anti-fetal hemoglobin antibody by flow cytometry. Iranian Biomed J 2008; 12: 43-48.
14. Pelikan DM, Scherjon SA, Mesker WE et al.: Quantification of fetomaternal hemorrhage: a comparative study of the manual and automated microscopic Kleihauer-Betke tests and flow cytometry in clinical samples. Am J Obstet Gynecol 2004; 191: 551-557.
15. Fabijańska-Mitek J: Przeciek płodowo-matczyny. Skutki kliniczne i metody oceny. Acta Haematol Pol 2011; 41: 445-451.
16. Gieleżyńska A, Fabijańska-Miek J: Płodowo-matczyny przeciek krwi – wykrywanie i ocena ilościowa. Pol Merk Lek 2011; XXX: 219-223.
17. Gómez-Arbonès X, Pinacho A, Ortiz P et al.: Quantification of foetomaternal haemorrhage. An analysis of two cytometric techniques and a semiquantitative gel agglutination test. Clin Lab Haematol 2002; 24: 47-53.
18. Ben-Haroush A, Belkin A, Chezar J et al.: Comparison of two techniques for the evaluation of fetomaternal hemorrhage in RhD-negative women: gel agglutination and haemoglobin F determination by flow cytometry. Acta Obstet Gynecol 2007; 86: 821-826.
19. Agaylan A, Meyer O, Ahrens N et al.: A rapid gel agglutination test for the determination of fetomaternal haemrrhage. Transf Med 2007; 17: 395-398.
20. Gieleżyńska A, Fabijańska-Mitek J, Dębska M: Introduction of maternal and fetal morphological parameters of blood for calculation the postpartum anti-RhD immunoglobulin doses. Postępy Nauk Medycznych 2012; XXV: 553-556.

