© Borgis - Nowa Pediatria 2/2016, s. 57-61
*Marzanna Chojnacka1, Anna Semaniak2, Katarzyna Pędziwiatr1, Anna Skowrońska-Gardas1
Zastosowanie radioterapii w gruczolakach przysadki u dzieci – opis trzech przypadków
Radiotherapy for pituitary adenomas in children – report of three cases
1Pracownia Przygotowania, Planowania i Leczenia Napromienianiem, Centrum Onkologii –Instytut im. M. Skłodowskiej-Curie, Warszawa
Kierownik Pracowni: dr hab. n. med. Zbigniew Szutkowski
2Zakład Fizyki Medycznej, Centrum Onkologii – Instytut im. M. Skłodowskiej-Curie, Warszawa
Kierownik Zakładu: dr hab. n. med. Paweł Kukołowicz
Summary
Pituitary adenomas are uncommon central nervous system tumors in children. The therapeutic procedure includes surgery, medical therapy for patients with secreting adenomas, and radiotherapy for selected cases. Between 2005 and 2014 three children with pituitary adenoma were irradiated in Radiotherapy Department Maria Skłodowska-Curie Memorial Cancer Center – Institute in Warsaw. Both short clinical characteristic and radiotherapy schedules of these patients were presented to show the evolution of irradiation techniques and its connection with the ability of healthy tissue protection. Radiotherapy was tolerated well in all children. Neither vision deterioration nor worsening of the pituitary failure was evaluated. Epilepsy was diagnosed in one patient, most likely because of the late complications of irradiation. We observed greater protection of healthy tissue when the conformal radiotherapy methods were applied. The postoperative radiotherapy should be considered as supplementary treatment for patients with the pituitary macroadenomas and the residual tumors. This therapy may be safely postponed for children with maintained pituitary secretion until the tumor progression. The multidisciplinary care after therapy should be the standard procedure due to the wide spectrum of treatment toxicity.

Wstęp
Gruczolaki przysadki stanowią zaledwie 3% wszystkich guzów mózgu zlokalizowanych nadnamiotowo u dzieci (1-3). Jest to schorzenie, którego podejrzenie zwykle wysnuwa endokrynolog (ze względu na cechy hipersekrecji niektórych hormonów) bądź okulista (po stwierdzeniu nieprawidłowości w badaniu dna oka czy zaburzeń pola widzenia) (1, 3-6). Wynik badania rezonansu magnetycznego (MRI) okolicy siodła tureckiego oraz ocena czynności wydzielniczej gruczolaka stanowią podstawę do podjęcia decyzji terapeutycznych. Leczenie gruczolaków przysadki jest postępowaniem indywidualizowanym w zależności od typu guza. W większości przypadków wykonywany jest zabieg operacyjny z dojścia przez zatokę klinową (1, 2, 4). W guzach czynnych hormonalnie o typie prolactinoma leczenie farmakologiczne z zastosowaniem agonistów dopaminy jest leczeniem pierwszego rzutu (1-4, 7). Radioterapia jako metoda zasadnicza stosowana jest rzadko – tylko w przypadku obecności przeciwwskazań do przeprowadzenia zabiegu operacyjnego. Jako metoda uzupełniająca rozważana jest po stwierdzeniu cech progresji guza po operacji lub niekontrolowanej leczeniem farmakologicznym aktywności hormonalnej gruczolaka (1, 2, 4, 8, 9). Obawy przed zastosowaniem napromieniania u dzieci wynikają z toksyczności tej metody leczenia. Jednakże, obecnie stosowana radioterapia to metody wysoce konformalne, pozwalające na skupienie wysokiej dawki w obszarze guza z maksymalnym jej obniżeniem w tkankach sąsiadujących (10, 11).
Celem pracy jest określenie roli nowoczesnych metod napromieniania w leczeniu gruczolaków przysadki u dzieci.
Opisy przypadków
W latach 2005-2014 w Zakładzie Radioterapii Centrum Onkologii w Warszawie przy ul. Wawelskiej 15 leczono napromienianiem troje dzieci z rozpoznaniem gruczolaka przysadki. Poniżej przedstawiono krótką charakterystykę poszczególnych pacjentów oraz zaprezentowano plany leczenia w celu pokazania ewolucji metod radioterapii i związanego z tym wzrostu możliwości ochrony prawidłowych tkanek.
Pacjent 1
Dziesięcioletnia dziewczynka z otyłością powyżej 97 centyla oraz miesięcznym wywiadem bólu głowy i niedowładu nerwu II i IV po stronie prawej. W badaniu MRI uwidoczniono rozległą masę zlokalizowaną śród- i nadsiodłowo o wymiarach 40 x 27 x 26 mm, naciekającą zatoki jamiste. Skrzyżowanie nerwów wzrokowych było wtopione w masę guza. U pacjentki stwierdzono znacznie podwyższony poziom prolaktyny: 890 ng/ml przy normie do 19,7 ng/ml. W pierwszym etapie przeprowadzono biopsję endoskopową guza z dojścia przez zatokę klinową. Po ustaleniu rozpoznania inwazyjnego gruczolaka przysadki o typie prolactinoma włączono leczenie bromokryptyną w dawce 2,5 mg/dobę. Po okresie półrocznej terapii doszło do progresji klinicznej w postaci nasilenia bólu głowy oraz upośledzenia ostrości widzenia, potwierdzonej w badaniu MRI (masa 50 x 34 x 36 mm). Pacjentka została poddana leczeniu operacyjnemu, usunięto częściowo gruczolaka drogą kraniotomii czołowej.
Na tym etapie leczenia pacjentka została zakwalifikowana do radioterapii. W chwili kwalifikacji stwierdzono wielohormonalną niewydolność przysadki, niewielką wadę wzroku wymagającą zastosowania szkieł korekcyjnych oraz znaczną otyłość, powyżej 97 centyla. W badaniu obrazowym wymiary gruczolaka były zbliżone do tych sprzed operacji. Na przełomie sierpnia i września 2005 roku przeprowadzono konformalną radioterapię guza okolicy nad- i śródsiodłowej z niewielkim marginesem tkanek prawidłowych. Zastosowano napromienianie fotonami o energii 15 MV, techniką trzech pól z osłonami indywidualnym i filtrami klinowymi do dawki całkowitej 45 Gy w 25 dawkach frakcyjnych po 1,8 Gy (ryc. 1). Objętość tkanek prawidłowych objęta wysoką dawką (V80% = 36 Gy) wyniosła 216,5 cm? przy objętości guza z marginesem (ang. clinical target volume – CTV) równej 134 cm?. Dawka średnia (V50% = 22,5 Gy) została podana w objętości 658 cm? tkanek. Tolerancja leczenia była dobra.
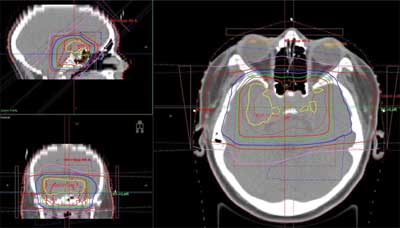
Ryc. 1. Rozkład dawki dla pacjenta 1
W 8-letniej obserwacji obraz radiologiczny gruczolaka pozostał stabilny. Po 4 latach od radioterapii podwyższeniu uległ poziom prolaktyny. Ponowną odpowiedź uzyskano włączając dodatkowy preparat z grupy pochodnych ergoliny – Dostinex. Po 7 latach od napromieniania u pacjentki wystąpiły napady padaczki, w badaniu EEG stwierdzono patologiczny zapis nad prawą półkulą mózgu. Analizując dawkę podaną na prawy płat skroniowy można podejrzewać, że padaczka jest późnym następstwem przebytej radioterapii. Obecnie pacjentka pozostaje w obserwacji, pod wielospecjalistyczną opieką: neurologa, endokrynologa, okulisty i dietetyka. Wymaga pełnej substytucji hormonalnej.
Pacjent 2
Piętnastoletnia pacjentka z postępującym osłabieniem ostrości widzenia okiem lewym. W badaniu rezonansu magnetycznego stwierdzono guz zajmujący siodło tureckie o wymiarach 20 x 20 x 30 mm. Lewy nerw wzrokowy wtopiony był w masę guza. Nie ujawniono odchyleń w poziomie hormonów. Pacjentka została poddana zabiegowi częściowego usunięcia guza. W badaniu histopatologicznym stwierdzono niemego somatotropowego gruczolaka przysadki. W pooperacyjnym badaniu MRI opisano resztkę guza 10 x 7 mm, nie obserwowano cech niewydolności hormonalnej przysadki. Po roku od pierwotnego zabiegu przeprowadzono reoperację ze względu na progresję resztki guza w dwóch kolejnych badaniach obrazowych. Wówczas pacjentka została zakwalifikowana do uzupełniającej radioterapii. Klinicznie w chwili kwalifikacji stwierdzono: otyłość, moczówkę prostą, ślepotę oka prawego i zawężenie pola widzenia oka lewego oraz niedomogę hormonalną w zakresie ACTH i hormonów płciowych wymagającą substytucji. W badaniu obrazowym nie stwierdzono resztki guza. Na przełomie czerwca i lipca 2008 roku przeprowadzono radioterapię konformalną fot. X 15 MV na obszar loży guza w dawce 50 Gy w 25 dawkach frakcyjnych po 2 Gy (ryc. 2). Objętość prawidłowych tkanek napromienionych wysoką dawką wyniosła 42,6 cm? przy objętości CTV równej 11,1 cm?. Tolerancja radioterapii była dobra.
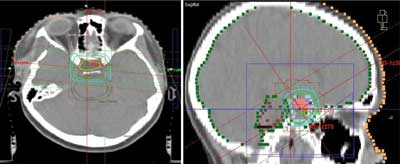
Ryc. 2. Rozkład dawki wysokiej dla pacjenta 2
W 2-letniej obserwacji po leczeniu nie ujawniono nowych objawów będących efektem toksyczności przebytego napromieniania. Pacjentka pozostawała pod opieką: endokrynologa, ginekologa, okulisty i dietetyka. W badaniach obrazowych nie stwierdzono odrostu guza. Po ukończeniu 18. roku życia została przekazana pod opiekę poradni dla pacjentów dorosłych.
Pacjent 3
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Guaraldi F, Storr HL, Ghizzoni L et al.: Pediatric pituitary adenomas: a decade of change. Horm Res Paediatr 2014; 81: 145-155. 2. Singh SK, Aggarwal R: Pituitary adenomas in childhood. Indian J Pediatr 2005; 72(7): 583-591. 3. Pandey P, Ojha BK, Mahapatra AK: Pediatric pituitary adenoma: a series of 42 patients. J Clin Neurosci 2005; 12(2): 124-127. 4. Cortet-Rudelli C, Bonneville JF, Borson-Chazot F et al.: Post-surgical management of non-functioning pituitary adenoma. Ann Endocrinol 2015; 76: 228-238. 5. Webb C, Prayson RA: Pediatric pituitary adenomas. Arch Pathol Lab Med 2008; 132: 77-80. 6. Keil MF, Stratakis CA: Pituitary tumors in childhood: an update in their diagnosis, treatment and molecular genetics. Expert Rev Neurother 2008; 8(4): 563-574. 7. Minniti G, Clarke E, Scaringi C, Enrici RM: Stereotactic radiotherapy and radiosurgery for non-functioning and secreting pituitary adenomas. Rep Pract Oncol Radiother 2014, http://dx.doi.org/10.1016/j.rpor.2014.09.004. 8. Erridge SC, Conkey DS, Stockton D et al.: Radiotherapy for pituitary adenomas: long-term efficacy and toxicity. Radiother Oncol 2009; 93: 597-601. 9. Krysiak R, Okopień B, Marek B, Szkróbka W: Gruczolak przysadki wydzielający prolaktynę. Przegl Lek 2009; 66(4): 198-205. 10. Steele CA, MacFarlane IA, Blair J et al.: Pituitary adenomas in childhood, adolescence and young adulthood: presentation, management, endocrine and metabolic outcomes. Eur J Endocrinol 2010; 163: 515-522. 11. Zawada NB, Kunert-Radek B: Klinicznie nieczynne hormonalnie guzy przysadki. Folia Medica Lodziensia 2012; 39(1): 87-138. 12. Kapczuk I, Beń-Skowronek I, Jaklińska T, Szewczyk L: Zaburzenia hormonalne w przebiegu leczenia guzów okolicy podwzgórzowo-przysadkowej. Endokrynol Ped 9/2010; 2(31): 35-44.


