© Borgis - Postępy Nauk Medycznych 4/2016, s. 241-245
*Dorota Jarzębicka, Joanna Sieczkowska, Jarosław Kierkuś, Maciej Dądalski, Marek Woynarowski, Grzegorz Oracz
Achalazja przełyku u dzieci
Esophageal achalasia in children
Klinika Gastroenterologii, Hepatologii, Zaburzeń Odżywiania i Pediatrii, Instytut „Pomnik – Centrum Zdrowia Dziecka”, Warszawa
Kierownik Kliniki: prof. dr hab. med. Józef Ryżko
Streszczenie
Achalazja przełyku jest pierwotnym zaburzeniem motoryki przełyku. Charakteryzuje się: wzmożonym napięciem spoczynkowym dolnego zwieracza przełyku (LES), brakiem odruchowego rozkurczu dolnego zwieracza przełyku w odpowiedzi na nadchodzącą falę perystaltyczną oraz brakiem skutecznej fali perystaltycznej w trzonie przełyku. Zaburzenia te prowadzą do czynnościowej niedrożności przełyku, zastoju pokarmu, wtórnego poszerzenia i zapalenia przełyku. Jest to rzadka choroba, spowodowana niedorozwojem, zwyrodnieniem lub brakiem komórek zwojowych w splocie Auerbacha w dolnym odcinku przełyku. Wyróżniamy achalazję pierwotną (idiopatyczną) oraz wtórną. Częstość jej występowania szacuje się na 1/100 tysięcy. Choroba może wystąpić w każdym wieku, jednak tylko w 5% przypadków dotyczy ona osób poniżej 15. roku życia. Wystąpienie choroby w ciągu pierwszych 5 lat życia może być związane z podłożem genetycznym, które jest wyraźnie potwierdzone w zespole Allgrove’a (zespół 3A). Najczęstsze objawy to: dysfagia, wymioty, ból zamostkowy, wolne jedzenie, utrata masy ciała. Późno rozpoznana choroba prowadzi do stopniowego wyniszczenia chorego. Rozpoznanie jest ustalane na podstawie objawów klinicznych, badania radiologicznego po podaniu środka kontrastowego, obrazu endoskopii oraz zapisu manometrii przełyku. Dostępnych jest kilka metod leczenia achalazji przełyku. Leczenie farmakologiczne jest najrzadziej stosowane z powodu małej skuteczności. Leczenie endoskopowe to wstrzykiwanie toksyny botulinowej typu A oraz rozszerzanie przełyku balonem. Za najbardziej skuteczne uważa się leczenie operacyjne – laparoskopową miotomię Hellera z fundoplikacją. Przezustna endoskopowa miotomia (POEM) jest najnowszą techniką leczenia achalazji przełyku, która obiecuje podobnie trwały pozytywny rezultat leczenia jak inwazyjna miotomia Hellera, przy wyraźnie mniejszym obciążeniu pacjenta.
Summary
Achalasia is a primary esophageal motility disorder, characterized by increased resting tension of the lower esophageal sphincter (LES), a lack of relaxation reflex of the LES in response to the incoming wave and the lack of effective peristaltic wave in the esophagus. These disorders lead to functional obstruction of the esophagus, food stagnation, secondary enlargement and inflammation. It is a rare disease caused by underdevelopment, degeneration or absence of ganglion cells in Auerbach’s plexus in the lower part of the esophagus. There is primary (idiopathic) and secondary achalasia. The incidence is estimated to be 1/100 000. The disease can occur at any age, but only 5% of cases occur below 15 years of age. The genetic background is clearly confirmed in Triple-A syndrome (unit 3A). The most common symptoms are dysphagia, vomiting, chest pain and, free food, weight loss. Late diagnosed leads to malnutrition of the patient. The diagnosis is established on the basis of clinical symptoms, radiological examination after the administration of contrast agent, endoscopy and esophageal manometry. There are several treatments for esophageal achalasia. Pharmacological treatment is not often used due to low efficiency. Available endoscopic techniques are the injection of botulinum toxin type A and esophageal balloon dilatation. Surgery is considered to be the most effective – laparoscopic Heller’s myotomy with fundoplication. Peroral endoscopic myotomy (POEM) is the latest technique for the treatment of esophageal achalasia, which promises the same lasting positive results as invasive treatment miotomia Heller, with significantly less stress on the patient.

WSTĘP
Achalazja przełyku jest schorzeniem należącym do zaburzeń motoryki przełyku. Po raz pierwszy choroba została opisana przez Thomasa Willisa w 1674 roku (1, 2). Achalazja przełyku jest pierwotnym zaburzeniem motoryki przełyku, u podłoża którego leży zaburzenie napięcia spoczynkowego i upośledzenie rozkurczu dolnego zwieracza przełyku (ang. lower esophageal sphincter – LES) z towarzyszącą nieprawidłową falą perystaltyczną przełyku. Charakterystyczne są brak perystaltyki przełyku i upośledzona relaksacja LES, co w następstwie doprowadza do zalegania pokarmu, poszerzenia i zapalenia przełyku. Jest to rzadka, postępująca choroba. Spowodowana jest niedorozwojem, zwyrodnieniem lub brakiem komórek zwojowych w splocie warstwy mięśniowej Auerbacha w dolnym odcinku przełyku (3, 4).
EPIDEMIOLOGIA
Występowanie achalazji wśród dzieci i młodzieży jest bardzo rzadkie. Częstość występowania szacuje się na 1/100 000, a zapadalność na 0,5/100 000/rok (3-6). Choroba może wystąpić w każdym wieku, jednak tylko w 5% przypadków dotyczy osób poniżej 15. roku życia (2, 4, 6). Wystąpienie choroby w ciągu pierwszych 5 lat życia może być związane z podłożem genetycznym, jednak rodzinne występowanie szacuje się na mniej niż 1% przypadków choroby (3).
ETIOLOGIA
Wyróżniamy achalazję pierwotną (idiopatyczną) oraz wtórną. Hipoteza rozwoju achalazji pierwotnej zakładała przewlekłą przeszkodę w pasażu i zwyrodnienie neuronalne, jednak opisy histopatologiczne wycinków z przełyku opisywały jedynie stan zapalny, który skutkował utratą komórek zwojowych w dolnej części przełyku i LES (2, 6, 7). Co więcej, wydaje się, że stopień nasilenia zmian histopatologicznych koreluje z ciężkością przebiegu choroby (7). Wśród przyczyn wtórnej achalazji wymienia się postać związaną między innymi z trisomią 21 czy zakażeniem Trypanosoma cruzi (choroba Chagasa) (3, 4). W patogenezie choroby bierze się także pod uwagę udział czynników autoimmunologicznych, infekcyjnych (głównie wirusy neurotropowe), środowiskowych oraz genetycznych (7, 8). Za tłem autoimmunologicznym przemawia obecność krążących przeciwciał przeciwko komórkom splotu trzewnego oraz zwiększenie częstości występowania HLA antygenów klasy II (7-9). Wśród przyczyn infekcyjnych pewną pozycję, jak wspomniano powyżej, zajmuje zakażenie Trypanosoma cruzi. Dało to początek sugestiom możliwych infekcji wirusowych, takich jak odra, ospa czy HSV-1, jednak żadna praca nie wykazała jak dotąd związku przyczynowego z ww. wirusami (7, 8). W ostatnim czasie coraz częściej mówi się również o możliwym tle genetycznym achalazji przełyku. Tło genetyczne jest wyraźnie potwierdzone w zespole Allgrove’a (zespół 3A), którego składowymi są: achalazja przełyku, choroba Addisona i alakrimia (3, 7-10). Zespół Allgrove’a spowodowany jest mutacją w genie AAAS zlokalizowanym na chromosomie 12q13.8. Jednakże jest to niezwykle rzadki zespół. Ostatnie obserwacje sugerują częstsze występowanie achalazji u dzieci z zespołem Downa (7, 9).
OBJAWY KLINICZNE
Objawy kliniczne zależą od długości trwania choroby oraz wieku pacjenta. Początek jest zazwyczaj stopniowy. Najczęstsze objawy to: dysfagia, wymioty, ból zamostkowy i krztuszenie się podczas jedzenia, wolne jedzenie, utrata masy ciała, objawy z dróg oddechowych, takie jak aspiracyjne zapalenia płuc (1-7, 11). Należy pamiętać, że początkowe objawy mogą być różne w odpowiednich grupach wiekowych. Niemowlęta i małe dzieci najczęściej prezentują zadławienia, kaszel, nawracające infekcje górnych dróg oddechowych, wstręt do jedzenia, brak prawidłowego rozwoju. U starszych dzieci występują: wymioty, dysfagia, utrata masy ciała, powolne jedzenie, objawy z układu oddechowego (3, 4). Dysfagia, która wydaje się najczęstszym objawem początkowym, jest takim w 39% przypadków. Zgaga, regurgitacje i wolne jedzenie występują w odpowiednio 24, 24 i 16%. Podczas wykonywania diagnostyki najczęstszymi obserwowanymi objawami są wolne jedzenie (79%) z towarzyszącą dysfagią (76%) oraz stereotypowe ruchy ciała ułatwiające przełknięcie pokarmu – wyginanie szyi i ramion, unoszenie rąk, wstawanie i siadanie prosto (8). Dysfagia w początkowym etapie ograniczona jest do pokarmów stałych, choć wraz z rozwojem choroby dotyczy również diety płynnej. U chorych zdarzają się wymioty niestrawioną, zalegającą w poszerzonym przełyku treścią pokarmową oraz gromadzącą się śliną (3). Objawy kliniczne achalazji zostały przedstawione na rycinie 1.
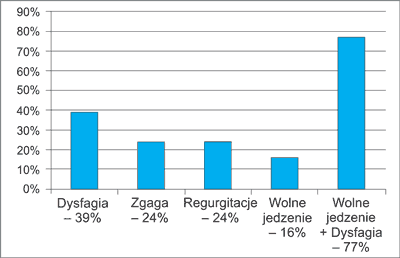
Ryc. 1. Częstość występowania poszczególnych objawów achalazji przełyku
DIAGNOSTYKA
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Willis T: The combination of medication and surgery of esophageal achalasia. [In:] Willis T (ed.): Achalasia. Hgas-comitis, London 1964: 18-19.
2. Upadhyaya VD, Gangopadhyaya AN, Gupta DK et al.: Esophageal achalasia of unknown etiology in infants. World J Pediatr 2008; 4(1): 63-65.
3. Rudolph CD, Sood MR: Achalasia and other motor disorders. [In:] Wyllie R, Hyams JS (eds.): Pediatric Gastrointestinal and Liver Disease. Elsevier, USA 2011: 248-254.
4. Franklin AL, Petrosyan M, Kane TD: Childhood achalasia: a comprehensive review of disease, diagnosis and therapeutic management. World J Gastrointest Endosc 2014; 6(4): 105-111.
5. Caldaro T, Familiari P, Romeo EF et al.: Treatment of esophageal achalasia in children: today and tomorrow. J Pediatr Surg 2015; 50: 726-730.
6. Hallal C, Kieling CO, Nunes DL et al.: Diagnosis, misdiagnosis, and associated diseases of achalasia in children and adolescents: a twelve-year single center experience. Pediatr Surg Int 2012: 28(12): 1211-1217.
7. Tam PKH, Wong KKY: Achalasia. [In:] Puri P, Höllwarth M (eds.): Pediatric Surgery: Diagnosis and Management. Springer-Verlag, Berlin 2009: 345-352.
8. Kashiwagi H, Omura N: Surgical treatment for achalasia: when should it be performed, and for which patients? Gen Thorac Cardiovasc Surg 2011; 59(6): 389-398.
9. Torab FC, Hamchou M, Ionescu G, Al-Salem AH: Familial achalasia in children. Pediatr Surg Int 2012; 28(12): 1229-1233.
10. Mathew T, Mehta A, Sarma GR: The fourth “A” of the “4A” syndrome. Pediatr Neurol 2013; 49(6): 507-508.
11. Allaix ME, Patti MG: What is the best primary therapy for achalasia: medical or surgical treatment? Who owns achalasia? J Gastrointest Surg 2013; 17: 1547-1549.
12. Morera C, Nurko S: Heterogeneity of lower esophageal sphincter function in children with achalasia. J Pediatr Gastroenterol Nutr 2012; 54(1): 34-40.
13. Inoue H, Minami H, Kobayashi Y et al.: Peroral endoscopic myotomy (POEM) for esophageal achalasia. Endoscopy 2010; 42(4): 265-271.

