© Borgis - Medycyna Rodzinna 4/2016, s. 231-238
Magdalena Potempa1, Paweł Jonczyk1, Kinga Szczerba1, Aleksandra Potempa2, Beata Kandefer1, Dariusz Kajdaniuk3
Metformina – dawny lek będzie lekiem przyszłości?
Metformin – an aged drug will be a drug of the future?
1Studenckie Koło Naukowe przy Katedrze Patofizjologii i Endokrynologii, Wydział Lekarski z Oddziałem Lekarsko-Dentystycznym w Zabrzu, Śląski Uniwersytet Medyczny w Katowicach
2Wydział Farmaceutyczny z Oddziałem Analityki Medycznej, Uniwersytet Medyczny im. Piastów Śląskich we Wrocławiu
3Katedra Patofizjologii i Endokrynologii, Wydział Lekarski z Oddziałem Lekarsko-Dentystycznym w Zabrzu, Śląski Uniwersytet Medyczny w Katowicach
Summary
Metformin is one of the most popular oral hypoglycemic drugs. In a chemical view of metformin, it belongs to biguanide derivatives. Beginnings of metformin discovery reach 1960s of XX century. That time Jean Sterne revealed its clinical hypoglycemic action. Metformin role within the cell comes to inhibit mitochondrial respiratory chain complex I in liver cells. It results in decrease of energy state of cell and alters its profile from anabolic to katabolic one. Thereby gluconeogenesis has been blocked out because of insufficient ATP production in liver cell. Beside this, metformin is able to “sensitize” peripheral cells on insulin which decreases insulin resistance – common disturbance among patients suffering from diabetes mellitus type 2. Clinical significance of metformin doesn’t limit just on therapy of diabetes type 2. Its other indications are inter alia polycystic ovary syndrome, prediabetes (performing together with metabolic syndrome constituents). Moreover in last years came about a great development of studies considering anticancer role of metformin.

Wstęp
Metformina należy do doustnych leków hipoglikemizujących. Od wielu lat jest jedną z najpopularniejszych substancji leczniczych stosowanych w terapii cukrzycy typu 2. Zgodnie ze Stanowiskiem Polskiego Towarzystwa Diabetologicznego w zakresie postępowania u chorych na cukrzycę typu 2, monoterapia metforminą należy do I etapu leczenia tego schorzenia wraz z zaleceniem modyfikacji stylu życia i zmniejszenia kaloryczności posiłków. Oprócz tego, w kolejnych etapach postępowania terapeutycznego, w schemacie leczenia, obok innych leków (doustnych przeciwcukrzycowych bądź insuliny) wciąż znajduje się metformina (1). W ostatnich latach nastąpił bardzo duży rozwój badań naukowych, których celem było poznanie skuteczności metforminy w innych stanach chorobowych aniżeli tylko w cukrzycy typu 2. W wielu przypadkach ich efekty okazały się pomyślne, co zaowocowało rozszerzeniem wskazań terapeutycznych do stosowania tego leku. Jednak w dalszym ciągu wydaje się, iż jego potencjał terapeutyczny nie został poznany i w fazie badań klinicznych jest wiele schorzeń, w których oceniana jest skuteczność metforminy. Wśród nich najważniejszymi są badania nad aktywnością przeciwnowotworową metforminy oraz jej potencjale przeciwstarzeniowym (2-4).
Celem niniejszej pracy jest przedstawienie profilu działania metforminy w cukrzycy typu 2 zarówno pod kątem wywoływanych zmian biochemicznych w komórce, jak i efektów klinicznych. Intencją autorów będzie również przedstawienie pozostałych najważniejszych jednostek chorobowych, w których została udowodniona istotna rola metforminy. Ponadto zostanie opisana czytelnikowi aktywność przeciwnowotworowa tego leku.
Rys historyczny
Metformina należy do grupy związków będących pochodnymi biguanidu. Jej odkrycie wiąże się z tradycyjnym ziołolecznictwem, tj. z zastosowaniem rutwicy lekarskiej (Galega officinalis), która już w średniowieczu kojarzona była z leczeniem objawów będących skutkiem cukrzycy typu 2. Składnikami czynnymi rutwicy są związki guanidynowe odpowiedzialne za jej słabe działanie hipoglikemizujące. W celu wzmocnienia tego działania w latach 20. XX wieku wytworzono dwa syntetyczne związki – diguanidy (syntalina A i B), lecz po stwierdzeniu ich stosunkowo silnych działań niepożądanych, upośledzających czynność wątroby oraz nerek (co jednoczasowo odbyło się z coraz szerszym zastosowaniem insuliny), odstąpiono od wykorzystania terapeutycznego tych związków (5). Kliniczne działanie przeciwcukrzycowe metforminy zostało natomiast odkryte i udowodnione w 1957 roku w badaniach przeprowadzonych pod kierownictwem francuskiego lekarza Jeana Sterne’a. Odbyło się to wraz z wytworzeniem dwóch innych biguanidowych pochodnych, tj. fenforminy i buforminy (6). Mimo to, ze względu na złą „reputację” tego typu związków, silne działanie toksyczne fenforminy i buforminy oraz dalsze rosnące zainteresowanie insuliną, metformina nie była stosowana. Pod koniec lat 70. XX wieku związki te zostały wycofane. Dopiero w 1995 roku na terenie Stanów Zjednoczonych, po wielu próbach klinicznych podjęto decyzję o ponownym wprowadzeniu metforminy do obrotu leczniczego (7). W aspekcie bezpieczeństwa stosowania tego leku oraz skuteczności działania metforminy bardzo istotne było wieloośrodkowe badanie UKPDS (United Kingdom Prospective Diabetes Study), w którym wzięło udział około 4000 chorych ze świeżo wykrytą cukrzycą typu 2. Po wielu latach jego trwania, wyniki pokazały, że w grupie chorych przyjmujących metforminę ogólna śmiertelność (ang. all- -cause mortality) zmniejszyła się o ponad 1/3, natomiast śmiertelność z przyczyn diabetologicznych zmalała o około 40%. Ponadto zaobserwowany brak zwiększenia masy ciała oraz istotnie mniejsza ilość epizodów hipoglikemii w stosunku do terapii innymi lekami przeciwcukrzycowymi wskazały na możliwość szerokiego zastosowania tego leku w praktyce klinicznej u chorych na cukrzycę typu 2 (przy jednoczasowej redukcji ilości przeciwwskazań do jej stosowania) (8).
Działanie metforminy w cukrzycy typu 2
Działanie hipoglikemizujące metforminy odbywa się w różny sposób. Z jednej strony zmniejszenie glikemii jest wynikiem zdolności metforminy do tzw. „uwrażliwiania” komórek na obwodowo krążącą insulinę, co powoduje zwiększony obwodowy wychwyt i tkankowe zużycie glukozy. Dodatkowo lek ten zmniejsza wchłanianie glukozy w jelicie cienkim oraz zwiększa zdolność do przezbłonowego transportu glukozy do wnętrza komórek efektorowych poprzez zwiększenie ilości receptorów GLUT-4 na ich powierzchni (ryc. 1). Z drugiej strony poprawa wartości glikemii odbywa się dzięki hamowaniu wytwarzania glukozy w wątrobie przez wpływ na proces glukoneogenezy. Do wyjaśnienia tych działań metforminy niezbędna jest ingerencja w procesy biochemiczne toczące się w obrębie komórki. Uważa się bowiem, że pierwotnym miejscem działania metforminy są mitochondria hepatocytów, w których lek ma zdolność hamowania aktywności kompleksu I łańcucha oddechowego (9, 10). Tym samym następuje zmniejszenie fosforylacji oksydacyjnej i produkcji ATP. Wtórnie, powoduje to zwiększenie ilości adenozynomonofosforanu (AMP), który przyłącza się do domeny katalitycznej kinazy białkowej aktywowanej przez AMP (AMPK). Kinaza ta działa jak wewnątrzkomórkowy sensor energii, który ulega aktywacji przy zmniejszeniu stosunku ATP/AMP (11). Udokumentowano, iż do pełnej aktywacji AMPK przez metforminę niezbędna jest prawidłowa funkcja kinazy LKB1 (ang. liver kinase B1) położonej pod błoną komórkową, a kodowanej przez gen należący do antyonkogenów o jednoimiennej nazwie (12, 13). Zwiększenie stosunku AMP/ATP powoduje zmianę profilu hepatocytów z anabolicznego na kataboliczny, zatrzymując w ten sposób szlaki zużywające ATP, w tym glukoneogenezę (14, 15). Oprócz tego dowiedziono, że istnieje także hamujące działanie metforminy na ekspresję pewnych genów, których produkty białkowe są zaangażowane w glukoneogenezę oraz allosteryczną modyfikację niektórych kluczowych enzymów uczestniczących w tym procesie (16). W hepatocycie odbywa się natomiast intensyfikacja procesów przeciwnych – oksydacji kwasów tłuszczowych (fosforylacja acetylo-CoA) oraz glikolizy (ryc. 2) (17, 18). Wykazano także, że przewlekła aktywacja AMPK ma zdolność do indukcji heksokinazy w mięśniach szkieletowych oraz powstawania receptorów GLUT-4 na powierzchni miocytów, co imituje efekt wysiłku fizycznego i normalizuje wartości glikemii (19-21). Wyniki badania Musi i wsp. przeprowadzonego u chorych na cukrzycę typu 2 pokazały, że metformina zwiększa aktywność AMPK w mięśniach szkieletowych i wychwyt glukozy przez tkanki obwodowe (22). Ponadto metformina wskutek zablokowania dipeptydylopeptydazy 4 hamuje degradację GLP-1 (ang. glucagon-like peptide-1). Zmniejsza się wtedy uwalnianie glukagonu, spowalnia opróżnianie żołądka, co daje efekt zahamowania łaknienia. Dlatego też podanie metforminy wraz z analogiem GLP-1 wpływa addycyjnie na obniżenie glikemii u chorych na cukrzycę typu 2 (23). Dowiedziono również szeregu innych korzystnych zaletach metforminy, w tym jej działania hipolipemicznego (24, 25), przeciwmiażdżycowego (zmniejszenie adhezji monocytów do ściany naczyniowej i hamowanie przekształcania makrofagów w komórki piankowate; zmniejszenie sekrecji czynników aktywacji śródbłonka i w efekcie wazodylatację naczyń) (26) czy też poprawiającego funkcję śródbłonka naczyniowego (27). Efekt przeciwzapalny odbywa się przez wpływ na stężenie cytokin prozapalnych, zmniejszenie stężenia białka C-reaktywnego (28) oraz ilości wolnych rodników tlenowych (29).
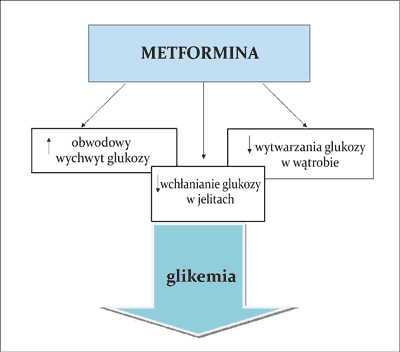
Ryc. 1. Działanie hipoglikemizujące metforminy
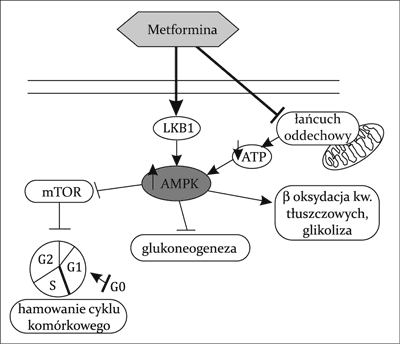
Ryc. 2. Działanie molekularne metforminy
AMPK – kinaza aktywowana 5’AMP; ATP – adenozynotrifosforan; LKB1 – kinaza LKB1; mTOR – szlak kinazy mTOR
Znaczenie metforminy w innych schorzeniach
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Doustne leki przeciwcukrzycowe i agoniści receptora GLP-1 w terapii cukrzycy typu 2. [W:] Zalecenia kliniczne dotyczące postępowania u chorych na cukrzycę 2016. Stanowisko Polskiego Towarzystwa Diabetologicznego 2016; 5 (supl. A): A16-A18. 2. Anisimov VN: Metformin for cancer and aging prevention: is it a time to make the long story short? Oncotarget 2015; 6: 39398-39407. 3. Dowling RJ, Goodwin PJ, Stambolic V: Understanding the benefit of metformin use in cancer treatment. BMC Medicine 2011; 9: 33. 4. Meng S: The Anticancer Effect of metformin, the Most Commonly Used Anti-Diabetes Drug. J Endorin Diabetes Obes 2014; 2: 1030. 5. Werner EA, Bell J: The preparation of methylguanidine and of ββ-dimethylguanidine by the interaction of dicyanodiamide and methylammonium and dimethylammonium chlorides respectively. J Chem Soc Transact 1922; 121: 1790-1794. 6. Sterne J: Treatment of diabetes mellitus with N,N-dimethylguanylguanidine (LA. 6023, glucophage). Therapie 1959; 14: 625-630. 7. Bailey CJ, Turner RC: Metformin. N Engl J Med 1996; 334: 574-579. 8. UK Prospective Diabetes Study (UKPDS) Group: Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998; 352: 854-865. 9. Kirpichnikov D, McFarlane SI, Sowers JR: Metformin: an update. Ann Intern Med 2002; 137: 25-33. 10. Śliwińska A, Drzewoski J: Molecular Action of Metformin in Hepatocytes: An Updated Insight. Curr. Diabetes Rev 2015; 11: 175-181. 11. Zhou G, Myers R, Li Y et al.: Role of AMP-activated protein kinase in mechanism of metformin action. J Clin Invest 2001; 108: 1167-1174. 12. Hardie DG: Minireview: the AMP-activated protein kinase cascade: the key sensor of cellular energy status. Endocrinology 2003; 144: 5179-5183. 13. Shaw RJ, Lamia KA, Vasquez D et al.: The kinase LKB1 mediates glucose homeostasis in liver and therapeutic effects of metformin. Science 2005; 310: 1642-1646. 14. Sanders MJ, Grondin PO, Hegarty BD et al.: Investigating the mechanism for AMP activation of the AMP-activated protein kinase cascade. Biochem J 2007; 403: 139-148. 15. Kahn BB, Alquier T, Carling D, Hardie DG: AMP-activated protein kinase: ancient energy gauge provides clues to modern understanding of metabolism. Cell Metab 2005; 1: 15-25. 16. Foretz M, Hebrard S, Leclerc J et al.: Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathway via a decrease in hepatic energy state. J Clin Invest 2010; 120: 2355-2369. 17. Hardie DG, Hawley SA: AMP-activated protein kinase: the energy charge hypothesis revisited. Bioessays 2001; 23: 1112-1119. 18. Nabrdalik K, Cichocka E, Gumprecht J: Metformina a kinaza białkowa aktywowana przez AMP (AMPK) i procesy energetyczne w cukrzycy typu 2. Diabetol Klin 2013; 2: 125-130. 19. Holmes BF, Kurth-Kraczek EJ, Winder WW: Chronic activation of 5’-AMP-activated protein kinase increases GLUT-4, hexokinase, and glycogen in muscle. J Appl Physiol (1985) 1999; 87: 1990-1995. 20. Winder WW, Holmes BF, Rubink DS et al.: Activation of AMP-activated protein kinase increases mitochondrial enzymes in skeletal muscle. J Appl Physiol 1985; 2000; 88: 2219-2226. 21. Ruderman NB, Park H, Kaushik VK et al.: AMPK as a metabolic switch in rat muscle, liver and adipose tissue after exercise. Acta Physiol Scand 2003; 178: 435-442. 22. Musi N, Hirshman MF, Nygren J et al.: Metformin increases AMP-activated protein kinase activity in skeletal muscle of subjects with type 2 diabetes. Diabetes 2002; 51: 2074-2081. 23. Cuthbertson J, Patterson S, O’Harte FP, Bell PM: Addition of metformin to exogenous glucagon-like peptide-1 results in increased serum glucagon-like peptide-1 concentrations and greater glucose lowering in type 2 diabetes mellitus. Metabolism 2011; 60: 52-56. 24. Robinson AC, Burke J, Robinson S et al.: The effects of metformin on glycemic control and serum lipids in insulin-treated NIDDM patients with suboptimal metabolic control. Diabetes Care 1998; 21: 701-705. 25. Palumbo PJ: Metformin: effects on cardiovascular risk factors in patients with non-insulin-dependent diabetes mellitus. J Diabetes Complications 1998; 12: 110-119. 26. Mamputu JC, Wiernsperger N, Renier G: Metformin inhibits monocyte adhesion to endothelial cells and foam cell formation. Br J Diabet Vasc Dis 2003; 3: 302-310. 27. Mather KJ, Verma S, Anderson TJ: Improved endothelial function with metformin in type 2 diabetes mellitus. J Am Coll Cardiol 2001; 37: 1344-1350. 28. Cameron A, Forteath C, Beall C, Rena G: Anti-inflammatory effect of metformin and their relationship to the therapeutic action of the drug. Endocrine Abstracts 2015; 35: P229. 29. Rahbar S, Figarola JL: Novel inhibitors of advanced glycation endproducts. Arch Biochem Biophys 2003; 419: 63-79. 30. Diabetes Prevention Program Research Group: Long-term safety, tolerability, and Wright loss associated with metformin In the Diabetes Program Research Group. Diabetes Care 2012; 35: 731-737. 31. Śliwnik-Janeczko D: Metformina – działanie antyhiperglikemiczne i kardioprotekcyjne. Diabetologia na co dzień 2009; 4: 27-32. 32. Otto-Buczkowska E: Metformina – blaski i cienie jej stosowania u młodych pacjentów. Dylematy refundacyjne. Medycyna Rodzinna 2013; 4: 154-157. 33. Jonczyk P, Potempa M, Kajdaniuk D: Analiza stopnia odżywienia i zaburzeń odżywiania oraz charakterystyka przyzwyczajeń żywieniowych i aktywności fizycznej wśród dzieci szkolnych w wieku 6-13 lat w mieście Piekary Śląskie. Pediatr Med Rodz 2015; 11: 302-314. 34. Milewicz A: Reimbursement of metformin for polycystic ovary syndrome. Endokrynol Pol 2013; 64: 409-414. 35. Kruszyńska A, Słowińska-Srzednicka J, Jeske W, Zgliczyński W: Proinsulin, adiponectin and hsCRP in reproductive age women with polycystic ovary syndrome (PCOS) – the effect of metformin treatment. Endokrynol Pol 2014; 65: 2-10. 36. Tang T, Lord JM, Norman RJ et al.: Insulin-sensitising drugs (metformin, rosiglitazone, pioglitazone, D-chiro-inositol) for women with polycystic ovary syndrome, oligo amenorrhoea and subfertility. Cochrane Database Syst Rev 2012; 16(5): CD003053. 37. Nadeau KJ, Chow K, Alam S et al.: Effects of low dose metformin in adolescents with type I diabetes mellitus: a randomized, double-blinded placebo-controlled study. Pediatr Diabetes 2015; 16: 196-203. 38. Urakami T, Morimoto S, Owada M, Harada K: Usefulness of the addition of metformin to insulin in pediatric patients with type 1 diabetes mellitus. Pediatr Int 2005; 47: 430-433. 39. Marques P, Carvalho MR, Pinto L, Guerra S: Metformin Safety in the Management of Gestational Diabetes. Endocr Pract 2014; 20: 1022-1031. 40. Rowan JA, Hague WM, Gao W et al.: Metformin versus Insulin for the Treatment of Gestational Diabetes. N Engl J Med 2008; 358: 2003-2015. 41. Gui J, Qing Liu Q, Feng L: Metformin vs Insulin in the Management of Gestational Diabetes: A Meta-Analysis. PLoS One 2013; 8: e64585. 42. Schwimmer JB, Middleton MS, Deutsch R, Lavine JE: A phase 2 clinical trial of metformin as a treatment for non-diabetic paediatric non-alcoholic steatohepatitis. Aliment Pharmacol Thera 2005; 21: 871-879. 43. Bugianesi E, Gentilcore E, Manini R et al.: A randomized controlled trial of metformin versus vitamin E or prescriptive diet in nonalcoholic fatty liver disease. Am J Gastroenterol 2005; 100: 1082-1090. 44. Huang S, Bjornsti M, Houghton P: Rapamycins: mechanism of action and cellular resistance. Cancer Biol Ther 2003; 2: 222-232. 45. Sahra IB, Le Marchand-Brustel Y, Tanti J, Bost F: Metformin in Cancer Therapy: A New Perspective for an Old Antidiabetic Drug? Mol Cancer Ther 2010; 9: 1092-1099. 46. Hietakangas V, Cohen SM: TOR complex 2 is needed for cell cycle progression and anchorage-independent growth of MCF7 and PC3 tumor cells. BMC Cancer 2008; 3: 282. 47. Advani SH: Targeting mTOR pathway: A new concept in cancer therapy. Indian J Med Paediatr Oncol 2010; 31: 132-136. 48. Vaira V, Lee CW, Goel HL et al.: Regulation of survivin expression by IGF-1/mTOR signaling. Oncogene 2007; 26: 2678-2684. 49. Han G, Gong H, Wang Y et al.: AMPK/mTOR-mediated inhibition of survivin partly contributes to metformin-induced apoptosis in human gastric cancer cell. Cancer Biol Ther 2015; 16: 77-87. 50. Del Bufalo D, Ciuffreda L, Trisciuoglio D et al.: Antiangiogenic potential of the Mammalian target of rapamycin inhibitor temsirolimus. Cancer Res 2006; 66: 5549-5554. 51. Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ: Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med 2003; 348: 1625-1638. 52. Larsson SC, Wolk A: Diabetes mellitus and incidence of kidney cancer: a meta-analysis of cohort studies. Diabetologia 2011; 54: 1013-1018. 53. Larsson SC, Orsini N, Wolk A: Diabetes mellitus and risk of colorectal cancer: a meta-analysis. J Nat Cancer Institute 2005; 97: 1679-1687. 54. Everhart J, Wright D: Diabetes mellitus as a risk factor for pancreatic cancer. A meta-analysis. J Am Med Assoc 1995; 273: 1605-1609. 55. Larsson SC, Mantzoros CS, Wolk A: Diabetes mellitus and risk of breast cancer: a meta-analysis. Intern J Cancer 2007; 121: 856-862. 56. Evans JM, Donnelly LA, Emslie-Smith AM et al.: Metformin and reduced risk of cancer in diabetic patients. BMJ 2005; 330: 1304-1305. 57. Decensi A, Puntoni M, Goodwin P et al.: Metformin and cancer risk in diabetic patients: a systematic review and meta-analysis. Cancer Prev Res 2010; 3: 1451-1461. 58. El-Haggar SM, El-Shitany NA, Mostafa MF, El-Bassiouny NA: Metformin may protect nondiabetic breast cancer women from metastasis.Clin Exp Metastasis 2016; 33: 339-357. 59. Deng D, Yang Y, Tang X et al.: Association between metformin therapy and incidence, recurrence and mortality of prostate cancer: evidence from a meta-analysis. Diabetes Metab Res Rev 2015; 31: 595-602. 60. Schuler KM, Rambally BS, DiFurio MJ et al.: Antiproliferative and metabolic effects of metformin in a preoperative window clinical trial for endometrial cancer. Cancer Med 2015; 4: 161-173. 61. Chen CI, Luan CF, Fang YA et al.: Cancer risk in HBV patients with statin and metformin use: a population-based cohort study. Medicine (Baltimore) 2015; 94: e462. 62. Hosono K, Endo H, Takahashi H et al.: Metformin suppresses colorectal aberrant crypt foci in a short-term clinical trial. Cancer Prev Res 2010; 3: 1077-1083. 63. Bodmer M, Becker C, Meier C et al.: Use of antidiabetic agents and the risk of pancreatic cancer: a case-control analysis. Am J Gastroenterol 2012; 107: 620-626. 64. Wu Y, Liu HB, Shi XF, Song Y: Conventional hypoglycaemic agents and the risk of lung cancer in patients with diabetes: a meta-analysis. PloS One 2014; 12(9): e99577.


