© Borgis - Postępy Nauk Medycznych 8/2017, s. 414-417
*Paweł Królik
Borelioza, postać wczesna rozsiana z zajęciem nerwu okoruchowego – opis przypadku
Borreliosis, the early, disseminated form of a nerve oculomotor palsy – case report
Oddział Geriatrii, Szpital Specjalistyczny w Jaśle
Kierownik Oddziału: lek. med. Paweł Królik
Streszczenie
Borelioza jest wielonarządową chorobą zakaźną przenoszoną przez kleszcze Ixodes. Czynnikiem etiologicznym są krętki Borrelia, najczęściej Borrelia burgdorferi sensu lato. Częstość występowania chorób przenoszonych przez kleszcze, przede wszystkim boreliozy, ale też kleszczowego zapalenia mózgu, anaplazmozy i w mniejszym stopniu babeszjozy, systematycznie wzrasta. Ryzyko zakażenia ludzi zależy od rejonu geograficznego oraz liczebności kleszczy zakażonych krętkami. Polska należy do krajów o średnim i wysokim wskaźniku zakażenia kleszczy Ixodes ricinus krętkami Borrelia burgdorferi. Prawdopodobieństwo zachorowania na boreliozę po jednorazowym pokłuciu przez kleszcza wynosi 1%, natomiast wytworzenia się swoistych przeciwciał – 3-6%. Wyróżnia się wczesną ograniczoną, wczesną rozsianą i późną postać boreliozy. Powikłania ze strony układu nerwowego (neuroborelioza) mogą dotyczyć 10-15%, a nawet 40% chorych. Ponieważ nie opracowano jednolitych kryteriów diagnostycznych, rozpoznanie neuroboreliozy pozostaje wciąż zagadnieniem trudnym. Oparte jest na obrazie klinicznym (kontakt z kleszczem, rumień wędrujący w wywiadzie) i wynikach badań laboratoryjnych (swoiste przeciwciała klasy IgM lub IgG przeciw Borrelia burgdorferi wykryte w pierwszym etapie metodą ELISA, potwierdzone metodą Western-blot). Stwierdzenie występowania w surowicy swoistych przeciwciał, bez objawów klinicznych typowych dla boreliozy, nie musi być dowodem aktywnego zakażenia. Miano przeciwciał nie jest też podstawą do oceny skuteczności leczenia i nie może być wskazaniem do powtórnej antybiotykoterapii. Zakażenia Borrelia burgdorferi nie powoduje trwałej odporności. Do rozpoznania reinfekcji konieczne jest wskazanie immunologicznej serokonwersji.
Dla wczesnych zespołów neurologicznych występujących w chorobie z Lyme typowe są porażenia nerwów czaszkowych. Leczenie polega na zastosowaniu pojedynczego 14-21-dniowego cyklu antybiotykoterapii. W pracy omówiono przypadek pacjenta z porażeniem n. okoruchowego w przebiegu wczesnej postaci rozsianej boreliozy.
Summary
Borreliosis is a multiorgan infectious disease transmitted by Ixodes ticks. The etiological factor is Borrelia burgdorferi sensu lato. The incidence of tick-borne diseases, especially Lyme disease, but also tick-borne encephalomyelitis, anaplasmosis and, to a lesser extent, babesiosis, is systematically increasing. The risk of human infection depends on the geographic area and the number of ticks infected by Borrelia spirochetes. Poland is one of the countries with medium and high rates of infection of ticks Ixodes ricinus with Borrelia spirochetes. The probability of having borreliosis after a one-time tocks bite is 1%, the specific anibodies production is 3-6%. There are the following clinical forms of Lyme disease: early, disseminated early and late. Neurological complications (neuroborreliosis) occur in 10-15%, or even 40% of patients. Since uniform criteria for the diagnosis have not been developed, the diagnosis of neuroborreliosis is a difficult issue. It is based on the clinical picture (contact with a tick, erythema migrans in the interview) and results of the laboratory researches (antibodies IgM or IgG classes against Borrelia burgdorferi detected in the first stage in the ELISA method, confirmed by the Western-blot method). Detection of specific anti-Borrelia burgdorferi antibodies, without clinical signs typical for Lyme disease, need not be evidence of active infection. Antibody tires not be used to assess therapeutic efficacy and can not be indicative for a re-treatment. Borrelia burgdorferi sensu lato infection does not cause permanent immunity. For diagnosis of reinfection, immunological seroconversion is required. For the early neurological syndromes occurring in the Lyme disease typical are cranial nerves palsies. The treatment involves the use of a single 14-21 day course of antibiotic therapy. The article discusses the case of the patient with oculomotor nerve palsy of the early form of disseminated Lyme disease.

WSTĘP
Borelioza (choroba z Lyme) jest chorobą zakaźną wywołaną przez krętki (około 20 gatunków). Najczęściej są to krętki z rodzaju Borrelia burgdorferi sensu lato (B. garinii i afzelii w Europie i B. burgdorferi sensu stricto w Ameryce Północnej) przenoszone przez kleszcze Ixodes (w Europie, w tym w Polsce Ixodes ricinus). Może przebiegać w trzech stadiach: wczesnym ograniczonym z zajęciem skóry (rumień pełzający i rzadko chłoniak limfocytowy skóry), wczesnym rozsianym (narządowym) jako zapalenie stawów, mięśnia sercowego lub układu nerwowego oraz późnym z trwałym uszkodzeniem zajętych narządów: skóry (przewlekłe zanikowe zapalenie skóry), układu ruchu i układu nerwowego. Według danych Państwowego Zakładu Higieny częstość zachorowań na boreliozę systematycznie rośnie – od 751 przypadków zgłoszonych w 1996 roku do 13 625 w 2015 (3) i już 17 852 zarejestrowanych do 15 listopada 2016 roku. Dominującą postacią zakażenia jest neuroborelioza ośrodkowego i obwodowego układu nerwowego (1-4).
OPIS PRZYPADKU
Siedemdziesięciodwuletni pacjent, chorujący od ponad 40 lat na cukrzycę, przyjęty został do szpitala na oddział geriatryczny z powodu wysokich od wielu tygodni wartości glikemii (poziom glukozy 15 mmol/l, HBA1C 10,3%). Skarżył się również na trwający od 2 tygodni silny ból głowy, szczególnie okolicy skroni i prawego oczodołu. Od 10 dni, po konsultacji neurologicznej (podejrzewano neuralgię n. trójdzielnego), zażywał karbamazepinę w dawce 600 mg/dobę. Dolegliwości bólowe nie zmniejszyły się.
W czasie pierwszych dni hospitalizacji chorego intensywnie nawadniano, włączono krótko działającą insulinę w pompie infuzyjnej (podawana przez 12 dni), p/bólowo tramadol, a następnie transdermalną buprenorfinę (obydwa leki odstawiono z powodu uporczywych mdłości). W wykonanych badaniach laboratoryjnych: morfologia prawidłowa, parametry zapalne niskie, bez zaburzeń elektrolitowych, RKZ prawidłowa, kreatynina 150 μmol/l, eGFR 42,4 ml/min/1,73 m2. W moczu obecne nieliczne bakterie (posiew ujemny), glukoza w stężeniu 0,4%. RTG kl. piersiowej wynik prawidłowy. W ECHO serca upośledzona podatność rozkurczowa LK, kurczliwość globalna i odcinkowa prawidłowa, EF 55%, ruchomość płatków prawidłowa. W usg j. brzusznej powiększony do 34 ml gruczoł krokowy z zaleganiem po mikcji 160 ml moczu (PSA w normie), poza tym bz. Gastroskopia prawidłowa.
W drugim tygodniu pobytu wystąpiło u chorego opadnięcie powieki prawego oka z ograniczeniem ruchomości gałki ocznej, poszerzeniem źrenicy i podwójnym widzeniem (ryc. 1). Ponieważ pacjent zgłaszał liczne ugryzienia przez kleszcze zarówno w czasie 2 miesięcy poprzedzających przyjęcie do szpitala, jak i w ciągu ostatnich 2 lat (bez rumienia wędrującego), przeprowadzono diagnostykę choroby z Lyme. Uzyskano wynik pozytywny w badaniu immunoenzymatycznym w klasie IGM 0,51 (≥ 0,32 dodatni) i IgG 1,97 (≥ 0,2 dodatni). W teście weryfikującym przeprowadzonym metodą Western-blot: w klasie IgM wynik uznano za wątpliwy [(+) OspC Ba i OspC B], natomiast w klasie IgG wyraźnie dodatni [(+) flagellina p41, p83, VIsE-Bg, VIsE-Bb, VisE-Ba]. Chorego konsultowano neurologicznie, nie wyraził zgody na nakłucie lędźwiowe w celu przeprowadzenia badania płynu mózgowo-rdzeniowego. Wykonano TK, a następnie MRI głowy – poza cechami podkorowego zaniku mózgu nie stwierdzając istotnych zmian. Do leczenia włączono ceftriakson w dawce 2 g/dobę. W ciągu 2 tygodni uzyskano istotne zmniejszenie się dolegliwości bólowych głowy, opadania powieki i poprawę widzenia. Cukrzycę wyrównano na trzech doposiłkowych dawkach insuliny krótko działającej i analogu długo działającym podawanym na noc. Pacjent wypisany został do domu w stanie dobrym, z zaleceniem kontroli w poradni chorób zakaźnych i poradni diabetologicznej (ryc. 2).
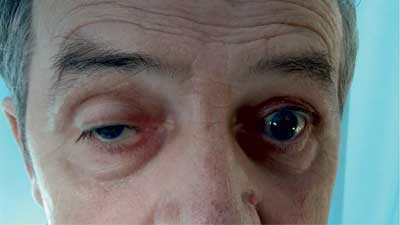
Ryc. 1. Porażenie prawego nerwu okoruchowego w przebiegu wczesnej neuroboreliozy
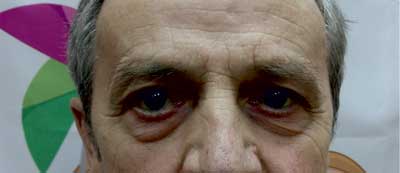
Ryc. 2. Całkowite ustąpienie objawów porażenia prawego nerwu okoruchowego 6 tygodni po zakończeniu dwutygodniowej antybiotykoterapii
DYSKUSJA
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Zajkowska J, Czupryna P, Kuśmierczyk J et al.: Analiza postaci klinicznych neuroboreliozy wśród pacjentów hospitalizowanych w Klinice Chorób Zakaźnych i Neuroinfekcji Akademii Medycznej w Białymstoku w latach 2000-2005. Prz Epidemiol 2007; 61: 59-65.
2. Flisiak R, Pancewicz S: Diagnostyka i leczenie boreliozy z Lyme. Zalecenia Polskiego Towarzystwa Epidemiologów i Lekarz Chorób Zakaźnych. Prz Epidemiol 2008; 62(1): 193-199.
3. Czarkowski MP, Cielebąk E, Staszewska-Jakubik E, Kondej B: Choroby zakaźne i zatrucia w Polsce w 2015 roku. Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny – Zakład Epidemiologii. Biuletyn roczny; 67.
4. O’Connell S: Lyme Borreliosis and Other Ixodid Tick-Borne Diseases – a European Perspective. [In:] Institute of Medicine: Critical Needs and Gaps in Understanding Prevention, Amelioration and Resolution of Lyme and Other Tick-Borne Diseases: The Short-Term and Long-Term Outcomes. The National Academies Press, Washington, D.C. 2010: 10-14.
5. Koper OM, Kamińska J, Kemona H: Badania laboratoryjne w diagnostyce neuroboreliozy. Diagn Lab 2012; 48(2): 205-211.
6. Henningsson AJ, Tjernberg I, Malmvall BE, Forsberg P et al.: Indications of Th1 and Th17 responses in cerebrospinal fluid from patients with Lyme neuroborreliosis: a large retrospective study. J Neuroinflammation 2011; 36(8).
7. Stanek G, Strle F, Gray J, Wormser GP: History and Characteristics of Lyme Borreliosis. [In:] Gray J, Kahl O, Lane RS, Stanek G: Lyme Borreliosis: Biology, Epidemiology and Control. CABI Publishing, Wallingford 2002: 10-11.
8. Coyle PK, Schutzer SE: Neurologic aspects of Lyme disease. Med Clin North Am 2002; 86(2): 261-284.
9. Blanc F, Philippi N, Cretin B et al.: Lyme neuroborreliosis and dementia. J Alzheimers Dis 2014; 41(4): 1087-1093.
10. Chmielewski T, Tylewska-Wierzbanowska S: Borelioza z Lyme, laboratoryjne metody rozpoznawania zakażenia. Samodzielna Pracownia Riketsji, Chlamydii i Krętków Odzwierzęcych. Państwowy Zakład Higieny. Diagn Lab 2007; 2(14): 5-7.
11. Mygland A, Ljøstad U, Fingerle V et al.: European Federation of Neurological Societies. EFNS guidelines on the diagnosis and management of European Lyme neuroborreliosis. Eur J Neurol 2010; 17: 8-16.
12. Jassam YN, Thler DE: Lyme meningo-radiculitis responsive to oral doxcycline therapy in the USA. Oxf Med Case Reports 2014; 9: 162-163.


