*Anna Pawełczyk1, Katarzyna Sowa-Kasprzak1, Justyna Michalak1, 2, Bogdan Kędzia2, Lucjusz Zaprutko1
Ocena aktywności antybiotycznej Z-jasmonu oraz jego pochodnych heterocyklicznych
Evaluation of antibiotic activity of Z-jasmone and its heterocyclic analogues
1Katedra i Zakład Chemii Organicznej, Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
Kierownik Katedry i Zakładu: prof. dr hab. n. farm. Lucjusz Zaprutko
2Zakład Farmakologii i Biologii Doświadczalnej, Instytut Włókien Naturalnych i Roślin Zielarskich w Poznaniu
Dyrektor Naukowy Instytutu: prof. dr n. techn. Ryszard Kozłowski
Streszczenie
Wstęp. Surowce roślinne stanowią źródło związków powszechnie stosowanych jako środki farmaceutyczne, związki biochemiczne, zapachowe, aromatyzujące czy barwniki spożywcze. Ekstrakt z kwiatów jaśminu dostarcza wielu cennych substancji o szerokim spektrum właściwości farmakologicznych. Jedną z nich jest badany w tej pracy keton 3-metylo-2-(2-Z-pentenylo)-2-cyklopenten-1-on, powszechnie nazywany Z-jasmonem.
Cel pracy. Ocena aktywności antybiotycznej Z-jasmonu i jego heterocyklicznych pochodnych.
Materiał i metody. Ocena aktywności antybiotycznej Z-jasmonu i jego pochodnych heterocyklicznych została przeprowadzona wobec szczepu wzorcowego Staphylococcus aureus ATCC 6538P. Natomiast aktywność antybiotyczną aktywnego Z-jasmonu przeprowadzono wobec wybranych szczepów bakterii i grzybów izolowanych z materiału klinicznego i surowców zielarskich. Aktywność badanych substancji określono na podstawie wartości minimalnego stężenia hamującego MIC i minimalnego stężenia bakteriobójczego MBC.
Wyniki. Z-jasmon wykazuje znacznie większą aktywność względem szczepu wzorcowego Staphylococcus aureus ATCC 6538P w porównaniu do jego pochodnych heterocyklicznych.
Wnioski. Zmiany strukturalne w obrębie pierścienia cyklopentanu i pięciowęglowego łańcucha bocznego cząsteczki jasmonu mają negatywny wpływ na aktywność antybiotyczną badanych pochodnych w porównaniu do Z-jasmonu.
Summary
Introduction. Plant materials are a traditional source of many of the active compounds commonly used as pharmaceuticals, fragrances, flavours and food colours. The jasminum flower extract provides valuable substances with broad spectrum of pharmacological properties. One of them is examined in this work 3-methyl-2-(2-Z-pentenyl)-2-cyclopenten-1-one, commonly named Z-jasmone.
Aim. The study of antibiotic activity of Z-jasmone and their heterocyclic derivatives.
Material and methods. Antibiotic activity determination of Z-jasmone and its heterocyclic derivatives was performed against the Staphylococcus aureus ATCC 6538P reference strain. Then antibiotic activity of active Z-jasmone against selected strains of bacteria and fungi isolated from clinical materials and herbal raw materials was evaluated. The activity of the tested substances was determined on the basis of the values of the minimum inhibitory concentration MIC and the minimum bactericidal concentration MBC.
Results. Z-Jasmone shows significantly higher activity against to the reference strain Stapylococcus aureus ATCC 6538P compared to its heterocyclic derivatives.
Conclusions. The structural modifications of the cyclopentane ring and the five-carbon side chain of jasmone molecule have a negative effect on the antibiotic activity of the tested derivatives in comparison to the Z-jasmone.

Wprowadzenie
Surowce roślinne stanowią tradycyjne źródło wielu aktywnych związków powszechnie stosowanych jako środki farmaceutyczne, związki biochemiczne, zapachowe, aromatyzujące czy barwniki spożywcze. Również rodzaj Jasminum, z rodziny Oliwkowatych (Oleaceae), obejmujący ponad 200 gatunków krzewów i pnączy, dostarcza wielu cennych substancji o szerokim spektrum właściwości farmakologicznych (1). Dlatego wybrane składniki, od momentu wyizolowania z materiału naturalnego i określenia ich struktury, budzą duże zainteresowanie i są przedmiotem licznych badań. Otrzymywane są przy wykorzystaniu coraz to nowszych metod syntezy oraz poddawane różnorodnym modyfikacjom chemicznym prowadzącym do powstania ich różnorodnych analogów o nowych i nieznanych jeszcze właściwościach.
Powszechnie stosowany ekstrakt z kwiatów Jasminum officinale var. grandiflorum zawiera ponad 250 substancji, będących głównie mono-, di-, tri- i seskwiterpenami, alkoholami, fenolami, związkami karbonylowymi, kwasami, estrami i laktonami, a także różnymi chemicznie kombinacjami tych związków.
Roślina ta występuje w stanie naturalnym głównie w tropikalnych rejonach Azji i Afryki, a wybrane gatunki uprawiane są również w Europie. Ze względu na swoją intensywną, trwałą oraz ciepłą, słodką i kwiatową nutę, ekstrakt z kwiatów jaśminu cieszy się dużą popularnością w przemyśle perfumeryjnym (1). Cennymi i kluczowymi składnikami naturalnego ekstraktu z kwiatów jaśminu są jasmonoidy i to one w pełni decydują o ich oryginalnym zapachu. Jasmonoidy stanowią relatywnie wąską, ale bardzo ważną grupę związków (2). Ważnym reprezentantem tej grupy jest badany w tej pracy 3-metylo-2-(2-Z-pentenylo)-2-cyklopenten-1-on, popularnie zwany Z-jasmonem, a także kwas jasmonowy oraz jego ester – jasmonian metylu (2, 3) (ryc. 1 a-c).
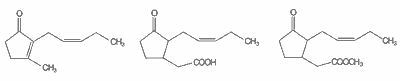
Ryc. 1a-c. Budowa chemiczna głównych jasmonoidów: a – Z-jasmon, b – kwas jasmonowy, c – jasmonian metylu
Te ketonowe związki, powstające w wyniku biosyntezy z nienasyconych kwasów tłuszczowych, pełnią w roślinach rolę fitohormonów – warunkują kontakt z otoczeniem, wytwarzają barierę ochronną przed owadami, odpowiadają za wytwarzanie enzymów roślinnych oraz stymulują procesy biosyntezy. Działają także jako przekaźniki sygnałów w odpowiedzi komórkowej, są regulatorami licznych ważnych funkcji biologicznych, m.in. procesów wzrostu (2).
Z terapeutycznego punktu widzenia zapach jaśminu ma znaczący wpływ na ludzki umysł i ciało. Działa on tonizująco na organizm człowieka, przyczynia się do koncentracji uwagi, zwiększa zdolność do pracy. Uważany jest za środek uspokajający, przeciwdepresyjny, przeciwstresowy, antyseptyczny i przeciwzapalny (3). Ponadto, inne części rośliny, takie jak: łodygi, liście i korzenie, są bardzo ważne i potencjalnie użyteczne w przemyśle farmaceutycznym (4).
Cel pracy
Celem pracy była ocena aktywności antybiotycznej Z-jasmonu i jego pochodnych heterocyklicznych wobec szczepu wzorcowego Staphylococcus aureus, a także Z-jasmonu wobec szczepów pochodzenia klinicznego i szczepów wyizolowanych z surowców zielarskich.
Materiał i metody
Badane substancje
Badaniami objęto Z-jasmon (Aldrich) oraz cztery jego pochodne heterocykliczne zawierające modyfikacje strukturalne w obrębie pięciocyklicznego pierścienia – zastąpienie atomów węgla heteroatomami (N, O) oraz pięciowęglowego podstawnika bocznego w pozycji C-2 Z-jasmonu (nasycenie łańcucha) (tab. 1) (5, 6).
Tab. 1. Z-jasmon i jego pochodne heterocykliczne
| Nr próbki | Wzór | Nazwa |
| 1 | 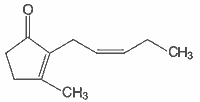 | Z-jasmon (3-metylo-2-(2-Z-pentenylo)-2-cyklopenten-1-on) |
| 2 | 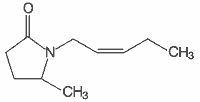 | 5-metylo-1-(Z-2-pentenylo)-2-pirolidynon |
| 3 | 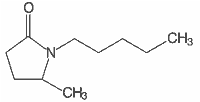 | 5-metylo-1-pentylo-2-pirolidynon |
| 4 | 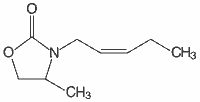 | 4-metylo-3-(Z-2-pentenylo)-2-oksazolidynon |
| 5 | 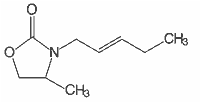 | 4-metylo-3-(E-2-pentenylo)-2-oksazolidynon |
Szczepy użyte w badaniach
Szczep wzorcowy – Staphylococcus aureus ATCC 6538P (American Type Culture Collection).
Szczepy pochodzenia klinicznego (Nr 1, Nr 3, Nr 4, Nr 5, Nr 7, Nr 9) oraz wyizolowane z surowców zielarskich (Nr 2, Nr 6, Nr 8). Należały one do następujących grup drobnoustrojów:
1. Ziarniaki Gram-dodatnie:
– Staphylococcus aureus MRSA (metycylinooporny) 15062,
– Enterococcus faecalis 8040/1.
2. Pałeczki Gram-ujemne:
– Klebsiella pneumoniae 291,
– Escherichia coli PZH 026B6,
– Salmonella enteritidis S59,
– Pseudomonas aeruginosa Sept. 58/2.
3. Grzyby drożdżoidalne:
– Candida albicans PCM 1409 PZH.
4. Grzyby pleśniowe:
– Aspergillus flavus 95/1.
5. Dermatofity:
– Microsporum gypseum K1.
Podłoża stosowane w badaniach
1. Antibiotic medium (AM) – Merck (płynne),
2. Agar tryptozowo-sojowy (TSA) – bioMèrieux (stałe),
3. Bulion Sabourauda z 2% glukozą (SAB) – Merck (płynne),
4. Agar Sabourauda z 2% glukozą (SAB) – Merck (stałe).
Przygotowanie próbek do badań
Próbki do oceny aktywności antybiotycznej przygotowano metodą seryjnych rozcieńczeń próbki podstawowej w DMSO (100 mg/ml – rozcieńczenie podstawowe) w zakresie stężeń 0,1-10 mg/ml oraz 0,25-5 mg/ml w odpowiednim podłożu płynnym (AM – bakterie, SAB – grzyby).
Oznaczanie aktywności antybiotycznej
Aktywność antybiotyczną badanych substancji określono na podstawie wyznaczonych wartości minimalnego stężenia hamującego MIC i minimalnego stężenia bakteriobójczego MBC, w odniesieniu do substancji referencyjnej – chloramfenikolu. Oznaczone wartości MIC i MBC dla chloramfenikolu w odniesieniu do szczepu wzorcowego Staphylococcus aureus ATCC 6538P wynosiły 0,0005 mg/ml (MIC = MBC).
Badanie polegało na wprowadzeniu do próbek z określonymi, malejącymi rozcieńczeniami seryjnymi badanych substancji, odpowiedniej objętości zawiesiny (0,1 ml) drobnoustrojów w podłożu płynnym (AM – bakterie, SAB – grzyby) o znanym inokulum (105 jednostek tworzących kolonie/ml). Następnie próbki inkubowano w cieplarce przez okres 18 godz. w przypadku bakterii i grzybów drożdżoidalnych (37°C) oraz przez 5-7 dni w przypadku grzybów pleśniowych i dermatofitów (30°C). Po inkubacji odczytywano wartość MIC dla badanej próbki przez obserwację obecności zmętnienia w danym stężeniu (rozwój hodowli), które wskazywało na wzrost szczepu. Następnie jałową ezą przenoszono odpowiednie stężenia na określone podłoża stałe (TSA – bakterie, SAB – grzyby). Po kolejnej inkubacji w odpowiednich warunkach oceniano wartość MBC, tj. najmniejsze stężenie substancji, przy którym nie obserwowano wzrostu drobnoustrojów.
Dla każdego badania aktywności antybiotycznej dołączano kontrolę, inkubowaną w takich samych warunkach (kontrola wzrostu szczepu, kontrola jałowości podłoża).
Kryteria aktywności antybiotycznej
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Pawełczyk A, Zaprutko L. Jasmine and their varieties in perfumery. Pol J Cosmet 2011; 14(2):82-7.
2. Cheong JJ, Choi YD. Methyl jasmonate as a vital substance in plants. Trends Genet 2003; 19:409-13.
3. Kurek A, Zaprutko L. Substancje o zapachu jaśminu. Pol J Cosmet 2004; 3:140-53.
4. Joy P, Raja DP. Anti-bacterial activity studies of Jasminum grandiflorum and Jasminum sambac. Ethnobot Leaflets 2008; 12:481-3.
5. Pawełczyk A, Zaprutko L. Microwave assisted synthesis of fragrant jasmone heterocyclic analogues. Eur J Med Chem 2006; 41:586-91.
6. Pawełczyk A, Zaprutko L. Microwave assisted synthesis of unsaturated jasmone heterocyclic analogues as new fragrant substances. Eur J Med Chem 2009; 44:3032-9.

