*Marlena Hupało1, Dariusz J. Jaskólski1, 2
Neurofizjologiczna protekcja struktur nerwowych podczas operacji guzów pnia mózgu
Neurophysiological monitoring for surgery of brainstem tumours
1Oddział Kliniczny Neurochirurgii i Onkologii Centralnego Układu Nerwowego, Uniwersytecki Szpital Kliniczny nr 1 im. N. Barlickiego w Łodzi
Ordynator Oddziału: prof. UMŁ dr hab. med. Dariusz J. Jaskólski
2Klinika Neurochirurgii i Onkologii Układu Nerwowego, Uniwersytet Medyczny w Łodzi
Kierownik Kliniki: prof. UMŁ dr hab. med. Dariusz J. Jaskólski
Streszczenie
Mimo znacznego rozwoju metod obrazowania OUN oraz techniki mikrochirugicznej, operacje guzów pnia mózgu wciąż pozostają wielkim wyzwaniem dla neurochirurga, gdyż obarczone są znacznym ryzykiem ciężkich deficytów neurologicznych po zabiegu. Bezpieczne strefy wejścia (ang. safety entry zones) w głąb pnia mózgu są trudne do identyfikacji, zwłaszcza w stanach patologicznych. Stąd przydatność metod neurofizjologicznych pozwalających na ustalenie położenia (mapowanie) i śródoperacyjne monitorowanie integralności pobliskich struktur nerwowych, zwłaszcza jąder ruchowych nerwów czaszkowych i dróg korowo-jądrowych. W pracy przedstawiono szczegółowo technikę mapowania jąder ruchowych nerwów czaszkowych (VII, IX, X, XI i XII) w dnie komory IV, poprzez identyfikację wzgórka nerwu twarzowego, jądra dwuznacznego (trójkąta nerwu błędnego) i trójkąta nerwu podjęzykowego, oraz lokalizowanie jąder ruchowych nerwów III, IV i VI w śródmózgowiu i moście. Ponadto omówiono przydatność kliniczną metody monitorowania dróg korowo-jądrowych za pomocą ruchowych potencjałów wywołanych (ang. MEPs).
Summary
Despite a considerable progress of both neuroimaging and microsurgical techniques, brainstem surgery remains a great challenge as carrying a substantial risk of postoperative disabling neurological deficit. At surgery, the safe entry zones into the brainstem are quite difficult to define, particularly under pathological conditions. Thus, intraoperative neurophysiological techniques come handy allowing to map and subsequently to monitor integrity of neighbouring neural structures, namely motor nuclei of the cranial nerves and the corticonuclear tracts. In this paper we presented in detail the techniques of the cranial nerves motor nuclei mapping, e.g. nn. VII, IX, X, XI and XII in the floor of the fourth ventricle, by means of identifying the facial colliculus, nucleus ambiguus (the vagal triangle) and hypoglossal triangle, as well as the motor nuclei of the III, IV and VI nerves in the midbrain and pons. Moreover, we reviewed the issue of the corticonuclear tracts monitoring by means of the motor evoked potentials, MEPs.

WSTĘP
Jeszcze do lat 70. XX wieku guzy pnia mózgu uważano za nieoperacyjne, zawsze rosnące w sposób rozlany i naciekający, a interwencja chirurgiczna ograniczała się co najwyżej do biopsji, która zwykle obarczona była znacznym ryzykiem. Rozwój badań obrazowych, a zwłaszcza MR, był czynnikiem kluczowym do zmiany spojrzenia na problem dostępności chirurgicznej guzów pnia mózgu, umożliwiając ich podział ze względu na typ wzrostu na: egzofityczne, ogniskowe, rozlane i opuszkowo-szyjne (1, 2).
Zazwyczaj interwencje chirurgiczne przeprowadza się w przypadkach guzów egzofitycznych i ogniskowych, zwłaszcza tych rosnących przy grzbietowej powierzchni pnia, w śródmózgowiu i rdzeniu przedłużonym (2-5). Są to najczęściej wolno rosnące wysoko zróżnicowane gwiaździaki (ang. low grade gliomas, WHO I, II), zatem ich usunięcie może zapewnić wyleczenie (ryc. 1a, b). Jednakże mimo znacznego rozwoju w ostatnich latach metod neuroobrazowania, techniki mikrochirurgicznej, neuroanestezjologii oraz neurofizjologii śródoperacyjnej, operacje guzów pnia mózgu nadal pozostają wielkim wyzwaniem dla neurochirurga. Skomplikowana struktura anatomiczna i funkcjonalna pnia mózgu – liczne jądra nerwów czaszkowych, zagęszczenie nerwów oraz pęczków, dróg i sieci neuronalnych, obecność ośrodków krążenia i oddychania, powoduje, że sama operacja jest bardzo niebezpieczna i niesie ze sobą znaczne ryzyko ciężkiego kalectwa (6). Najcięższe powikłania pooperacyjne mogą manifestować się zaburzeniami napędu oddechowego (dyspnea) i zaburzeniami rytmu pracy serca, obwodowym uszkodzeniem nerwu twarzowego (jedno- lub obustronnym), porażeniem i atrofią języka, zaburzeniami połykania (dysfagia), porażeniem strun głosowych (dysphonia i dysartria), zniesieniem odruchu kaszlowego prowadzącym do zachłystowego zapalenia płuc, a także obustronnym opadnięciem powiek i porażeniem spojrzenia do góry.
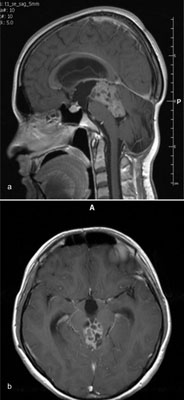
Ryc. 1a, b. Egzofityczny guz pnia mózgu – histopatologicznie nerwiak ośrodkowy, WHO II. Obrazy MRI z kontrastem ważone w czasie relaksacji podłużnej, przekrój strzałkowy (a) i poprzeczny (b)
Aż do lat 90. XX wieku jedynymi metodami śródoperacyjnej oceny funkcji struktur pnia mózgu były tylko słuchowe potencjały wywołane pnia mózgu (ang. brainstem auditory evoked potentials – BAEPs) oraz somatosensoryczne potencjały wywołane (ang. somatosensory evoked potentials – SEPs). Jednakże metody te, nawet stosowane łącznie, monitorują tylko ok. 20% struktur pnia, a przy tym nie dają podczas zabiegu żadnych informacji o stanie dróg zstępujących (piramidowych) (7). Co więcej, dokumentują one tylko uszkodzenie struktur nerwowych, nie ostrzegając o potencjalnym zagrożeniu. Dopiero po opracowaniu przez Taniguchi i wsp. (8) techniki rejestracji ruchowych potencjałów wywołanych (ang. motor evoked potentials – MEPs) u chorych znieczulonych, nastąpił szybki rozwój neurofizjologii śródoperacyjnej, z możliwością oceny funkcjonalnej ciągłości dróg korowo-rdzeniowych i korowo-opuszkowych, co bez wątpienia znacznie poprawiło komfort operacyjny neurochirurga i zwiększyło bezpieczeństwo neurologiczne chorego w czasie operacji guzów pnia mózgu.
W warunkach prawidłowych istnieją i są dobrze znane przez neurochirurgów anatomiczne punkty orientacyjne w dnie komory IV (ang. landmarks), będące swego rodzaju „drogowskazami”, wyznaczającymi bezpieczne strefy wejścia (ang. safety entry zones) w głąb grzbietowej powierzchni śródmózgowia, mostu czy rdzenia przedłużonego (9-11). Ich identyfikacja pomaga w dostępie do guza w sposób pozwalający uniknąć ciężkie deficyty neurologiczne. Zatem przed rozpoczęciem resekcji należy zidentyfikować w dnie komory IV położenie jąder ruchowych nerwów czaszkowych poprzez lokalizację wzgórka twarzowego, trójkąta nerwu podjęzykowego oraz trójkąta nerwu błędnego. Jednakże w stanach patologicznych prawidłowe stosunki anatomiczne bywają zmienione przez proces rozrostowy, a wówczas konieczna staje się neurofizjologiczna pomoc (mapowanie i monitorowanie śródoperacyjne (ang. intraoperative neuromonitoring – IOM) w celu lokalizacji ważnych struktur nerwowych, a następnie oceny ich funkcjonalnej integralności podczas dalszych etapów zabiegu operacyjnego (12). Ciągły śródoperacyjny monitoring pozwala wykryć zagrażające strukturom i szlakom nerwowym uszkodzenia spowodowane uciskiem, pociąganiem bądź zaburzeniami perfuzji, a wczesne ostrzeżenie neurochirurga pozwala mu zmodyfikować strategię operacyjną, umożliwiając określenie granic bezpiecznej resekcji guza.
Istnieją dwie podstawowe techniki IOM: mapowanie, tj. lokalizacja struktur nerwowych i nerwów, oraz monitorowanie, tj. ciągła ocena funkcjonalnej integralności struktur nerwowych i nerwów w czasie rzeczywistym podczas operacji.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Epstein FJ, Farmer JP: Brainstem glioma growth patterns. J Neurosurg 1993; 78: 408-412.
2. Fischbein NJ, Prados MD, Wara W et al.: Radiologic classification of brain stem tumors: correlation of magnetic resonance imaging appearance with clinical outcome. Pediatr Neurosurg 1996; 77: 9-23.
3. Epstein FJ, Wisoff J: Intra-axial tumors of the cervicomedullary junction. J Neurosurg 1987; 67: 483-487.
4. Hoffman HJ, Becker LE, Craven MA: A clinically and pathologically distinct group of benign brain stem gliomas. Neurosurgery 1980; 7: 243-248.
5. Porter RW, Detwiler PW, Spetzler RF: Surgical approaches to the brain stem. Operat Tech Neurosurg 2000; 3: 114-123.
6. Sala F, Manganotti P, Tramontano V et al.: Monitoring of motor pathways during brain stem surgery: what we have achieved and what we still miss? Neurophysiol Clin 2007; 37: 399-406.
7. Fahlbusch R, Stauss C: Surgical significance of cavernous hemangioma of the brain stem. Zentralbl Neurochir 1991; 52: 25-32.
8. Taniguchi M, Cedzich C, Schramm J: Modification of cortical stimulation for motor-evoked potentials under general anesthesia: technical description. Neurosurgery 1993; 32: 219-226.
9. Kyoshima K, Kobayashi S, Gibo H, Kuroyanagi T: A study of safe entry-zones via the floor of the forth ventricle for brain-stem lesions: report of three cases. J Neurosurg 1993; 78: 987-993.
10. Stauss C, Lutjen-Drecoll E, Fahlbusch R: Pericollicular surgical approaches to the rhomboid fossa. Part I: Anatomical basis. J Neurosurg 1997; 87: 893-899.
11. Morota N, Deletis V, Lee M, Epstein FJ: Functional anatomic relationship between brain-stem tumors and cranial motor nuclei. Neurosurgery 1996; 39: 787-793.
12. Morota N, Deletis V, Epstein FJ et al.: Brain stem mapping: Neurophysiological localization of motor nuclei on the fourth ventricle. Neurosurgery 1995; 37: 922-930.
13. Deletis V, Fernandez-Conejero I: Intraoperative monitoring and mapping of the functional integrity of the brainstem. J Clin Neurol 2016; 12: 262-273.
14. Morora N, Ihara S, Deletis V: Intraoperative neurophysiology for surgery in and around the brainstem: role of brainstem mapping and corticobulbar tract motor-evoked potential monitoring. Childs Nerv Syst 2010; 26: 513-521.
15. Strauss C, Romstock J, Nimsky C, Fahlbusch R: Intraoperative identification of motor areas of the rhomboid fossa using direct stimulation. J Neurosurg 1993; 79: 393-399.
16. Morota N, Deletis V: The importance of brainstem mapping in brainstem surgical anatomy before the fourth ventricle and implication for intraoperative neurophysiological mapping. Acta Neurochir (Wien) 2006; 148: 499-509; discussion 509.
17. Suzuki K, Matsumoto M, Ohta M et al.: Experimental study for identification of the facial colliculus using electromyography and antidromic-evoked potentials. Neurosurgery 1997; 41: 1130-1136.
18. Ishihara H, Bjeljac M, Straumann D et al.: The role of intraoperative monitoring of oculomotor and trochlear nuclei-safe entry-zone to tegmental lesions. Minim Invasive Neurosurg 2006; 49: 168-172.
19. Deletis V, Sala F, Morota N: Intraoperative neurophysiological monitoring and mapping during brain stem surgery: a modern approach. Operative Tech Neurosurg 2000; 2: 109-113.
20. Dong CC, MacDonald DB, Akagami R et al.: Intraoperative facial motor evoked potential monitoring with transcranial electrical stimulation during skull base surgery. Clin Neurophysiol 2005; 116: 599-596.
21. Deletis V, Fernandez-Conejero I, Ukatan S, Constantino P: Methodology for intraoperatively eliciting motor evoked potentials in the vocal muscles by electrical stimulation of the corticobulbar tract. Clin Neurophysiol 2009; 120: 336-341.
22. Sekiya T, Hatayama T, Shimamura N, Susuki S: Intraoperative electrophysiological monitoring of oculomotor nuclei and their intramedullary tracts during midbrain tumor surgery. Neurosurgery 2000; 47: 1170-1177.
23. Verst SM, Sucena AC, Maldaun MV, Aguiar PH: Effectiveness of C5 or C6-Cz assembly in predicting immediate post operative facial nerve deficit. Acta Neurochir (Wien) 2013; 155: 1863-1869.
24. Ulkatan S, Deletis V, Fernandez-Conejero I: Central or peripheral activation of the facial nerve? J Neurosurg 2007; 106: 519-520.

