*Sławomir Glinkowski, Daria Marcinkowska
Leczenie chirurgiczne w gwałtownie postępującej aktywnej postaci wrzodziejącego zapalenia jelita grubego – opis przypadku
Surgical treatment of rapidly advancing active ulcerative colitis: a case report
Department of General and Oncological Surgery, Health Centre in Tomaszów Mazowiecki
Head of Department: Włodzimierz Koptas, MD, PhD
Streszczenie
Wrzodziejące zapalenie jelita grubego należy do nieswoistych chorób zapalnych jelit o różnorodnym obrazie klinicznym. Ze względu na zaburzoną odpowiedź immunologiczną w obrębie tkanki jelitowej dochodzi do powstania rozlanego zapalenia, co prowadzi do występowania krwawień oraz biegunek. Podstawą rozpoznania jest obraz kliniczny oraz wynik badania kolonoskopowego, które potwierdza zapalne zmiany w obrębie jelita grubego.
Autorzy prezentują przypadek pacjenta przyjętego do oddziału po dwóch hospitalizacjach w innych ośrodkach, cierpiącego na aktywną postać wrzodziejącego zapalenia jelita grubego. Po wykluczeniu etiologii bakteryjnej oraz próbie leczenia zachowawczego na Oddziale Gastroenterologii pacjenta skierowano do Oddziału Chirurgicznego. W kolonoskopii wykonanej w trakcie poprzedniej hospitalizacji opisywano zmianę w okolicy zagięcia śledzionowego uniemożliwiającą uwidocznienie dalszego odcinka jelita grubego. Kolonoskopia wykonana na Oddziale nie potwierdziła występowania tej zmiany, a uwidoczniła liczne pseudopolipy. Z uwagi na gwałtownie postępujące wyniszczenie oraz anemizację, a także ze względu na brak poprawy po próbie leczenia farmakologicznego zdecydowano o wykonaniu pilnej kolektomii z wytworzeniem ileostomii końcowej. Po tygodniowym przygotowaniu pacjenta (żywienie pozajelitowe, przetoczenie KKCz) wykonano pankolektomię. Badanie histopatologiczne potwierdziło ostrą fazę wrzodziejącego zapalenia jelita grubego. W przebiegu pooperacyjnym doszło do masywnego zakażenia rany, które było leczone przez 14 dni terapią podciśnieniową (VAC). Pacjent na Oddziale Chirurgicznym był leczony 30 dni. W stanie ogólnym dobrym został wypisany do domu z zaleceniem dalszej opieki ambulatoryjnej.
Summary
Ulcerative colitis is an inflammatory bowel disease with various clinical presentation. Due to an impaired immune response, diffuse inflammation develops in the intestinal tissue, which leads to bleeding and diarrhoea. The basis for diagnosis is the clinical presentation and the result of colonoscopy which confirms the presence of inflammatory lesions in the colon.
The authors present the case of a patient admitted to their department following two previous hospitalisations at other centres who was suffering from active ulcerative colitis. After bacterial aetiology of the disease was excluded and conservative treatment was attempted at a gastroenterology ward, the patient was referred to a surgical department. During the previous hospitalisation colonoscopy was performed in which a lesion was observed in the splenic flexure, which precluded the visualisation of the further part of the colon. A colonoscopy performed at the surgical department did not confirm the presence of that lesion; however, it did reveal multiple pseudopolyps. Due to rapidly progressing cachexia and anaemia and a lack of improvement following attempted pharmacological treatment, a decision was made to perform an urgent colectomy with end ileostomy. After a week-long preparation of the patient (parenteral nutrition, packed red blood cells transfusion), pancolectomy was performed. Histopathological examination confirmed acute phase ulcerative colitis. In the postoperative period massive wound infection developed, which was treated for 14 days with vacuum therapy (VAC). The patient was treated for 30 days at the surgical department. He was discharged in a good general condition and instructed to report to his outpatient care centre.

Wprowadzenie
Wrzodziejące zapalenie jelita grubego należy do nieswoistych chorób zapalnych jelit. Jest to choroba o wieloczynnikowej etiologii oraz różnorodnym obrazie klinicznym. Choroba występuje na całym świecie, ale największą zachorowalność obserwuje się wśród rasy białej, głównie w krajach Europy (WZJG: 505/100 000 w Norwegii; CD: 322/100 000 w Niemczech) i Ameryki Północnej (WZJG: 286/100 000 w USA; CD: 319/100 000 w Kanadzie). Zapadalność w Europie wynosi ok. 10/100 000 populacji. Rozpowszechnienie nieswoistych chorób zapalnych jelit przekroczyło 0,3% w Ameryce Północnej, Oceanii i wielu krajach Europy (1). Największą zapadalność obserwuje się pomiędzy 20. a 40. rokiem życia, jednak choroba może wystąpić zarówno u dzieci, jak i u osób starszych. Obserwowana jest podobna zachorowalność wśród kobiet i mężczyzn, w przeciwieństwie do choroby Leśniowskiego-Crohna, na którą częściej cierpią kobiety (2). Choroby zapalne jelit częściej występują u osób zamieszkałych w mieście oraz wykonujących pracę biurową (3).
W zależności od zajętego obszaru jelita pacjenci mogą zgłaszać różne objawy. Pierwszym objawem mogącym nakierować lekarza na rozpoznanie WZJG najczęściej jest biegunka (zwykle utrzymująca się powyżej 6 tygodni) z domieszką krwi w stolcu. Liczba wypróżnień może wynosić nawet 20 na dobę. W przypadku gdy zmiany nie przekraczają odbytnicy, rytm wypróżnień może być niezaburzony, a jedynym występującym objawem mogą być zaparcia z domieszką krwi, a niekiedy również towarzyszącym bólem brzucha. Przebieg choroby jest przewlekły, występują okresy zaostrzeń i remisji.
Podstawowym badaniem, zarówno w celu rozpoznania choroby, jak i monitorowania jej przebiegu oraz nadzoru onkologicznego, jest kolonoskopia.
Podział kliniczny postaci WZJG wynika z potrzeby określenia granicy prowadzenia leczenia miejscowego, po przekroczeniu której konieczne jest włączenie leczenia systemowego. W 2005 roku w Montrealu podczas Światowego Kongresu Gastroenterologii zaproponowano klasyfikację WZJG opartą na rozległości zmian w jelicie grubym (4).
Według tej klasyfikacji wyróżniamy:
– E1 (ang. proctitis) – zapalenie odbytnicy, gdy zmiany w błonie śluzowej nie wykraczają poza odbytnicę (proksymalna granica zmian nie przekracza zagięcia odbytniczo-esiczego). W tej postaci dominującą skargą pacjentów jest uczucie gwałtownego parcia na stolec, krwawienie z dolnego odcinka przewodu pokarmowego, możliwe jest występowanie zaparć,
– E2 – postać dystalną/lewostronną, w której zmieniony jest dalszy odcinek jelita grubego, ale zmiany nie przekraczają zagięcia śledzionowego okrężnicy,
– E3 – postać rozległą, w której zmiany sięgają proksymalnie poza zagięcie śledzionowe okrężnicy, czasem obejmując nawet całe jelito grube (ang. pancolitis), a niekiedy mogą sięgać dalszego odcinka jelita krętego.
W przypadku postaci rozległej objawy są bardziej nasilone, może występować krwawienie z dolnego odcinka przewodu pokarmowego. Obecne jest gwałtowne uczucie parcia na stolec, w kale może pojawić się domieszka treści śluzowo-ropnej, pacjenci skarżą się na nocne wypróżnienia oraz opisują bóle brzucha, często zlokalizowane w okolicy lewego dołu biodrowego, nasilające się bezpośrednio przed wypróżnieniem i ustępujące po wypróżnieniu.
Obraz kliniczny pacjentów chorujących na WZJG bywa bardzo zróżnicowany. Autorzy przedstawiają przypadek 61-letniego mężczyzny, u którego choroba miała krótkotrwały i bardzo gwałtowny przebieg zmuszający do podjęcia agresywnego leczenia.
Opis przypadku
Pacjent, lat 61, został przyjęty na Oddział Chirurgii Ogólnej i Onkologicznej Tomaszowskiego Centrum Zdrowia w Tomaszowie Mazowieckim z rozpoznaniem wrzodziejącego zapalenia jelita grubego (WZJG) oraz opisanym w kolonoskopii zwężeniem jelita w okolicy zagięcia śledzionowego (podejrzenie zmiany rozrostowej), celem rozszerzenia diagnostyki oraz ewentualnego leczenia operacyjnego. W wywiadzie zgłaszał znaczne osłabienie, utratę ok. 20 kg masy ciała w przeciągu 2 miesięcy oraz utrzymujące się od 3 miesięcy biegunki z domieszką krwi, nawet do 9 na dobę. Negował ból brzucha oraz wymioty, kilkukrotnie wystąpiły epizody nudności.
Chory 3 lata wcześniej z powodu bloku przedsionkowo-komorowego II stopnia z zespołem pre-MAS miał wszczepiony kardiowerter-defibrylator. W wywiadzie cukrzyca insulinozależna oraz stan po cholecystektomii.
Miesiąc wcześniej, z powodu utrzymującej się od kilkunastu dni krwistej biegunki, pacjent był hospitalizowany na Oddziale Chorób Zakaźnych, Tropikalnych i Pasożytniczych Kliniki Chorób Zakaźnych i Hepatologii. Na podstawie wykonanych badań wykluczono etiologię zakaźną biegunki. W wykonanym badaniu TK jamy brzusznej stwierdzono: „okolica zagięcia śledzionowego o nieregularnie pogrubiałych ścianach i nieregularnym świetle, odcinek nie wykazuje perystaltyki – podejrzenie procesu rozrostowego. Widoczne jest zgrubienie ścian jelita grubego, na całym odcinku, z cechami zmian zapalnych”. Wniosek z badania: „nie można wykluczyć zmian rozrostowych w obrębie przewodu pokarmowego”. Pacjenta zakwalifikowano do powtórnej kolonoskopii celem pobrania wycinka błony śluzowej do badania histopatologicznego. Z uwagi na złe przygotowanie pacjenta do badania, aparat wprowadzono jedynie do 55 cm jelita. W obrazie endoskopowym jelito było sztywne, błona śluzowa zstępnicy, esicy i częściowo odbytnicy silnie przekrwiona, zaczerwieniona, krucha, krwawiąca przy dotyku aparatem. Widoczne były liczne polipy w esicy, średnicy 2-5 mm. W esicy stwierdzono także liczne, płytkie uchyłki. W wyniku badania histopatologicznego wycinków z esicy, zstępnicy i odbytnicy zaobserwowano zmiany charakterystyczne dla colitis ulcerosa w okresie aktywnym. Zastosowano wstępne leczenie zachowawcze: sulfadiazynę oraz sterydy. Ze względu na anemię przetoczono 2 j. KKCz. W badaniach laboratoryjnych uwagę zwracała podwyższona wartość antygenu karcinoembrionalnego (CEA): 8,88 ng/ml (n: 0,00-3,40). Pacjent po zastosowanym leczeniu został przeniesiony do dalszej diagnostyki do Kliniki Gastroenterologii.
W Klinice Gastroenterologii ponownie wykonano kolonoskopię, w której uwidoczniono błonę śluzową odbytnicy, esicy i zstępnicy obrzękniętą na całej powierzchni, o nierównej, brukowanej powierzchni, z obecnością licznych owrzodzeń średnicy do 5-6 mm, pokrytych włóknikiem, miejscami krwawiącą kontaktowo. W okolicy zagięcia śledzionowego błona śluzowa była silnie obrzęknięta – przejście kolonoskopem było niemożliwe. Po zmianie endoskopu na aparat o mniejszej średnicy dotarto do proksymalnego odcinka poprzecznicy, uwidaczniając podobne zmiany. Wynik badania histopatologicznego wycinków pobranych do badania potwierdził rozpoznanie aktywnej fazy wrzodziejącego zapalenia jelita grubego. Pacjentowi włączono terapię farmakologiczną – mesalazynę doustnie oraz w postaci wlewek doodbytnicznych, azatioprynę doustnie, metronidazol, albuminy, suplementację żelaza, produkt wysokobiałkowy jako uzupełnienie diety oraz preparat zawierający szczepy bakterii jelitowych. Kontynuowano terapię glikokortykosteroidami (Encorton 30-20-0 mg). Pacjenta wypisano do domu, następnego dnia zgłosił się na leczenie na Oddział Chirurgii Ogólnej.
Na Oddziale Chirurgicznym, po uprzednim przygotowaniu jelita grubego, pacjenta ponownie zakwalifikowano do kolonoskopii, która uwidoczniła zmiany charakterystyczne dla aktywnej postaci wrzodziejącego zapalenia jelita grubego. Endoskopista bez problemu przeszedł przez okolicę zagięcia śledzionowego, nie stwierdzając znaczącego przewężenia, które uniemożliwiło wykonanie pełnej kolonoskopii przy poprzednim badaniu (ryc. 1, 2).
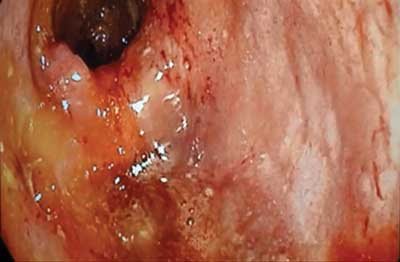
Ryc. 1. Obraz z kolonoskopii
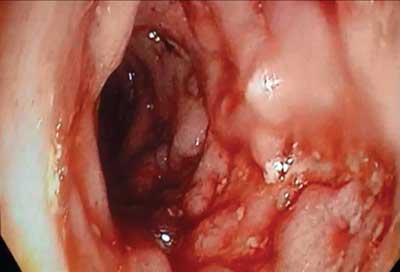
Ryc. 2. Obraz z kolonoskopii (okolica zagięcia śledzionowego)
W dodatkowo wykonanych badaniach uwagę zwracały: WBC = 3,1 tys./mm3, RBC = 2,67 mln/mm3, Hgb = 8,0 g/dl, potas = 2,9 mmol/l. Poziom białka całkowitego w surowicy wynosił 5,2 g/dl, dlatego, z uwagi na wyniszczenie pacjenta, zdecydowano o włączeniu preparatu do żywienia pozajelitowego. Poziom białka C-reaktywnego (CRP) wynosił 62,1 mg/l (n: 0,0-9,0). Ze względu na zmianę opisaną w TK pobrano również próbkę krwi na badanie poziomu CA 19-9: 34,28 IU/ml (n: 0,00-37,00), CEA: 0,9 ng/ml (0-2,5 ng/ml), jednak obie były w granicach normy. Uwzględniając wyniki badań oraz znaczne nasilenie dolegliwości prowadzące do szybkiej utraty masy ciała i postępującego wyniszczenia, pacjenta zakwalifikowano do pilnej kolektomii z wytworzeniem ileostomii końcowej. Ze względu na osłabienie pacjenta, operację wykonano po uprzednim przygotowaniu chorego oraz tygodniowym całkowitym żywieniu pozajelitowym. Przed operacją wartość WBC wynosiła 3,6 tys./mm3, RBC = 3,43 mln/mm3, HGB = 10,6 g/dl, poziom białka całkowitego wzrósł do 5,4 g/dl. Przed operacją pacjentowi przetoczono łącznie 4 j. KKCz.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Ng S, Shi H, Hamidi N et al.: Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. Lancet 2018; 390: 2769-2778.
2. Adams SM, Bornemann PH: Ulcerative colitis. Am Fam Physican 2013; 87(10): 699-705.
3. Wejman J, Bartnik W: Wrzodziejące zapalenie jelita grubego. Atlas kliniczno-patologiczny nieswoistych chorób zapalnych jelit. Termedia, Poznań 2011.
4. Kucharski A: Ocena przydatności skal endoskopowych do określania aktywności choroby u pacjentów z nieswoistymi zapalnymi chorobami jelit. Klinika Gastroenterologii, Żywienia Człowieka i Chorób Wewnętrznych, Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu 2012.
5. Langholz E: Current trends in inflammatory bowel disease: the natural history. Therap Adv Gastroenterol 2010; 3(2): 77-86.
6. Bartnik W: Farmakoterapia colitis ulcerosa w fazie zaostrzenia i remisji – drugi konsensus europejski. Gastroenterol Klin 2013; 5(1): 1-4.
7. Truelove SC, Witts LJ: Cortisone in ulcerative colitis – final report on a therapeutic trial. Br Med J 1955; 2(4947): 1041-1048.
8. Prantera C, Marconi S: Glucocorticosteroids in the treatment of inflammatory bowel disease and approaches to minimizing systemic activity. Therap Adv Gastroenterol 2013; 6(2): 137-156.
9. Lichtiger S: Preliminary report: cyclosporin in treatment of severe active ulcerative colitis. The Lancet 1990; 336: 16-19.
10. Becker JM: Surgical therapy for ulcerative colitis and crohn’s disease. Inflamm Bowel Dis 1999; 28: 371-390.
11. Andersson P, Söderholm JD: Surgery in ulcerative colitis: indication and timing. Dig Dis 2009; 27: 335-340.


