Marta Musińska, Marta Minkiewicz, Justyna Wasielica-Berger, Krystian Kidrycki, Krzysztof Kurek
Klinika Gastroenterologii i Chorób Wewnętrznych, Wydział Lekarski z Oddziałem Stomatologii i Oddziałem Nauczania w Języku Angielskim, Uniwersytet Medyczny w Białymstoku
Rak jelita grubego (ang. colorectal cancer – CRC) jest nowotworem złośliwym, lokalizującym się w obrębie odbytnicy i okrężnicy. Prawie 60% zachorowań na omawiany nowotwór występuje w krajach rozwiniętych. Różnice w częstości występowania między populacjami są ponad 10-krotne: największą częstość występowania notuje się w Australii i Nowej Zelandii oraz Europie Zachodniej, a najniższą w Afryce (za wyjątkiem niektórych krajów Afryki Południowej) i południowo-centralnej Azji (1). Na świecie CRC stanowi trzeci pod względem częstości występowania nowotwór złośliwy (w 2012 roku rozpoznano 1 361 000 przypadków) (2). Natomiast w Europie CRC jest najczęstszym nowotworem złośliwym (stanowi 13,6% wszystkich nowotworów złośliwych) o narastającej częstości występowania (w 2004 roku odnotowano 376 000, a w 2008 roku 463 000 nowych przypadków) (3).
W Polsce (tab. 1) CRC stanowi ok. 12% zachorowań u mężczyzn i ok. 10% zachorowań u kobiet, a każdego roku rozpoznawanych jest ok. 16 000 nowych przypadków (liczba zachorowań w 2007 roku wynosiła 14 244, a w 2011 roku już 16 126). Dane z 2015 roku są jeszcze bardziej pesymistyczne, gdyż zdiagnozowano wówczas 10 271 (12,6%) nowych zachorowań u mężczyzn (co stanowiło wzrost zachorowań w porównaniu do 2000 roku o 70%) oraz 8186 (10,0%) nowych zachorowań u kobiet (co stanowiło wzrost zachorowań w porównaniu do 2000 roku o 37%) (4).
Tab. 1. Zachorowalność na raka jelita grubego w Polsce w latach 1980-2013 (4)
Współczynnik surowy zachorowalności – liczba przypadków zgłaszanych po raz pierwszy w określonym roku kalendarzowym w przeliczeniu na 100 000 mieszkańców; współczynnik standaryzowany zachorowalności – określa, ile zachorowań wystąpiłoby w określonej populacji (w przeliczeniu na 100 000 mieszkańców), gdyby struktura wieku tej populacji była analogiczna jak struktura wieku populacji przyjętej za standard
Obserwowany jest ponadto dynamiczny wzrost zachorowalności na raka jelita grubego, przejawiający się 4-krotnym wzrostem liczby zachorowań u mężczyzn i 3-krotnym wzrostem liczby zachorowań u kobiet w Polsce od 1980 roku. Mimo iż rak jelita grubego może wystąpić w każdym wieku, większość zachorowań (ok. 94%) występuje po 50. r.ż., a ok. 75% przypadków stwierdza się w populacji pacjentów po 60. r.ż. (5-7).
Nowotwory złośliwe jelita grubego są odpowiedzialne na świecie za 374 000 (8%) zgonów mężczyzn i 320 000 (9%) kobiet. W 2012 roku odnotowano 694 000 przypadków zgonów z powodu CRC (2). Z kolei w Polsce (tab. 2) CRC u obu płci jest drugim pod względem umieralności (po raku płuca u mężczyzn i po raku płuca i gruczołu sutkowego u kobiet) z powodu nowotworów złośliwych i powoduje ok. 12% wszystkich zgonów nowotworowych. W 2007 roku odnotowano 9372 przypadki (4231 u mężczyzn i 5141 u kobiet), a w 2011 roku 10 663 (5876 u mężczyzn i 4787 u kobiet) przypadki zgonów z powodu raka jelita grubego. W kolejnych latach odnotowano dynamiczny wzrost śmiertelności z powodu CRC i w 2015 roku stwierdzono 6827 (12,3%) zgonów u mężczyzn (wzrost o 57% w porównaniu do 2000 roku) oraz 5332 (11,8%) zgony kobiet (wzrost o 22% w porównaniu do 2000 roku) (4).
Tab. 2. Umieralność z powodu raka jelita grubego w Polsce w latach 1965-2013 (4)
Współczynnik surowy umieralności – liczba zgonów w określonym roku kalendarzowym w przeliczeniu na 100 000 mieszkańców; współczynnik standaryzowany umieralności – określa, ile zgonów wystąpiłoby w określonej populacji (w przeliczeniu na 100 000 mieszkańców), gdyby struktura wieku tej populacji była analogiczna jak struktura wieku populacji przyjętej za standard
Od 1980 roku liczba zgonów z powodu raka jelita grubego wzrosła 6-krotnie u mężczyzn i 4-krotnie u kobiet (5, 8, 9). Większość zgonów (ponad 80%) z powodu CRC występuje po 60. r.ż. Ryzyko zgonu z powodu CRC wzrasta wraz z wiekiem, począwszy od 6. dekady życia, i najwyższe wartości osiąga po 80. r.ż. Najwięcej zgonów u mężczyzn stwierdza się w 8. dekadzie życia, natomiast u kobiet w 9. dekadzie życia (7).
Rak jelita grubego należy do nowotworów o względnie dużej przeżywalności. Wśród polskich pacjentów z rozpoznaniem CRC jednoroczne wskaźniki przeżyć wynosiły 70,1% u mężczyzn i 68,6% u kobiet (lata 2000-2002). W latach 2003-2005 wskaźniki przeżyć jednorocznych uległy poprawie do 72,4% (wśród mężczyzn) oraz do 70,8% (wśród kobiet). Analizując przeżycia 5-letnie wśród polskich pacjentów z rozpoznaniem CRC w ciągu pierwszej dekady XXI (lata 2000-2002 vs. lata 2003-2005), zaobserwowano nieznaczny wzrost u mężczyzn z 43,3 do 47,6%, natomiast u kobiet z 44,1 do 49,1% (7).
W ciągu nadchodzących 15 lat należy spodziewać się znacznego wzrostu zachorowań na CRC nawet o ok. 40% u mężczyzn i o ok. 20% u kobiet. Przyczynami przedstawionych powyżej prognoz są postępujące starzenie się populacji polskiej oraz obserwowane obecnie trendy zachorowalności. Przewidywana liczba zachorowań na raka jelita grubego w 2025 roku wyniesie ogółem 24 600 (15 500 u mężczyzn i 9100 u kobiet). Największy wzrost zachorowań nastąpi przypuszczalnie u mężczyzn po 65. r.ż., w której to grupie liczba zachorowań zwiększy się nawet do 11 000 (10).
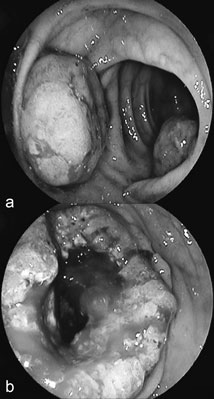
Większość (ok. 85%) przypadków raków jelita grubego stanowią gruczolakoraki (adenocarcinoma), powstające przeważnie z gruczolaków (adenoma) lub rzadziej z polipów ząbkowanych. Morfologicznie mogą przybierać formę polipowatą, zawierającą utkanie histopatologiczne gruczolakoraka (ryc. 1a, b) lub też występować w postaci egzofitycznej, szerzącej się powierzchniowo infiltracji, często zwężającej światło jelita grubego. Proces transformacji gruczolaka, występującego przeważnie w formie niewielkiego polipa utworzonego z komórek nabłonka jelita grubego do raka, trwa zwykle 10-15 lat. W większości polipów ogniska dysplazji powstają na skutek niestabilności chromosomowej i/lub satelitarnej, niemniej jednak w przypadku ok. 15% polipów zachodzą hipermutacje somatyczne (ok. 700), prowadzące do transformacji gruczolaków do gruczolakoraka (11). Przedstawiona powyżej sekwencja patogenetyczna w większości przypadków (ok. 75%) jest procesem sporadycznym, na który nie wpływają uwarunkowania genetyczne. Pozostałe przypadki występują u pacjentów z obciążonym wywiadem rodzinnym w kierunku CRC (ok. 20%) lub wynikają z mutacji pojedynczych genów (ok. 5%).
Ryc. 1a, b. Rak jelita grubego: a) w obrazie kolonoskopowym widoczne dwie struktur polipowate, zawierające utkanie histopatologiczne gruczolakoraka; b) w obrazie kolonoskopowym widoczna egzofityczna infiltracja (w utkaniu histopatologicznym – gruczolakorak), zwężająca światło jelita grubego
Źródło: archiwum Kiniki Gastroenterologii i Chorób Wewnętrznych, UMB
Dotychczas scharakteryzowano liczne czynniki ryzyka warunkujące progresję gruczolaków do CRC, jak również czynniki protekcyjne zmniejszające ryzyko wystąpienia omawianego nowotworu (tab. 3). Spośród tzw. niemodyfikowalnych czynników ryzyka CRC najważniejszą rolę odgrywa wiek. Wyniki badań epidemiologicznych wskazują, że większość CRC występuje u osób po 50. r.ż., natomiast na podstawie badań autopsyjnych stwierdzono znamiennie wyższy odsetek zmian polipowatych w jelicie grubym po 50. r.ż. (12). U kobiet tendencja do zależnego od wieku wzrostu zachorowań na CRC nie jest tak wyraźna jak w przypadku mężczyzn, niemniej jednak płeć żeńska związana jest z większym odsetkiem występowania CRC oraz zmian polipowatych w proksymalnej części jelita grubego (2). Na częstość występowania CRC wpływa ponadto pochodzenie etniczne. Afroamerykanie charakteryzują się wyższą w porównaniu do populacji kaukaskiej częstością zachorowania na CRC, podczas gdy u pacjentów pochodzenia latynoamerykańskiego CRC występuje rzadziej (13). W krajach o niskim statusie socjoekonomicznym odsetek występowania CRC jest niższy niż w krajach rozwiniętych, aczkolwiek śmiertelność z powodu tego nowotworu jest wyższa (2).
Tab. 3. Czynniki ryzyka oraz czynniki protekcyjne CRC (2)
Istotną rolę w patogenezie CRC odgrywają czynniki genetyczne. Krewny pierwszego stopnia (rodzice, rodzeństwo, dzieci) pacjenta, u którego zdiagnozowano CRC poniżej 60. r.ż., ma dwukrotnie wyższe ryzyko rozwoju tego nowotworu, a w przypadku kilku krewnych pierwszego stopnia z CRC ryzyko to jest aż czterokrotnie wyższe niż w populacji ogólnej (14). Ponadto, ok. 5% CRC jest uwarunkowanych genetycznie. W przebiegu rodzinnej polipowatości gruczolakowatej (ang. familial adenomatous polyposis – FAP), uwarunkowanej dziedziczoną autosomalnie dominująco mutacją genu APC oraz dziedzicznego raka jelita grubego niezwiązanego z polipowatością (zespół Lyncha), ryzyko wystąpienia CRC wynosi 100%. Powyższe informacje uzasadniają konieczność intensywniejszego skriningu w kierunku CRC u pacjentów, u których stwierdzono przypadki tego nowotworu w rodzinie w porównaniu do populacji ogólnej (15).
Spośród innych niemodyfikowalnych czynników ryzyka CRC wymieniane są nieswoiste zapalenia jelit (ang. inflammatory bowel disease – IBD), tj. wrzodziejące zapalenie jelita grubego oraz choroba Leśniowskiego-Crohna jelita grubego, które zwiększają ryzyko wystąpienia CRC trzykrotnie, jak również cukrzyca oraz mutacje genu BRCA (16, 17).
Zmienność geograficzna występowania nowotworów jelita grubego oraz wyniki badań prowadzonych na migrantach dowodzą, iż kluczową rolę w etiologii nowotworów jelita grubego odgrywają czynniki związane ze stylem życia.
Opisano ponadto liczne tzw. modyfikowalne czynniki ryzyka CRC. Spośród nich istotną rolę odgrywa dieta zawierająca czerwone mięso oraz przetworzone mięso, z niską zawartością owoców i warzyw (18). W październiku 2015 roku Światowa Organizacja Zdrowia (World Health Organization – WHO) uznała wysoką zawartość mięsa w diecie za czynnik karcinogenny (19). Opublikowano ponadto dane potwierdzające zależność pomiędzy występowaniem CRC a dietą niskobłonnikową (20). Do innych modyfikowalnych czynników ryzyka CRC zaliczane są: otyłość, palenie tytoniu, nadużywanie alkoholu, niewystarczająca aktywność fizyczna oraz niedobór wapnia w diecie (17, 21-23).
Do potencjalnych czynników zapobiegających występowaniu CRC zaliczane są niektóre leki, m.in. kwas acetylosalicylowy (aspiryna). Wykazano, że stosowanie aspiryny w małych dawkach profilaktycznych wiąże się z 20% redukcją wystąpienia CRC i zależnej od nowotworu śmiertelności po 20 latach stosowania, przy czym efekt ten widoczny jest dopiero po 10 latach stosowania leku (24). Niemniej jednak, wytyczne United States Preventive Services Task Force (USPSTF) zalecają stosowanie małych dawek aspiryny w prewencji CRC u pacjentów pomiędzy 50. a 59. r.ż., obciążonych dziesięcioletnim ryzykiem incydentów sercowo-naczyniowych > 10%, z przewidywaną długością życia > 10 lat, z niskim ryzykiem krwawień oraz wyrażających chęć codziennego stosowania aspiryny przez co najmniej 10 lat (25). W profilaktyce CRC oceniono ponadto zastosowanie hormonalnej terapii zastępczej, antyoksydantów, kwasu foliowego oraz witamin z grupy B (B6 i B12), aczkolwiek wyniki badań nie potwierdziły korzyści z ich stosowania w zapobieganiu CRC (2).
1. Center MM, Jemal A, Smith RA, Ward E: Worldwide variations in colorectal cancer. CA Cancer J Clin 2009; 59(6): 366-378.
2. Choi Y, Sateia HF, Peairs KS, Stewart RW: Screening for colorectal cancer. Semin Oncol 2017; 44(1): 34-44.
3. Potemski P: Epidemiologia, badania przesiewowe i klasyfikacja zaawansowania klinicznego raka jelita grubego. Onkol Prak Klin 2010; 6: 283-289.
4. http://onkologia.org.pl/nowotwory-zlosliwe-jelita-grubego-c18-21/.
5. Kubiak A, Kycler W, Trojanowki M: Epidemiologia i profilaktyka raka jelita grubego w Polsce. Probl Hig Epidemiol 2014; 95(3): 636-642.
6. Tuchowska P, Worach-Kardas H, Marcinkowski JT: Najczęstsze nowotwory złośliwe w Polsce – główne czynniki ryzyka i możliwość optymalizacji działań profilaktycznych. Probl Hig Epidemiol 2013; 94(2): 166-171.
7. Krajowy Rejestr Nowotworów: www.onkologia.org.pl.
8. Wojciechowska U, Didkowska J, Zatoński W: Nowotwory złośliwe w Polsce w 2010 r. Centrum Onoklogii – Instytut, Warszawa 2012.
9. Prognoza ludności na lata 2008-2035. GUS, Warszawa 2009.
10. Didkowska J, Wojciechowska U, Zatoński W: Prognozy zachorowalności i umieralności na nowotwory złośliwe w Polsce. Centrum Onkologii – Instytut, Warszawa 2009: 23-27.
11. Strum WB: Colorectal adenomas. N Engl J Med 2016; 374(11): 1065-1075.
12. Pendergrass CJ, Edelstein DL, Hylind LM et al.: Occurrence of colorectal adenomas in younger adults: an epidemiologic necropsy study. Clin Gastroenterol Hepatol 2008; 6(9): 1011-1015.
13. Lieberman DA, Williams JL, Holub JL et al.: Race, ethnicity, and sex affect risk for polyps > 9 mm in average-risk individuals. Gastroenterology 2014; 147(2): 351-358; quiz e14-15.
14. Lowery JT, Ahnen DJ, Schroy PC 3rd et al.: Understanding the contribution of family history to colorectal cancer risk and its clinical implications: A state-of-the-science review. Cancer 2016; 122(17): 2633-2645.
15. Syngal S, Brand RE, Church JM et al.; American College of Gastroenterology: ACG clinical guideline: Genetic testing and management of hereditary gastrointestinal cancer syndromes. Am J Gastroenterol 2015; 110(2): 223-262; quiz 263.
16. Sengupta N, Yee E, Feuerstein JD: Colorectal cancer screening in inflammatory bowel disease. Dig Dis Sci 2016; 61(4): 980-989.
17. Johnson CM, Wei C, Ensor JE et al.: Meta-analyses of colorectal cancer risk factors. Cancer Causes Control 2013; 24(6): 1207-1222.
18. Norat T, Aune D, Chan D, Romaguera D: Fruits and vegetables: updating the epidemiologic evidence for the WCRF/AICR lifestyle recommendations for cancer prevention. Cancer Treat Res 2014; 159: 35-50.
19. Bouvard V, Loomis D, Guyton KZ et al.; International Agency for Research on Cancer Monograph Working Group: Carcinogenicity of consumption of red and processed meat. Lancet Oncol 2015; 16(16): 1599-1600.
20. Aune D, Chan DS, Lau R et al.: Dietary fibre, whole grains, and risk of colorectal cancer: systematic review and dose-response meta-analysis of prospective studies. BMJ 2011; 343: d6617.
21. Chan AT, Giovannucci EL: Primary prevention of colorectal cancer. Gastroenterology 2010; 138(6): 2029-2043.e10.
22. Calle EE, Rodriguez C, Walker-Thurmond K, Thun MJ: Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med 2003; 348(17): 1625-1638.
23. Cho E, Smith-Warner SA, Ritz J et al.: Alcohol intake and colorectal cancer: a pooled analysis of 8 cohort studies. Ann Intern Med 2004; 140(8): 603-613.
24. Dehmer SP, Maciosek MV, Flottemesch TJ et al.: Aspirin for the Primary Prevention of Cardiovascular Disease and Colorectal Cancer: A Decision Analysis for the U.S. Preventive Services Task Force. Ann Intern Med 2016; 164(12): 777-786.
25. Bibbins-Domingo K; U.S. Preventive Services Task Force: Aspirin Use for the Primary Prevention of Cardiovascular Disease and Colorectal Cancer: U.S. Preventive Services Task Force Recommendation Statement. Ann Intern Med 2016; 164(12): 836-845.
26. Wilson JM, Jungner YG: Principles and practice of mass screening for disease. Bol Oficina Sanit Panam 1968; 65(4): 281-393.
27. Regula J, Rupinski M, Kraszewska E et al.: Colonoscopy in colorectal-cancer screening for detection of advanced neoplasia. N Engl J Med 2006; 355(18): 1863-1872.
28. Zauber AG, Winawer SJ, O’Brien MJ et al.: Colonoscopic polypectomy and long-term prevention of colorectal-cancer deaths. N Engl J Med 2012; 366(8): 687-696.
29. Welch HG, Robertson DJ: Colorectal Cancer on the Decline – Why Screening Can’t Explain It All. N Engl J Med 2016; 374(17): 1605-1607.
30. Church TR, Wandell M, Lofton-Day C et al.; PRESEPT Clinical Study Steering Committee, Investigators and Study Team: Prospective evaluation of methylated SEPT9 in plasma for detection of asymptomatic colorectal cancer. Gut 2014; 63(2): 317-325.
31. Lin JS, Piper MA, Perdue LA et al.: Screening for Colorectal Cancer: A Systematic Review for the U.S. Preventive Services Task Force (Internet). Rockville (MD): Agency for Healthcare Research and Quality (US) 2016. Report No.: 14-05203-EF-1.
32. Leontiadis GI: Fecal Immunochemical Tests in Patients at Increased Risk for Colorectal Cancer-Is It Prime Time Yet? JAMA Intern Med 2017; 177(8): 1119-1120.
33. Ostrow JD: Tests for fecal occult blood. [In:] Walker HK, Hall WD, Hurst JW (eds.): Clinical Methods: The History, Physical, and Laboratory Examinations. 3rd edition. Butterworths, Boston 1990: Chapter 98.
34. US Preventive Services Task Force; Bibbins-Domingo K, Grossman DC, Curry SJ et al.: Screening for Colorectal Cancer: US Preventive Services Task Force Recommendation Statement. JAMA 2016; 315(23): 2564-2575.
35. Tinmouth J, Lansdorp-Vogelaar I, Allison JE: Faecal immunochemical tests versus guaiac faecal occult blood tests: what clinicians and colorectal cancer screening programme organisers need to know. Gut 2015; 64(8): 1327-1337.
36. Benton SC, Seaman HE, Halloran SP: Faecal occult blood testing for colorectal cancer screening: the past or the future. Curr Gastroenterol Rep 2015; 17(2): 428.
37. Faivre J, Dancourt V, Lejeune C: Screening for colorectal cancer with immunochemical faecal occult blood tests. Dig Liver Dis 2012; 44(12): 967-973.
38. Huddy JR, Ni MZ, Markar SR, Hanna GB: Point-of-care testing in the diagnosis of gastrointestinal cancers: current technology and future directions. World J Gastroenterol 2015; 21(14): 4111-4120.
39. Rockey DC, Auslander A, Greenberg PD: Detection of upper gastrointestinal blood with fecal occult blood tests. Am J Gastroenterol 1999; 94(2): 344-350.
40. Brenner H, Tao S: Superior diagnostic performance of faecal immunochemical tests for haemoglobin in a head-to-head comparison with guaiac based faecal occult blood test among 2235 participants of screening colonoscopy. Eur J Cancer 2013; 49(14): 3049-3054.
41. Imperiale TF: Quantitative immunochemical fecal occult blood tests: is it time to go back to the future? Ann Intern Med 2007; 146(4): 309-311.
42. Hundt S, Haug U, Brenner H: Comparative evaluation of immunochemical fecal occult blood tests for colorectal adenoma detection. Ann Intern Med 2009; 150(3): 162-169.
43. Cruz-Correa M, Schultz K, Jagannath S et al.: Performance characteristics and comparison of two fecal occult blood tests in patients undergoing colonoscopy. Dig Dis Sci 2007; 52(4): 1009-1013.
44. Houshmand M, Abbaszadegan MR, Kerachian MA: Assessment of Bone Morphogenetic Protein 3 Methylation in Iranian Patients with Colorectal Cancer. Middle East J Dig Dis 2017; 9(3): 158-163.
45. Frossard JL, de Peyer R: Fecal DNA for colorectal-cancer screening. N Engl J Med 2005; 352(13): 1384-1385; author reply 1384-1385.
46. Lucas AL, Hwang C, Frucht H: Strengthening the case for stool DNA tests as first-line colorectal cancer screening: are we there yet? Clin Gastroenterol Hepatol 2012; 10(3): 214-215.
47. Imperiale TF, Ransohoff DF, Itzkowitz SH et al.: Multitarget stool DNA testing for colorectal-cancer screening. N Engl J Med 2014; 370(14): 1287-1297.
48. Charchut A, Wójcik M, Kościelniak BK, Tomasik PJ: Testy na krew utajoną w stolcu w samokontroli i w badaniach w miejscu opieki. Diagn Lab 2017; 53(2): 101-106.
49. Winawer SJ, Stewart ET, Zauber AG et al.: A comparison of colonoscopy and double-contrast barium enema for surveillance after polypectomy. National Polyp Study Work Group. N Engl J Med 2000; 342(24): 1766-1772.
50. Rockey DC, Paulson E, Niedzwiecki D et al.: Analysis of air contrast barium enema, computed tomographic colonography, and colonoscopy: prospective comparison. Lancet 2005; 365(9456): 305-311.
51. Pickhardt PJ, Choi JR, Hwang I et al.: Computed tomographic virtual colonoscopy to screen for colorectal neoplasia in asymptomatic adults. N Engl J Med 2003; 349(23): 2191-2200.
52. Johnson CD, Chen MH, Toledano AY et al.: Accuracy of CT colonography for detection of large adenomas and cancers. N Engl J Med 2008; 359(12): 1207-1217.
53. Bacchus CM, Dunfield L, Gorber SC et al.; Canadian Task Force on Preventive Health Care: Recommendations on screening for colorectal cancer in primary care. CMAJ 2016; 188(5): 340-348.
54. Atkin WS, Edwards R, Kralj-Hans I et al.; UK Flexible Sigmoidoscopy Trial Investigators: Once-only flexible sigmoidoscopy screening in prevention of colorectal cancer: a multicentre randomised controlled trial. Lancet 2010; 375(9726): 1624-1633.
55. Holme Ø, Løberg M, Kalager M et al.: Effect of flexible sigmoidoscopy screening on colorectal cancer incidence and mortality: a randomized clinical trial. JAMA 2014; 312(6): 606-615.
56. Segnan N, Armaroli P, Bonelli L et al.; SCORE Working Group: Once-only sigmoidoscopy in colorectal cancer screening: follow-up findings of the Italian Randomized Controlled Trial-SCORE. J Natl Cancer Inst 2011; 103(17): 1310-1322.
57. Schoen RE, Pinsky PF, Weissfeld JL et al.; PLCO Project Team: Colorectal-cancer incidence and mortality with screening flexible sigmoidoscopy. N Engl J Med 2012; 366(25): 2345-2357.
58. Winawer SJ, Zauber AG, Ho MN et al.: Prevention of colorectal cancer by colonoscopic polypectomy. The National Polyp Study Workgroup. N Engl J Med 1993; 329(27): 1977-1981.
59. Nishihara R, Wu K, Lochhead P et al.: Long-term colorectal-cancer incidence and mortality after lower endoscopy. N Engl J Med 2013; 369(12): 1095-1105.
60. Baxter NN, Goldwasser MA, Paszat LF et al.: Association of colonoscopy and death from colorectal cancer. Ann Intern Med 2009; 150(1): 1-8.
61. Müller AD, Sonnenberg A: Prevention of colorectal cancer by flexible endoscopy and polypectomy. A case-control study of 32,702 veterans. Ann Intern Med 1995; 123(12): 904-910.
62. Singh H, Turner D, Xue L et al.: Risk of developing colorectal cancer following a negative colonoscopy examination: evidence for a 10-year interval between colonoscopies. JAMA 2006; 295(20): 2366-2373.
63. Brenner H, Chang-Claude J, Seiler CM et al.: Protection from colorectal cancer after colo-noscopy: a population-based, case-control study. Ann Intern Med 2011; 154(1): 22-30.
64. Quintero E, Castells A, Bujanda L et al.; COLONPREV Study Investigators: Colonoscopy versus fecal immunochemical testing in colorectal-cancer screening. N Engl J Med 2012; 366(8): 697-706.
65. Rex DK, Cummings OW, Helper DJ et al.: 5-year incidence of adenomas after negative colonoscopy in asymptomatic average-risk persons (see comment). Gastroenterology 1996; 111(5): 1178-1181.
66. Imperiale TF, Glowinski EA, Lin-Cooper C et al.: Five-year risk of colorectal neoplasia after negative screening colonoscopy. N Engl J Med 2008; 359(12): 1218-1224.
67. Lieberman DA, Weiss DG, Harford WV et al.: Five-year colon surveillance after screening colonoscopy. Gastroenterology 2007; 133(4): 1077-1085.
68. Brenner H, Chang-Claude J, Seiler CM et al.: Does a negative screening colonoscopy ever need to be repeated? Gut 2006; 55(8): 1145-1150.
69. Ko CW, Riffle S, Michaels L et al.: Serious complications within 30 days of screening and surveillance colonoscopy are uncommon. Clin Gastroenterol Hepatol 2010; 8(2): 166-173.
70. Warren JL, Klabunde CN, Mariotto AB et al.: Adverse events after outpatient colonoscopy in the Medicare population. Ann Intern Med 2009; 150(12): 849-857, W152.
71. Kaminski MF, Regula J, Kraszewska E et al.: Quality indicators for colonoscopy and the risk of interval cancer. N Engl J Med 2010; 362(19): 1795-1803.
72. Shaukat A, Rector TS, Church TR et al.: Longer Withdrawal Time Is Associated With a Reduced Incidence of Interval Cancer After Screening Colonoscopy. Gastroenterology 2015; 149(4): 952-957.
73. Rex DK, Johnson DA, Anderson JC et al.; American College of Gastroenterology: American College of Gastroenterology guidelines for colorectal cancer screening 2009. Am J Gastroenterol 2009; 104(3): 739-750.
74. Knudsen AB, Zauber AG, Rutter CM et al.: Estimation of Benefits, Burden, and Harms of Colorectal Cancer Screening Strategies: Modeling Study for the US Preventive Services Task Force. JAMA 2016; 315(23): 2595-2609.
75. Mittal S, Lin YL, Tan A et al.: Limited life expectancy among a subgroup of medicare beneficiaries receiving screening colonoscopies. Clin Gastroenterol Hepatol 2014; 12(3): 443-450.e1.
76. Gelband H, Jha P, Sankaranarayanan R: Cancer. 3rd ed. International Bank for Reconstruction and Development, The World Bank, Washington, DC 2015.
77. Sabatino SA, White MC, Thompson TD, Klabunde CN; Centers for Disease Control and Prevention (CDC): Cancer screening test use – United States, 2013. MMWR Morb Mortal Wkly Rep 2015; 64(17): 464-468.
78. Lynge E, Törnberg S, von Karsa L et al.: Determinants of successful implementation of population-based cancer screening programmes. Eur J Cancer 2012; 48(5): 743-748.
79. Narodowy Program Zwalczania Chorób Nowotworowych 2006-2015. Warszawa 2008.
80. Tomczak M: 10 sekund i raka jelita grubego nie ma! (debata ekspertów). Gazeta Lekarska 1 grudnia 2017.
81. Program Badań Przesiewowych wczesnego wykrywania raka jelita grubego: http://www.pbp.org.pl.
82. Kozierkiewicz A, Bochenek T, Gilewski D et al.: Biała księga zwalczania raka jelita grubego i raka piersi na tle wybranych krajów europejskich. Ośrodek Analiz Uniwersyteckich, Warszawa-Kraków 2011.
83. Janiak M, Głowacka P, Kopeć A, Staśkiewicz A: Czynniki determinujące zgłaszalność na badania kolonoskopowe w Programie Badań Przesiewowych raka jelita grubego w Polsce. Gastroenterologia Kliniczna 2016; 8(4): 142-151.