Katarzyna Odzimkowska-Łata1, Aleksandra Rybkowska2, Edyta Olesińska2
Młodzieńczy toczeń rumieniowaty układowy – opis przypadku
Juvenile systemic lupus erythematosus – case report
1Oddział Dziecięcy z Izbą Przyjęć, Wojewódzki Szpital Specjalistyczny im. Stefana Kardynała Wyszyńskiego w Lublinie
2Oddział Pediatrii, Chorób Płuc i Reumatologii Dziecięcej, Uniwersytecki Szpital Dziecięcy w Lublinie
Summary
Juvenile systemic lupus erythematosus is an autoimmune, chronic, multisystemic inflammatory disease with an unknown etiology.
The average age of juvenile systemic lupus erythematosus (jSLE) diagnosis is 11-14 years old, with a significant female predominance. Clinical manifestations of JSLE are extremely variable, from a relatively mild disease characterised by facial rash, joint pains, fever, fatigue, weight loss, alopecia and arthralgias to a severe life threatening illness.These and other symptoms of diffuse generalized inflammation including lymphadenopathy and hepatosplenomegaly occur both at onset and during disease flares.The authors present the case of a girl hospitalized in the Rheumatology Clinic due to fevers, skin lesions and haematological disorders. The diagnostic difficulty may have been the fact that the symptoms appear also in the course of many pediatric diseases. Finally, based on an in-depth medical history, physical examination and the results of immunological tests, they were recognized at the outset. Juvenile systemic lupus erythematosus is a disease with a diverse clinical picture, therefore, early diagnosis is not easy, but it is necessary to implement effective treatment. Knowledge and experience of the spectrum of paediatric and adolescent disease is important as well as recognition of when features merit further investigation.

Wstęp
Młodzieńczy toczeń rumieniowaty układowy (MTRU) jest jedną z układowych chorób tkanki łącznej występujących u dzieci. To przewlekła choroba zapalna na tle autoimmunizacyjnym, w przebiegu której dochodzi do uszkodzenia wielu narządów na skutek wiązania się z endogennymi antygenami tkankowymi autoprzeciwciał (m.in. przeciwciała przeciwjądrowe, anty-dsDNA) i odkładania kompleksów immunologicznych. Odsetek dzieci z początkiem tego schorzenia przed 16. rokiem życia to ok. 20% wszystkich chorych z toczniem rumieniowatym układowym. Choroba występuje z częstością ok. 6-30/10 000 dzieci rocznie, zależną od grupy etnicznej. Częściej występuje u płci żeńskiej, ale przewaga ta jest mniejsza niż u dorosłych (5:1 vs 9:1). Średni wiek rozpoznania MTRU to 11.-14. rok życia, rzadko objawy choroby pojawiają się przed 10. r.ż. i bardzo rzadko przed 5. r.ż. (formy monogenowe choroby) (1-3).
W porównaniu do populacji dorosłych MTRU często charakteryzuje się nagłym początkiem oraz cięższym przebiegiem klinicznym z zajęciem nerek, układu nerwowego, występowaniem zaburzeń hematologicznych czy krwawienia do pęcherzyków płucnych. Wskaźnik śmiertelności u dzieci z MTRU jest znacznie wyższy niż u dorosłych (14,3 vs 3,6) (2, 4, 5).
Etiopatogeneza tocznia nie jest do końca wyjaśniona. U osób predysponowanych genetycznie (geny HLA DR i DQ oraz C’2 i C’4) pod wpływem różnych czynników zewnętrznych (np. promienie UV, infekcje, leki, dieta bogatotłuszczowa) lub wewnętrznych (np. hormonalnych – względny niedobór androgenów przy podwyższonych poziomach estrogenów i prolaktyny) dochodzi do nadmiernej odpowiedzi immunologicznej ze strony układu odpornościowego (autoreaktywność limfocytów T i B). Czynniki zakaźne mogą inicjować wytwarzanie autoprzeciwciał w mechanizmie mimikry antygenowej (podobieństwo do antygenów człowieka). W patogenezie choroby wskazuje się również na udział żeńskich hormonów płciowych – estrogenów, w pobudzaniu komórek zapalnych do produkcji cytokin (6).
Celem pracy jest przedstawienie różnorodności objawów MTRU na podstawie przebiegu choroby u kilkunastoletniej pacjentki.
Opis przypadku
Dotychczas zdrowa, 13,5-letnia dziewczynka została przyjęta do szpitala z powodu codziennych stanów gorączkowych do 39°C, utrzymujących się od ponad tygodnia oraz stwierdzanych w badaniach laboratoryjnych: głębokiej leukoneutropenii oraz niedokrwistości. Około 3 tygodnie przed gorączką wystąpiły zmiany skórne w postaci rumienia nasady nosa, policzków, bródki, szyi i dekoltu, które uznano za wysypkę posłoneczną; zasinienie skóry dystalnych części kończyn górnych i dolnych; uogólnione przerzedzenie/wypadanie włosów. Ponadto od kilku miesięcy pacjentka czuła się zmęczona, często po szkole spała kilka godzin, osłabiona, niechętnie uczestniczyła w życiu towarzyskim. Mama opisywała u córki trudności z pamięcią i pogorszenie wyników w nauce. Nie miesiączkowała. W wywiadzie rodzinnym bez istotnych chorób przewlekłych.
Przy przyjęciu do szpitala pacjentka była w stanie ogólnym średnio ciężkim, apatyczna, osłabiona, odpowiadająca lakonicznie na zadawane pytania. W badaniu fizykalnym stwierdzono: rumień w kształcie „motyla” na skórze twarzy z towarzyszącym złuszczaniem (ryc. 1), rumień szyi, małżowin usznych, powiek górnych, obrzęk twarzy oraz nadżerki błon śluzowych wargi dolnej (ryc. 2) i podniebienia twardego (ryc. 3). Dodatkowo występowały: obrzęki stóp, dłoni, siność siateczkowata skóry kończyn górnych i dolnych, zmiany naczyniowe okołopaznokciowe II palca stopy prawej (ryc. 4), rumień dłoniowy oraz liczne powiększone węzły chłonne szyjne, pachowe lewe, pachwinowe. W badaniu przedmiotowym zwracała uwagę powiększona wątroba ok. 3 cm poniżej łuku żebrowego w linii środkowo-obojczykowej prawej, poniżej 2 cm w linii przymostkowej prawej oraz śledziona macalna poniżej łuku żebrowego 3,5 cm w linii środkowo-obojczykowej lewej. Osłuchowo akcja serca miarowa, tachykardia 160/min, szmer wzdłuż lewego brzegu mostka 3/6 według skali Levine’a, nad polami płucnymi ściszenie szmeru pęcherzykowego po stronie prawej w okolicy pachowej środkowej. W badaniu układu kostno-stawowego nie stwierdzono cech zapalenia stawów. W badaniu neurologicznym: łagodne zaburzenia poznawcze, bez cech zespołu neurologicznego.
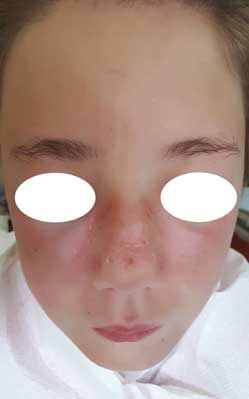
Ryc. 1. Rumień w kształcie motyla z towarzyszącym złuszczaniem
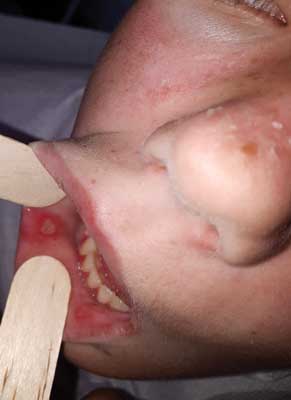
Ryc. 2. Nadżerka błony śluzowej wargi dolnej

Ryc. 3. Nadżerki błony śluzowej podniebienia twardego

Ryc. 4. Livedo reticularis i zmiany naczyniowe okołopaznokciowe
W wykonanych badaniach dodatkowych stwierdzono: leukopenię 1,55 tys./ul z neutropenią 1,04 tys./ul i limfopenią 0,35 tys./ul, niedokrwistość z Hb 6,9 g/dl, Hct – 20,6%, MCV – 87 fl, retikulocyty – w normie, liczba płytek – 160 tys./ul, w rozmazie mikroskopowym: granulocyty pałeczkowate 6%, granulocyty segmentowate 70%, granulocyty kwasochłonne 1%, limfocyty 20%, monocyty 3%. W badaniach biochemicznych: podwyższone OB 30 mm/h, prawidłowe wskaźniki CRP – 0,5 mg/dl (N < 0,5) i prokalcytonina bez wskaźników hemolizy, hipoalbuminemia 2,8 g/dl, podwyższona aktywność AST – 53 U/l, LDH – 1152 U/l, hiperferrytynemia – 1080 mg/dl, hipertriglicerydemia – 231 mg/dl, pozostałe wskaźniki funkcji wątroby, hormony tarczycy, enzymy: CK, CK-MB, troponina oraz elektrolity pozostawały w normie. Stwierdzono zaburzenia układu hemostazy: wydłużony APTT – 39,5 s, podwyższone D-dimery – 1926 ng/ml, hipofibrynogenemia – 1,92 g/l, wydłużony czas trombinowy – TT 22,1 s.
W badaniu ogólnym moczu: ketony 1+, urobilinogen 4+, leukocyty 5-10 wpw, białko 83,4 mg/dl. Wykonano dobową zbiórkę moczu, w której oceniono całkowitą ilość białka na 762,85 mg. Kał na obecność krwi utajonej – negatywny.
W wykonanych badaniach obrazowych: RTG klatki piersiowej – miąższ płucny bez zmian naciekowych, sylwetka serca niepowiększona. W USG jam opłucnowych – niewielka ilość płynu w obu jamach opłucnowych: w pozycji leżącej, grzbietowo do 15 mm grubości, w pozycji siedzącej płyn pod powierzchnią przeponową płuc do 13 mm obustronnie. W USG jamy brzusznej – wątroba znacznie powiększona o wymiarach w linii pachowej przedniej 191 mm, śledziona jednorodna o wymiarach 189 x 51 mm – znacznie powiększona, stykająca się z lewym płatem wątroby, płyn zapęcherzowo o wymiarach 64 x 24 mm, płyn w jamie otrzewnowej, w jamie Douglasa ok. 50 ml, ślad płynu międzypętlowo.
W EKG: rytm zatokowy, miarowy o częstości 80/min, normogram, długość zespołów i odcinków prawidłowa, płaskie załamki T w odprowadzeniach III, aVL.
W ECHO serca: fizjologiczna niedomykalność zastawki trójdzielnej, śladowa niedomykalność zastawki płucnej oraz aortalnej, wymiary i funkcję serca oceniono jako prawidłową. Obecny płyn w worku osierdziowym, za RV w rozkurczu przy koniuszku 0,47 cm, maks. 0,52 cm, za RA maks. 1,55 cm.
Analiza wywiadu, badania przedmiotowego i wstępne wyniki badań były podstawą do przeprowadzenia wieloetapowej szerokiej diagnostyki różnicowej (tab. 1).
Tab. 1. Diagnostyka różnicowa MTRU
| Choroby infekcyjne | |
| – bakteryjne | infekcje paciorkowcowe, salmonelloza, bruceloza, gruźlica, chlamydioza, borelioza |
| – wirusowe | wirus Epsteina-Barr (EB), cytomegalowirus, parwowirus B19, HIV, HHV-6 |
| Choroby hematologiczne i onkologiczne | choroby rozrostowe układu krwiotwórczego (białaczki, chłoniaki), immunologiczna małopłytkowość, niedokrwistość autoimmunohemolityczna, neuroblastoma, choroba Castlemana, histiocytoza, zespół hemofagocytarny (HLH) |
| Choroby reumatologiczne | choroba Kawasaki, choroba Takayasu, ziarniniak Wegenera, młodzieńcze zapalenie skórno-mięśniowe (JDM), mieszana choroba tkanki łącznej (MCTD), zespół Sjögrena (SS), choroba Behçeta (BD) |
| Choroby autoimmunologiczne | rodzinna gorączka śródziemnomorska, niedobór kinazy mewalonianowej, zespół nawracających gorączek związany z TNF-receptorem (TRAPS), okresowe zespoły zależne od kriopiryny (CAPS), zespół Blaua/wczesny początek sarkoidozy |
| Choroby zapalne jelit (IBD) | choroba Crohna, wrzodziejące zapalenie jelita grubego |
| Gorączka polekowa | leki najczęściej powodujące gorączkę: penicylina, sulfonamidy, wankomycyna, amfoterycyna B, salicylany, bleomycyna, interferony, chinidyna, prokainamid, barbiturany, fenytoina, metyldopa |
Wykonano diagnostykę mikrobiologiczną i serologiczną w kierunku patogenów infekcyjnych. Pobrane dwukrotnie w odstępach czasowych posiewy krwi tlenowe i beztlenowe pozostały jałowe. Wyniki badań serologicznych w kierunku wirusów i bakterii: EBV IgM (-), IgG (+), CMV (-), HBsAg (-), anty-HCV (-), Parwowirus B19 (-), HSV IgG (+) i IgM (+), B. pertusis IgA (+), IgM (-), IgG (+), M. pneumoniae IgM (+), M. tuberculosis testem Quantiferon (-), Legionella (-), Chlamydia pneumoniae (-).
Wykonano badania immunologiczne, które ujawniły: dodatni bezpośredni test antyglobulinowy (BTA), obecność autoprzeciwciał klasy IgG, IgM oraz składowej C3 dopełniacza na krwinkach czerwonych oraz w surowicy wolne autoprzeciwciała klasy IgG i autoprzeciwciała typu zimnego, aktywne w temperaturze 20°C. Poza tym stwierdzono obecność przeciwciał przeciwjądrowych 1:5120 o typie świecenia homogennym/ziarnistym, przeciwciał anty-dsDNA w mianie 1:640 oraz anty-SM, przeciwhistonowych, przeciw nukleosomom, RNP/Sm, rybonukleinie P, jak również obecność przeciwciał antykardiolipinowych w klasie IgG i IgM, p/β2-glikoproteinie w klasie IgM, śladowy antykoagulant tocznia (LAC), a-TPO oraz przeciwciał przeciwgranulocytarnych – MAIGA, GIFT. Czynnik reumatoidalny był nieobecny, stwierdzano wysokie poziomy immunoglobuliny IgG – 2286 mg/dl, IgM – 420 mg/dl oraz IgE – 588,3 IU/ml i bardzo niską aktywność składowych dopełniacza: C3 – 19 mg/dl, C4 – 2,0 mg/dl.
Wykonano biopsję aspiracyjną szpiku kostnego. W mielogramie: erytropoeza żywa, normoblastyczna, z zachowanym torem dojrzewania erytroblastów, układ ziarnistokomórkowy reprezentowany przez wszystkich przedstawicieli z zaznaczonym przesunięciem w prawo do szczebla granulocyta podzielonego, układ limforetikularny bez uchwytnych zmian jakościowych i ilościowych, obecne nieliczne megakariocyty niepłytkotwórcze.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Rodsaward P, Prueksrisakul T, Deekajorndech T et al.: Oral ulcers in juvenile-onset systemic lupus erythematosus – review of the literature. Am J Clin Dermatol 2017; 18(6): 755-762.
2. Malattia C, Martini A: Paediatric-onset systemic lupus erythematosus. Best Pract Res Cl Rh 2013; 27(3): 351-362.
3. Levy D, Kamphuis S: Systemic Lupus Erythematosus in Children and Adolescents. Pediatr Clin North Am 2012; 59(2): 345-364.
4. Aggarwal A, Phatak S, Srivastava P et al.: Outcomes in juvenile onset lupus: single center cohort from a developing country. Lupus 2018; 27(3): 1-9.
5. Chen Sarah K, Costenbader Karen H: Prognosis and mortality of SLE. [In:] Wallace DJ, Hahn BH: Dubois’ lupus erythematosus and related syndromes. 9th ed. Elsevier, 2019: 770-781.
6. Mazur-Zielińska H: Młodzieńczy toczeń rumieniowaty układowy. Pediatr Dypl 2012; 16(2): 18-22.
7. Petri M, Orbai AM, Alarcón GS et al.: Derivation and validation of the Systemic Lupus International Collaborating Clinics classification criteria for systemic lupus erythematosus. Arthritis Rheum 2012; 64: 2677-2686.
8. Descloux E, Durieu I, Cochat P et al.: Influence of age at disease onset in the outcome of paediatric systemic lupus erythematosus. Rheumatology (Oxford) 2009; 48: 779-784.
9. Uziel Y, Gorodnitski N, Mukamel M et al.: Outcome of a national Israeli cohort of pediatric systemic lupus erythematosus. Lupus 2007; 16: 142-146.
10. Salah S, Lotfy HM, Sabry SM et al.: Systemic lupus erythematosus in Egyptian children. Rheumatol Int 2009; 29: 1463-1468.
11. Hiraki LT, Benseler SM, Tyrrell PN et al.: Clinical and laboratory characteristics and long-term outcome of pediatric systemic lupus erythematosus: a longitudinal study. J Pediatr 2008; 152: 550-556.
12. Ramirez Gomez LA, Uribe Uribe O, Osio Uribe O et al.: Childhood systemic lupus erythematosus in Latin America. The GLADEL experience in 230 children. Lupus 2008; 17: 596-604.
13. Tuszkiewicz-Misztal E, Smolewska E, Postępski J, Olesińska E: Reumatologia wieku rozwojowego. [W:] Zimmermann-Górska I (red.): Postępy w reumatologii klinicznej. Wyd. 1. PZWL, Warszawa 2014: 81-87.
14. Grim A, Komosińska-Vassev K, Olczyk P: Rodzaje autoprzeciwciał w chorobach reumatycznych i metody ich oznaczeń. Diagn Lab 2015; 51(3): 235-250.




