Iwona Wawer1, *Katarzyna Paradowska2
Luteina i astaksantyna jako dietetyczne wsparcie terapii
Lutein and astaxanthin as dietary support of therapy
1Karpacka Państwowa Uczelnia w Krośnie
2Katedra Farmacji Fizycznej i Bioanalizy, Zakład Chemii Fizycznej, Wydział Farmaceutyczny, Warszawski Uniwersytet Medyczny
Kierownik Katedry: prof. dr hab. n. farm. Piotr Wroczyński
Streszczenie
Luteina i astaksantyna należą do karotenoidów szeroko stosowanych w przemyśle spożywczym i farmaceutycznym. Totalna synteza chemiczna luteiny i astaksantyny daje mieszaninę stereoizomerów. Oba karotenoidy są ekstrahowane z materiału roślinnego w postaci mieszaniny mono- i diestrów. Luteina jest ekstrahowana z kwiatów aksamitka lub nagietka. Suplementacja luteiny powoduje wzrost jej stężenia w surowicy krwi i plamce żółtej oka. Coraz więcej dowodów potwierdza rolę luteiny w prewencji zwyrodnienia plamki żółtej (AMD), może poprawiać zdrowie oczu. Astaksantynę otrzymuje się z alg Haematococcus pluvialis. Dzięki silnym właściwościom antyoksydacyjnym, przeciwzapalnym oraz immunomodulującym może mieć zastosowanie do wspomagania leczenia chorób neurodegeneracyjnych, układu krążenia, cukrzycy, chorób oczu, a także do suplementacji diety pacjentów z COVID-19.
Summary
Lutein and astaxanthin belong to carotenoids which have wide applications in food, nutraceutical and pharmaceutical industries. The total chemical syntheses of lutein and astaxanthin produces a mixture of stereoisomers. Both carotenoids are extracted from the plant material as the mixture of mono- and diesters. Lutein is extracted from marigold and tagetes flowers. Lutein supplementation increases its concentration in blood serum and in the macula of the eye. There is increasing evidence that lutein is important in the prevention of age-related macular degeneration (AMD) and may improve eye health. Astaxanthin is extracted from the Haematococcus pluvialis algae. Due to its strong antioxidant, anti-inflammatory, and immunomodulatory properties, they can be used to support the treatment of neurodegenerative and cardiovascular diseases, diabetes, eye diseases, and to supplement the diet of COVID-19 patients.

Wprowadzenie
Luteina i astaksantyna to nierozpuszczalne w wodzie barwniki karotenoidowe (zaliczane też do ksantofili). Karotenoidy absorbują promieniowanie UV i światło widzialne, zwłaszcza w zakresie niebieskim (400-500 nm), a ich intensywny czerwony kolor wynika z obecności układu sprzężonych podwójnych wiązań. Luteinę od β-karotenu odróżnia obecność dwóch polarnych grup hydroksylowych przy asymetrycznych atomach węgla C3 i C3’. Astaksantyna ma dodatkowo dwie grupy karbonylowe (C4 = O) (ryc. 1a-c).
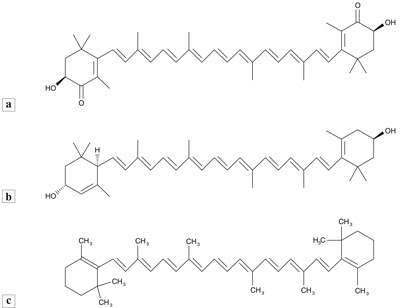
Ryc. 1a-c. Wzór chemiczny a) astaksantyny, b) luteiny, c) β-karotenu
Długi łańcuch i polarne grupy na obu końcach łańcucha umożliwiają unikalne ułożenie astaksantyny w błonie komórkowej, jej cząsteczka jest rozciągnięta przez całą dwuwarstwę lipidową. Może więc zapewniać ochronę przed stresem oksydacyjnym, zmiatając reaktywne formy tlenu (ROS) po obu stronach błony komórkowej (1, 2). Astaksantyna ma silne właściwości wymiatania wolnych rodników, zwłaszcza tlenu singletowego (3). Jako przeciwutleniacz jest kilkadziesiąt razy silniejsza niż witaminy C, E czy β-karoten.
Luteina jest obecna w osoczu, ale największe jej stężenie występuje w plamce żółtej oka. W centralnym miejscu siatkówki jest więcej zeaksantyny i mezoksantyny, ale w dalszych rejonach dominuje luteina (4). Aby zapewnić prawidłową ochronę fotoreceptorów potrzebne są minimum dwa karotenoidy: luteina i zeaksantyna, które muszą być dostarczane z dietą, ponieważ organizm człowieka ich nie wytwarza.
Suplementy diety najczęściej zawierają luteinę i zeaksantynę w dawkach dziennych odpowiednio 10 i 2 mg (5:1).
Rola karotenoidów w zapobieganiu chorobom degeneracyjnym, w tym chorobom neurodegeneracyjnym i chorobom oczu, jest tematem wielu prac badawczych.
Naturalne czy syntetyczne?
Otrzymywanie luteiny
Totalna chemiczna synteza (3R,3’R,6’R) luteiny jest pracochłonna, a pojedyncze stereoizomery otrzymuje się z małą wydajnością. Zastosowanie reakcji stereoselektywnego sprzęgania Wittiga pozwala uzyskać inne stereoizomery luteiny: (3R,3’S,6’S), (3R,3’S,6’R), (3R,3’R,6’S) oraz 3’-epiluteinę (5). Aktualnie najwięcej naturalnej luteiny otrzymuje się przez ekstrakcję kwiatów aksamitki (Tagetes erecta), jednak warto też skorzystać z alternatywnego źródła, którym są algi (6). Luteinę z dobrą wydajnością można otrzymać przez ekstrakcję nadkrytycznym dwutlenkiem węgla z mikroalg Scenedesmus almeriensis (7).
Otrzymywanie astaksantyny
Synteza chemiczna umożliwia produkcję tego związku na większą skalę. Jednak w jej wyniku otrzymuje się mieszaninę stereoizomerów: dwóch izomerów optycznych i formy meso w stosunku 1:2:1 (3R,3’R): (3R,3’S): (3S,3’S). Niektóre z nich mogą wykazywać niekorzystne efekty uboczne po spożyciu, dlatego przemysł farmaceutyczny i spożywczy używa tylko naturalnej all-trans astaksantyny (3S,3’S). Astaksantynę można otrzymać z drożdży Xanthophyllomyces dendrorhous (głównie izomer 3R,3R’), ale najwięcej produkuje się jej z alg Haematococcus pluvialis (8).
Algi syntetyzują i akumulują astaksantynę w warunkach stresowych, takich jak duże zasolenie wód lub intensywne promieniowanie słoneczne (warunki istniejące np. na Hawajach). Zielone algi żyjące w ciepłych słonych wodach stają się czerwone pod wpływem ww. czynników stresowych, a dodatkowo zmienia się skład karotenoidów, bowiem β-karoten ulega transformacji do astaksantyny. Potwierdzono to, używając konfokalnej mikroskopii ramanowskiej. Zarejestrowano widma Ramana astaksantyny, β-karotenu i chlorofilu, które pokazały, że β-karoten jest prekursorem astaksantyny, a jej synteza odbywa się poza chloroplastami (9).
Do ekstrakcji czerwonych alg H. pluvialis używa się 50% etanolu w octanie etylu, a wydajność wzrasta po podgrzaniu do 40°C. W wyższej temperaturze następuje degradacja astaksantyny. Do otrzymania astaksantyny można użyć ekstrakcji wspomaganej ultradźwiękami, prowadząc ją w temperaturze 41°C. Dobrym sposobem otrzymywania astaksantyny jest ekstrakcja dwutlenkiem węgla w stanie nadkrytycznym (10). Algi są suszone próżniowo i mielone na proszek, ekstrakcję prowadzi się pod ciśnieniem 200-300 bar z 10% dodatkiem etanolu. W tych warunkach z materiału odzyskiwano do 92% karotenoidów, z czego 75% stanowiła zestryfikowana astaksantyna.
Wolna luteina i astaksantyna czy estry?
Luteina pochodząca z roślinnego źródła (np. kwiaty aksamitki, nagietka), a także astaksantyna z alg są w postaci mieszaniny estrów. W większości suplementów diety są one także w postaci zestryfikowanej, a konwersja estrów do wolnych karotenoidów powinna nastąpić w procesie trawienia. Jednak w warunkach fizjologicznych wydajność reakcji hydrolizy zależy od aktywności enzymów trawiennych, lipazy i esterazy, która znacznie zmniejsza się z wiekiem.
Skład estrów w ekstraktach roślinnych, używanych do produkcji suplementów diety, musi być dobrze znany. Zawartość estrów w ekstraktach kwiatów nagietka zmienia się w granicach od 167 do 5752 μg/g, a w ekstraktach obecnych w suplementach diety wynosi 88,0-110,7 mg/g (11). Dominującym związkiem jest dipalmitynian luteiny, znacznie mniej jest 3’-O-mirystyniano-3-O-palmitynianu i 3’-O-palmityniano-3-O-mirystynianu oraz monoestrów.
Algi H. pluvialis zawierają astaksantynę, a jej zawartość sięga 72,0-78,8%. Podczas ekstrakcji uzyskuje się barwnik, w którym dominują monoestry astaksantyny (od 0,01 do 11,8 mg/g); zawartość diestrów to 0,05-2,7 mg/g (20,5-27,5%), wolnej astaksantyny jest tylko 0,2-0,3 mg/g suchej masy (0,5-0,7%).
Luteina i astaksantyna jako dodatki do żywności
Luteina i astaksantyna są uważane za bezpieczne, w USA mają status GRAS (Generally Recognized as Safe) i mogą być dodawane do żywności. W krajach Unii Europejskiej luteiny używa się jako koloryzującego dodatku do żywności (E 161b). Jej bezpieczeństwo zostało ocenione w 2006 roku, a ponowna ocena przez Panel EFSA ANS (Food Additives and Nutrient Sources added to Food) nastąpiła w 2010 roku (12). Naukowcy z EFSA na podstawie badań na szczurach ustalili dopuszczalne dzienne spożycie (ang. acceptable daily intake – ADI) jako 1 mg/kg masy ciała. Ustalając ADI, korzystano z ekstraktu z aksamitki, zawierającego 79% luteiny i 5% zeaksantyny, większość (> 60%) występowała w postaci estrów.
Panel EFSA (AFC) (Additives, Flavourings, Processing Aids and Materials in Contact with Food) ocenił możliwość stosowania luteiny w żywności specjalnego przeznaczenia (ang. particular nutritional uses – PARNUTs) (13). Produkty specjalnego przeznaczenia medycznego (ang. foods for special medical purposes – FSMPs) mogą mieć taką ilość luteiny, która odpowiada dziennej dawce 0,5-2 mg. Nie ma produktu FSMP z wysoką dawką luteiny (np. 20-40 mg), który mógłby być dietetycznym wsparciem terapii degeneracji plamki żółtej oka (AMD).
Eksperci EFSA stwierdzili, że dzienna dawka 1 mg/kg masy ciała dla luteiny z preparatów (ekstrakt z kwiatów aksamitki lub nagietka) zawierających 80% karotenoidów nie budzi kontrowersji co do jej ewentualnej toksyczności. Dla człowieka ważącego 70 kg oznacza to, że może spożyć dziennie 70 mg luteiny i 53 mg zeaksantyny, a więc znacznie więcej niż 10-20 mg podawane w badaniach klinicznych. Wartość NOAEL (ang. no-observed-adverse-effect level, poziom niewywołujący dających się zaobserwować szkodliwych skutków) dla koncentratu luteiny z zeaksantyną określono na 400 mg/kg masy ciała.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Kidd P. Astaxanthin, cell membrane nutrient with diverse clinical benefits and anti-aging potential. Altern Med Rev 2011; 16:355-64.
2. Fakhri S, Abbaszadeh F, Dargahi L i wsp. A mechanistic review on its biological activities and health benefits. Pharmacol Res 2018; 136:1-20.
3. Goto S, Kogure K, Abe K i wsp. Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid Astaxanthin. Biochim Biophys Acta Biomembr 2001; 1512:251-8.
4. Bone RA, Landrum JT, Friedes LM i wsp. Distribution of lutein and zeaxanthin stereoisomers in the human retina. Exp Eye Res 1997; 64(2):211-8.
5. Khachik F, Chang AN. Total synthesis of (3R,3’R,6’R)-lutein and its stereoisomers. J Org Chem 2009; 74(10):3875-85.
6. Fernandez-Sevilla JM, Acien Fernandez FG, Molina Grima E. Biotechnological production of lutein and its applications. Appl Microbiol Biotechnol 2010; 86(1):27-40.
7. Mahariva S, Iovinas A, Di Sanzo G i wsp. Supercritical fluid extraction of lutein from Scenedesmus almeriensis. Molecules 2019; 24(7):E1324.
8. Stachowiak B, Szulc P. Astaxanthin for the food industry. Molecules 2021; 26(9):2666.
9. Collins AM, Jenes HDT, Han D i wsp. Carotenoid distribution in living cells of Haematococcus pluvialis (Chlorophyceae). PLoS One 2011; 6(9):e24302.
10. Nobre B, Marcelo F, Passos R i wsp. Supercritical carbon dioxide extraction of astaxanthin and other carotenoids from the microalga Haematococcus pluvialis. Eur Food Res Technol 2006; 223:787-90.
11. Abdel-Aal el SM, Rabalski I. Composition of lutein ester regioisomers in marigold flower, dietary supplement, and herbal tea. J Agric Food Chem 2015; 63(44):9740-6.
12. EFSA (European Food Safety Authority), 2010. Scientific Opinion on the re-evaluation of lutein (E 161b) as a food additive. EFSA Panel on Food Additives and Nutrient Sources added to Food (ANS). EFSA Journal 2010; 8(7):1678.
13. EFSA (European Food Safety Authority), 2006. Opinion of the Scientific Panel on Food Additives, Flavourings, Processing Aids and Materials in Contact with Food on a request from the Commission related to Lutein for use in foods for nutritional uses. Question EFSA Q-2003-128. Adopted on 26 January 2006.
14. EFSA Panel on Nutrition, Novel Foods, and Food Allergens “Safety of astaxanthin for its use as a novel food in food supplements”. NDA EFSA Journal 2020; 18(2):e05993.
15. Shah MM, Liang Y, Cheng JJ, Daroch M. Astaxanthin-producing green microalga Haematococcus pluvialis: from single cell to high value commercial products. Front Plant Sci 2016; 7:531.
16. Spiller GA, Dewell A. Safety of an astaxanthin-rich Haematococcus pluvialis algal extract: A randomized clinical trial. J Med Food 2003; 6:51-6.
17. Mercke Odeberg J, Lignell A, Pettersson A i wsp. Oral bioavailability of the antioxidant astaxanthin in humans is enhanced by incorporation of lipid-based formulations. Eur J Pharm Sci 2003; 19:299-304.
18. Age-Related Eye Disease Study Research Group: A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta-carotene, and zinc for age-related macular degeneration and vision loss: AREDS report, No.8. Arch Ophthalmol 2001; 119(10):1417.
19. Age-related eye disease study research group: the relationship of dietary carotenoid and vitamin A, E, and C intake with age-related macular degeneration in a case-control study AREDS report, No. 22. Arch Ophthalmol 2007; 125(9):1225.
20. Castro Lima V, Rosen RB, Farah M. Macular pigment in retinal health and disease. Int J RetinVitr 2016; 2:19.
21. Cho E, Hankinson SE, Rosner B i wsp. Prospective study of lutein/zeaxanthin intake and risk of age-related macular degeneration. Am J Clin Nutr 2008; 87(6):1837-43.
22. Feigl B, Morris CP, Voisey J i wsp. The relationship between BCMO1 gene variants and macular pigment optical density in persons with and without age-related macular degeneration. PLoS One 2014; 9(2):e89069.
23. Borel P, de Edelenyi FS, Vincent-Baundry S i wsp. Genetic variants in BCMO1 and CD36 are associated with plasma lutein concentrations and macular pigment optical density in humans. Ann Med 2011; 43(1):47-59.
24. Ma L, Dou HL, Wu YQ i wsp. Lutein and zeaxanthin intake and the risk of age-related macular degeneration: a systematic review and meta-analysis. Br J Nutr 2012; 107(3):350-9.
25. Landrum JT, Bone RA, Joa H i wsp. A one-year study of the macular pigment: The effect of 140 days of a lutein supplement. Exp Eye Res 1997; 65(1):57-62.
26. Bone RA, Landrum JT. Dose-dependent response of serum lutein and macular pigment optical density to supplementation with lutein esters. Arch Biochem Biophys 2010; 504(1):50-5.
27. Yao Y, Qiu QH, Wu XW i wsp. Lutein supplementation improves visual performance in Chinese drivers: 1-year randomized, double-blind, placebo-controlled study. Nutrition 2013; 29(7-8):958-64.
28. Ma L, Lin XM, Zou ZY i wsp. A 12-week lutein supplementation improves visual function in Chinese people with long-term computer display light exposure. Br J Nutr 2009; 102(2):186-90.
29. Xue C, Rosen R, Jordan A i wsp. Management of ocular diseases using lutein and zeaxanthin: What have we learned from experimental animal studies? J Ophthalmol 2015; 2015:523027.
30. Bernstein PS, Li B, Preejith P i wsp. Lutein, zeaxanthin, and meso-zeaxanthin: The basic and clinical science underlying carotenoid-based nutritional interventions against ocular disease. Prog Retin Eye Res 2016; 50:34-66.
31. Obana A, Tanito M, Gahto Y i wsp. Changes in macular pigment optical density and serum lutein concentration in Japanese subjects taking two different lutein supplements. PLoS One 2015; 10(10):e0139257.
32. Kelly D, Coen RF, Akuffo KO i wsp. A cognitive function and its relationship with macular pigment optical density and serum concentrations of its constituent carotenoids. J Alzheimers Dis 2015; 48:261-77.
33. Giannaccare G, Pellegrini M, Senni C i wsp. Clinical applications of astaxanthin in the treatment of ocular diseases: emerging insights. Mar Drugs 2020;18(5):239.
34. Nagaki Y, Hayasaka S, Yamada T i wsp. Effects of astaxanthin on accommodation, critical flicker fusion, and pattern visual evoked potential in visual display terminal workers. J Tradit Med 2002; 19:170-3.
35. Kajita M, Tsukahara H, Kato M. The effects of a dietary supplement containing astaxanthin on the accommodation function of the eye in middle-aged and older people. Med Consult New Remedies 2009; 46:89.
36. Kono K, Shimizu Y, Takahashi S i wsp. Effect of multiple dietary supplements containing lutein, astaxanthin, cyanidin-3-glucoside, and DHA on accommodative ability. Curr Med Chem 2014; 14(2):114-25.
37. Pashkow FJ, Watumull DG, Campbell CL. Astaxanthin: a novel potential treatment for oxidative stress and inflammation in cardiovascular disease. Am J Cardiol 2008; 101(10A):58D.
38. Wu D, Xu H, Chen J i wsp. Effects of astaxanthin supplementation on oxidative stress. Int J Vitam Nutr Res 2020; 90 (1-2):179-94.
39. Liu X, Osawa T. Astaxanthin protects neuronal cells against oxidative damage and is a potent candidate for brain food. Forum Nutr 2009; 61:129-35.
40. Katagiri M, Satoh A, Tsuji S i wsp. Effects of astaxanthin-rich Haematococcus pluvialis extract on cognitive function: a randomised, double-blind, placebo-controlled study. J Clin Biochem Nutr 2012; 51(2):102-7.
41. Nouchi R, Suiko T, Kimura E i wsp. Effects of lutein and astaxanthin intake on the improvement of cognitive functions among healthy adults: A systematic review of randomized controlled trials. Nutrients 2020; 12(3):617.
42. Talukdar J, Bhadra B, Dattaroy T i wsp. Potential of natural astaxanthin in alleviating the risk of cytokine storm in COVID-19. Biomed Pharmacother 2020; 132:110886.

