*Katarzyna Gryta1, Katarzyna Paradowska2
Resweratrol – budowa, właściwości i wpływ na organizm ludzki
Resveratrol – structure, properties, and effect on the human body
1SKN Free Radicals przy Zakładzie Chemii Fizycznej, Wydział Farmaceutyczny, Warszawski Uniwersytet Medyczny
Opiekun Koła: dr hab. n. farm. Łukasz Szeleszczuk
2Zakład Chemii Fizycznej, Wydział Farmaceutyczny, Warszawski Uniwersytet Medyczny
Kierownik Zakładu: dr hab. n. farm. Dariusz Maciej Pisklak
Streszczenie
Resweratrol jest naturalnie występującym polifenolem z grupy stilbenów. Po raz pierwszy został wyizolowany w 1940 roku z korzeni ciemiężycy białej. Wytwarzany jest przez rośliny w odpowiedzi na stres, skaleczenie, infekcje lub silne promieniowanie UV. Wpływa na odporność roślin na patogeny poprzez jego działanie grzybobójcze.
Występuje w czerwonym winie, wyrobach czekoladowych, orzechach ziemnych, warzywach i różnorodnych owocach jagodowych. Resweratrol jest często głównym składnikiem roślin i owoców stosowanych w ludowej medycynie chińskiej i japońskiej. Był on przedmiotem badań międzynarodowego projektu MONICA, monitorującego umieralność, zachorowalność i redukcję czynników ryzyka związanych z chorobami układu krążenia, przeprowadzonego w 21 krajach, w 38 ośrodkach. Resweratrol posiada zróżnicowane właściwości potencjalnie mogące przedłużyć życie: kardioprotekcyjne, neuroprotekcyjne i przeciwnowotworowe. Uważa się, że dzięki jego korzystnym właściwościom i brakowi toksyczności powinien być elementem codziennej, zróżnicowanej i zbilansowanej diety.
Summary
Resveratrol is a naturally occurring polyphenol from the stilben group. It was first isolated in 1940 from the roots of the white hellebore. It is produced by plants in response to stress, cuts, infections or strong UV radiation. It affects the resistance of plants to pathogens through its fungicidal action. It is found in red wine, chocolate products, peanuts, vegetables, and a variety of berries. Resveratrol is often the main ingredient in plants and fruits used in folk Chinese and Japanese medicine. Resveratrol has been studied by the international MONICA project monitoring mortality, morbidity and risk factor reduction associated with cardiovascular disease and has been performed in 21 countries at 38 centers. Resveratrol has a variety of potentially life-prolonging properties: cardioprotective, neuroprotective and anti-cancer. It is believed that due to its beneficial properties and non-toxicity, it should be part of a daily, varied and balanced diet.

Wstęp
Nauka nieustannie poszukuje nowych substancji mogących przedłużyć życie i uchronić przed zwiększoną zapadalnością na choroby cywilizacyjne, w tym nowotworowe. Obserwujemy zainteresowanie społeczeństwa takimi produktami i rosnący popyt na suplementy diety np. obniżające poziom cukru lub wspomagające pracę serca. Surowce roślinne są źródłem takich substancji, warto więc przypomnieć, że szereg obecnie stosowanych leków wywodzi się z surowców roślinnych, np. morfina z opium lub słomy makowej, chinina z kory chinowca, a prekursorem aspiryny są salicylany z kory wierzby. Niektóre substancje wyizolowane kilkadziesiąt lat temu nadal są przedmiotem badań, posiadają interesujące właściwości m.in. dla kardiologii, diabetologii czy pulmonologii.
Resweratrol to naturalnie występujący polifenol z grupy stilbenów, wytwarzany przez rośliny w odpowiedzi na stres, uszkodzenie, infekcje patogenów (działa grzybobójczo) lub promieniowanie UV. Znaleziono go w czerwonym winie, ale więcej jest go w liściach winogron niż owocach. Największą rozpoznawalność przyniósł resweratrolowi projekt MONICA (Multinational MONItoring of trends and determinants in CArdiovascular diseases), w którym wykazano jego pozytywne działanie na organizm człowieka. Dzięki właściwościom antyoksydacyjnym i hamującym rozwój procesów nowotworowych pozostaje często badaną substancją, istotną zarówno w profilaktyce, jak i we wspomaganiu leczenia.
Francuski paradoks
W wielu krajach Europy obserwowano korelację między spożywaniem produktów bogatych w tłuszcze zwierzęce a wysoką śmiertelnością spowodowaną chorobami układu krążenia, u podłoża których jest miażdżyca. Zjawisko to występuje w znacznie mniejszym stopniu w południowej Francji, co zostało nazwane francuskim paradoksem (ang. French paradox). Przyczyną tego zjawiska w krajach basenu Morza Śródziemnego jest zwyczaj regularnego spożywania przez mieszkańców umiarkowanej ilości czerwonego wina, zawierającego oprócz antocyjanów m.in. resweratrol, który znacząco wpływa na obniżenie wskaźnika śmiertelności z powodu schorzeń sercowo-naczyniowych (1).
Największe badanie epidemiologiczne trwające ponad 10 lat i dostarczające informacji o stanie zdrowia populacji w Europie zostało zorganizowane przez WHO (World Health Organization) na początku lat 80. XX wieku. Międzynarodowy projekt MONICA bazował na monitorowaniu trendów umieralności, zachorowalności i redukcji czynników ryzyka związanych z chorobami układu krążenia. Projekt został przeprowadzony w 21 krajach, w tym w 38 ośrodkach, również na terenie Polski. Grupę badawczą stanowiły zarówno kobiety, jak i mężczyźni w wieku od 25 do 64 lat (2).
Otrzymane wyniki wykazały, że wskaźnik śmiertelności we Francji jest bardziej zbliżony do stwierdzanego w Japonii i Chinach, różny od obserwowanego w USA lub Wielkiej Brytanii. U mieszkańców USA i Wielkiej Brytanii odnotowano również zbliżony poziom cholesterolu we krwi (wyższy), co jest skutkiem diety bogatej w dużą ilość tłuszczów nasyconych. Problem ten w szczególności dotyczył kobiet.
Wzięto pod uwagę również pozostałe czynniki mogące mieć wpływ na wyniki badania, takie jak: palenie papierosów, wskaźnik BMI (ang. body mass index) oraz ciśnienie krwi. Wykazano, że nie powodowały one istotnie statystycznej różnicy w porównaniu z pozostałymi krajami.
Początkowo wysnuto wniosek, że przyczyną francuskiego paradoksu jest wpływ diety typowej dla Francji. Kraj słynie z wysokiego spożycia pieczywa, warzyw, owoców i sera oraz wina, będącego podstawą kuchni śródziemnomorskiej. Wyniki z 17 krajów (3) potwierdziły, że istnieje korelacja między konsumpcją wina, a produktami zawierającymi tłuszcze zwierzęce. To przyczyniło się do podjęcia dalszych badań, aby potwierdzić obserwacje związane z potencjalnie korzystnym wpływem spożywania czerwonego wina. Jako miejsce analiz wybrano m.in. Tuluzę, miejscowość w regionie specjalizującym się w produkcji wina oraz słynącym z niskiego wskaźnika śmiertelności z powodu chorób układu sercowo-naczyniowego. Na podstawie uzyskanych wyników stwierdzono, że składnikiem mającym istotny wpływ na właściwości kardioprotekcyjne wina jest resweratrol.
Występowanie, budowa i właściwości
Po raz pierwszy resweratrol wyizolowano ponad 80 lat temu (w 1940 roku) (4) z korzeni ciemiężycy białej (Veratrum album L.), a następnie w 1963 roku z korzeni rdestowca ostrokończystego (Reynoutria japonica Houtt.), uprawianego głównie w Chinach i Japonii.
Resweratrol występuje również w orzechach ziemnych, warzywach i różnorodnych owocach jagodowych, m.in. owocach morwy, żurawiny, borówki czernicy i brusznic, borówki amerykańskiej, czarnej porzeczki, truskawek, a także malin i aronii, obecny jest również w wyrobach czekoladowych. Jest częstym składnikiem roślin stosowanych w ludowej medycynie chińskiej i japońskiej: Cassia quinaquangulata, C. garrettiana, Reynoutria japonica oraz Ficus barteri (5). Jednakże za najlepsze źródło resweratrolu uważa się winogrona, szczególnie owoce szczepu Pinot Noir (6), oraz czerwone wino. Resweratrol spełnia rolę substancji obronnej (fitoaleksyna), która syntetyzowana jest przez rośliny w odpowiedzi na uszkodzenie tkanki, a zwłaszcza po ataku patogennych grzybów, np. szarej pleśni i bakterii. Przeciwdziała on również skutkom innych czynników stresowych, takich jak nadmiar promieniowania UV, niedobór wody lub ekspozycja na ozon (7). Zawartość resweratrolu w roślinie po zadziałaniu czynnika indukującego osiąga maksimum po 24 godzinach i obniża się po 42-72 godzinach (1).
Proces syntezy związku (ryc. 1) katalizowany jest syntazą stilbenową (ang. stilbene synthase – STS), która wykorzystuje jako substraty trzy cząsteczki malonylo-CoA oraz jedną cząsteczkę p-kumarylo-CoA. Otrzymanym półproduktem jest tetraketon, który ulega cyklizacji w reakcji kondensacji aldolowej z uprzednim wydzieleniem czterech cząsteczek dwutlenku węgla (CO2) i czterech cząsteczek koenzymu A (8). W dalszych etapach w wyniku różnych modyfikacji (glikozylacji, metylacji, oligomeryzacji, izomeryzacji i izoprenylacji) powstaje resweratrol i pochodne (9).

Ryc. 1. Reakcja syntezy trans-resweratrolu
Resweratrol (3,5,4’-trihydroksystilben) to organiczny związek chemiczny, który należy do polifenolowych pochodnych stilbenu. Struktura chemiczna podobna jest do syntetycznego dietylostilbestrolu estrogenowego (4,4’-dihydroksy-trans-α, β-dietylostilbenu), zaliczanego do fitoestrogenów, hormonów roślinnych mających działanie podobne do estrogenu (1).
Resweratrol może występować w dwóch formach (izomery geometryczne): cis i trans (ryc. 2a, b), które różnią się od siebie właściwościami fizykochemicznymi. Naturalnie występuje izomer trans i tylko on wykazuje aktywność biologiczną. Izomer trans może przekształcić się w formę cis m.in. w wyniku promieniowania UV, fermentacji lub wysokiego pH. W materiale roślinnym stabilniejszy jest izomer trans, dlatego wykorzystywany jest on w celach badawczych.
Ryc. 2a, b. Formy izomeryczne resweratrolu: a. cis, b. trans
trans-Resweratrol dobrze rozpuszcza się w rozpuszczalnikach organicznych, takich jak etanol, DMSO (dimetylosulfotlenek) i DMF (dimetyloformamid), słabo w roztworach wodnych (10).
W badaniu przeprowadzonym przez Trela i Waterhouse (11) zarejestrowano widma absorpcyjne obu izomerów w etanolowych roztworach w zakresie UV i wyznaczono molowe współczynniki absorpcji jako Emax = 1,26 × 104 l/mol cm przy λ = 288 nm oraz Emax = 3 × 104 l/mol cm przy λ = 308 nm, odpowiednio dla cis- i trans-resweratrolu (12). Otrzymane widma UV przedstawiono na wykresie odpowiednio dla obu izomerów cis i trans (ryc. 3).
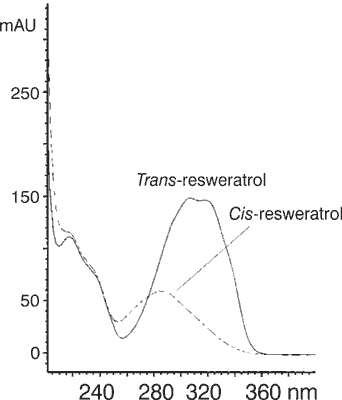
Ryc. 3. Widma absorpcyjne izomerów cis i trans (11)
W badaniach resweratrolu wykorzystano także metody teoretyczne, nazywane in silico.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Kopeć A, Piątkowska E, Leszczyńska T i wsp. Prozdrowotne właściwości resweratrolu. Żywn Nauka Technol Jakość 2011; 5(78):5-15.
2. Bryła M, Maciak A, Marcinkowski JT i wsp. Programy profilaktyczne w zakresie chorób układu krążenia przykładem niwelowania nierówności w stanie zdrowia. Probl Hig Epidemiol 2009; 90(1):6-17.
3. Renaud S, de Lorgeril M. Wine, alcohol, platelets, and the French paradox for coronary heart disease. Lancet 1992; 339(8808):1523-6.
4. Timmers S, Auwerx J, Schrauwen P. The journey of resveratrol from yeast to human. Aging 2012; 4(3):146-58.
5. Olas B. Antyoksydanty obecne w diecie w walce z miażdżycą. Kosmos 2003; 52(2-3):249-58.
6. Van Leeuw R, Kevers C, Pincemail J i wsp. Antioxidant capacity and phenolic composition of red wines from various grape varieties: Specificity of Pinot Noir. Jour Food Comp Anal 2014; 36(1-2):40-50.
7. Tian B, Liu J. Resveratrol: a review of plant sources, synthesis, stability, modification and food application. J Sci Food Agric 2020; 100(4):1392-404.
8. Przysławski J, Dzięcioł M. Resweratrol – aktualny stan wiedzy. Bromat Chem Toksykol 2012; 4:1166-74.
9. He S, Yan X. From resveratrol to its derivatives: New Sources of Natural Antioxidant. Curr Med Chem 2013; 20(8):1005-17.
10. Ha E, Park H, Lee S i wsp. Equilibrium solubility and modeling of trans-resveratrol in dichloromethane and primary alcohol solvent mixtures at different temperatures. J Mol Liq 2020; 311:113363.
11. Trela BC, Waterhouse AL. Resveratrol: Isomeric molar absorptivities and stability. J Agric Food Chem 1996; 44(5):1253-7.
12. Małyszko J, Karbarz M. Substancje biologicznie aktywne w winie. Wiad Chem 2012; 66(5-6):563-79.
13. Majewicz A, Marcinkowski J. Epidemiologia chorób układu krążenia. Dlaczego w Polsce jest tak małe zainteresowanie istniejącymi programami profilaktycznymi. Probl Hig Epidemiol 2008; 89(3):322-5.
14. Olas B. Resweratrol jako dobroczyńca w profilaktyce chorób układu krążenia. Kosmos 2006; 55(2-3):277-85.
15. Rivera L, Morón R, Zarzuelo A i wsp. Long-term resveratrol administration reduces metabolic disturbances and lowers blood pressure in obese Zucker rats. Biochem Pharmacol 2009; 77(6):1053-63.
16. Kmieć N, Wełnicka-Jaśkiewicz M, Jassem J. Niesteroidowe leki przeciwzapalne w profilaktyce i leczeniu nowotworów jelita grubego. Nowotwory J Oncol 2014; 64(2):175-9.
17. Richard N, Porath D, Radspieler A i wsp. Effects of resveratrol, piceatannol, tri-acetoxystilbene, and genistein on the inflammatory response of human peripheral blood leukocytes. Mol Nutr Food Res 2005; 49(5):431-42.
18. Martín AR, Villegas I, La Casa C i wsp. Resveratrol, a polyphenol found in grapes, suppresses oxidative damage and stimulates apoptosis during early colonic inflammation in rats. Biochem Pharmacol 2004; 67(7):1399-410.
19. King RE, Bomser JA, Min DB. Bioactivity of Resveratrol. Comp Rev Food Sci Food Safety 2006; 5(3):65-70.
20. Zagórska-Dziok M, Furman-Toczek D, Kruszewski M i wsp. Resweratrol jako związek chemoprewencyjny w terapii nowotworów. Probl Hig Epidemiol 2016; 97(4):308-17.
21. Crowell JA, Korytko PJ, Morrissey RL i wsp. Resveratrol-Associated Renal Toxicity. Toxicol Sci 2004; 82(2):614-9.
22. Cottart CH, Nivet-Antoine V, Laguillier-Morizot C i wsp. Resveratrol bioavailability and toxicity in humans. Mol Nutr Food Res 2010; 54(1):7-16.
23. Williams LD, Burdock GA, Edwards JA i wsp. Safety studies conducted on high-purity trans-resveratrol in experimental animals. Food Chem Toxicol 2009; 47(9):2170-82.



