© Borgis - Medycyna Rodzinna 3/2009, s. 49-53
*Joanna Kałużna-Czaplińska1, Ewa Socha1, Monika Michalska1, Wioletta Grys1, Anna Rozetti-Szymańska2, Joanna Wójcik2, Jacek Rynkowski1
Poziom kwasu homowanilinowego u autystyków*
The level of homovanillic acid in urine of autistic children
1Instytut Chemii Ogólnej i Ekologicznej, Wydział Chemiczny Politechniki Łódzkiej
Dyrektor Instytutu: prof. dr hab. Jacek Rynkowski
2NZOZ „NAVICULA-CENTRUM”, Poradnia dla Dzieci i Młodzieży z Autyzmem Dziecięcym
Dyrektor NAVICULA-CENTRUM: dr n. med. Anna Rozetti-Szymańska
Summary
Aim:The aim of this work was to develop a method of analysis of homovanillic acid in urine and to determine levels of this acid in urine of healthy and autistic children.
Material and methods: Urine samples were collected from 52 autistic children (4-11 years) who underwent rehabilitation at the "Navicula” Clinic of Developmental Dislocations in Lodz, and from 21 neurologically normal children (4-11 years).
We present method for the quantification of homovanillic acid in the urine by using capillary gas chromatography – mass spectrometry (GC/MS). HVA was extracted using ethyl acetate and diethyl ether and then was derivatized with bis-(trimethylsilyl) trifluoroacetamide (BSTFA).
Results: In 71% of autistic children we observed increase in urinary HVA levels (13.7 ± 6.2 ug/ml), and in 15,8% the levels of HMA were low in the urine of autistic children (2.0 ± 1.2 ug/ml). In the case 13.2% the levels of HVA are similar compared to the generally healthy children (4.4 ± 0.6 ug/ml).
Conclusions: Abnormal levels of HVA in urine are observed in child autism. Function disorders of dopaminergic system can be related to such autism symptoms as behavior stereotype, mood disorders, fits of aggression and deficits in interpersonal communication, for example avoiding social interactions.

WSTĘP
Dopamina (3,4-dihydroksyetyloamina) oprócz adrenaliny i noradrenaliny należy do grupy neuroprzekaźników nazywanych katecholaminami. Charakterystyczną cechą tych związków jest obecność w strukturze cząsteczki reszty aminowej oraz pierścienia benzenowego z dwiema sąsiadującymi grupami hydroksylowymi w pozycji 3´ oraz 4´, czyli katecholu. Ze względu na niskie poziomy katecholamin w próbkach biologicznych, skłonności grup katecholowych do utleniania oraz ich hydrofilowych właściwości, analiza tych związków sprawia ogromne trudności (1-2). Dopamina (DA) bierze udział w regulacji różnych procesów, takich jak: utrzymanie postawy ciała i poruszanie się, zapamiętywanie i uczenie się, interpretowanie bodźców emocjonalnych (1). Dopamina syntetyzowana jest w komórkach chromochłonnych rdzenia nadnerczy, który stanowi wydłużenie współczulnego układu nerwowego (3). Biosynteza dopaminy zaczyna się od aminokwasu L-tyrozyny. Enzym hydroksylaza tyrozynowa katalizuje wprowadzenie drugiej grupy fenolowej, w wyniku czego tworzy się L-dopa, która w następnym etapie ulega dekarboksylacji do DA (reakcja ta katalizowana jest przez enzym o nazwie dekarboksylaza dopy) (4). Dopamina ulega szybkiej metabolizacji pod wpływem O-Metylotransferazy katecholowej (COMT) i oksydazy monoaminowej (MAO). W wyniku działania tych enzymów powstają nieaktywne metabolity. Monoaminooksydaza występuje w dwóch odmianach: MAO-A i MAO-B. Dopamina ulega rozkładowi pod wpływem obu izozymów. Metabolitami DA są: kwas dihydroksyfenylooctowy (DOPAC), 3-metoksytyramina (3-MT) oraz kwas homowanilinowy (HVA) (ryc. 1) (3). Kwas homowanilinowy jest głównym metabolitem dopaminy. Jest aromatycznym kwasem karboksylowym o wzorze C9H1004. Według nazewnictwa IUPAC HVA to kwas 2-(4-hydroksy-3-metoksy-fenylo)octowy (5).
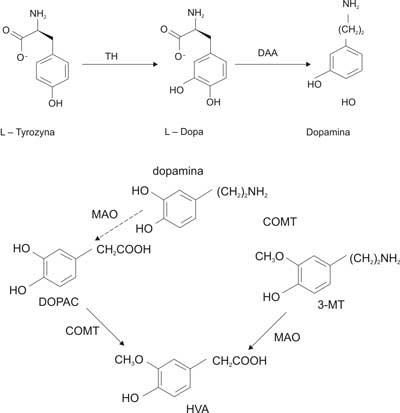
Ryc. 1. Synteza i metabolizm dopaminy.
Z danych literaturowych wynika, że zawartość HVA w płynach ustrojowych jest silnie zależna od wieku i maleje wraz z nim (6-9). Oznaczanie zawartości kwasu homowanilinowego w próbkach biologicznych ma istotne znaczenie w diagnostyce klinicznej oraz w badaniach nad patogenezą wielu chorób. Wykrywanie HVA z wykorzystaniem metod chromatograficznych znajduje również zastosowanie w badaniach nad mechanizmem działania leków działających na neurony dopaminergiczne. Oznaczanie głównego metabolitu dopaminy może być także pomocne przy wykrywaniu narkotyków i środków dopingujących. Nieprawidłowe zawartości HVA w płynach ustrojowych oraz tkankach są wynikiem wielu schorzeń, takich jak.: choroba Parkinsona, pląsawica Huntingtona, zespół Costello, epilepsja, dystonia, hipokinezja, nadciśnienie i hipotonia, choroby psychiczne (schizofrenia, manie, depresje), nowotwory (guz chromochłonny oraz występujący we wczesnym dzieciństwie nerwiak niedojrzały) (9-13). Zmienione poziomy HVA w płynach biologicznych mogą również być charakterystyczne dla autyzmu dziecięcego. Niektóre zaburzenia funkcjonowania układu dopaminergicznego mogą być związane z takimi objawami autyzmu, jak: stereotyp zachowań, zaburzenia nastroju, napady agresji, deficyty w sferze komunikacji interpersonalnej. Doświadczalne podanie nadmiernej ilości agonistów (przekaźników zastępczych) receptorów dla dopaminy wywołuje u zwierząt doświadczalnych stereotypie i zwiększoną aktywność ruchową – objawy obserwowane w przebiegu autyzmu u ludzi (14). Wynikiem zbyt dużego pobudzenia neuroprzekaźnika jest tworzenie się toksycznych związków, powodujących uszkodzenia neurologiczne, co przyczynia się do objawów widocznych u autystycznych pacjentów (15). Chociaż u części chorych mogą występować zaburzenia metabolizmu neuroprzekaźników, takich jak dopamina, w ośrodkowym układzie nerwowym, to jednak badania dotyczące neurochemicznych podstaw autyzmu są nadal prowadzone i nie ustalono jeszcze jednoznacznej hipotezy. Opublikowano prace, w których nie stwierdzono znaczących różnic pomiędzy poziomem HVA w płynach biologicznych u dzieci autystycznych i zdrowych. Jednakże wyższy poziom HVA w płynie mózgowo-rdzeniowym został znaleziony u dzieci z zaostrzonymi objawami, zwłaszcza wzmożoną aktywnością ruchową i silnymi stereotypiami. Znaleziono podwyższone stężenia tego kwasu w płynie mózgowo-rdzeniowym u wolnych od lekarstw autystycznych dzieci (16). Część badaczy nie stwierdziła znaczących różnic pomiędzy nieleczonymi autystycznymi dziećmi a zdrowymi pod względem stężenia HVA w moczu i osoczu krwi. Poziom tego kwasu znacząco wzrasta w płynach ustrojowych dzieci autystycznych leczonych środkami neuroleptycznymi (17).
W chemii klinicznej techniki chromatograficzne znalazły szerokie zastosowanie w oznaczaniu kwasu homowanilinowego w matrycy biologicznej. Obok najpowszechniej stosowanych technik łączonych: chromatografii gazowej sprzężonej ze spektrometrią mas (GC-MS) oraz wysokosprawnej chromatografii cieczowej połączonej z detekcją elektrochemiczną (HPLC-ED), wymienić tu należy także chromatografię gazową z detekcją płomieniowo-jonizacyjną, wysokosprawną chromatografię cieczową z detekcją fluoroscencyjną i chemiluminescencyjną. W prezentowanej pracy opracowana została metoda oznaczania kwasu homowanilinowego w moczu z wykorzystaniem chromatografii gazowej sprzężonej ze spektrometrią mas. Ponadto zostały określone poziomy tego kwasu w moczu dzieci zdrowych i dzieci autystycznych.
MATERIAŁ I METODY
Materiał badawczy: mocz pochodzący od 52 dzieci autystycznych w przedziale wiekowym od 4 do 11 lat, zdiagnozowanych jako autystyczne pomiędzy trzecim a piątym rokiem życia, rehabilitowane w ośrodku terapeutycznym Navicula – Centrum w Łodzi, oraz dzieci zdrowych (21 dzieci) w tym samym przedziale wiekowym.
Przygotowanie próbek: Do 0,4 ml moczu dodano 10 ul standardu wewnętrznego (0,1 mg/ml kwas malonowy), 0,1 ml 6 M HCl, 0,2 ml nasyconego roztworu NaCl, 0,6 ml mieszaniny octan etylu:eter dietylowy (1:1). Próbkę wytrząsano przez 30 min. Pobraną warstwę organiczną odparowano, dodano 80 ul N,O-bis(trimetylosililo)trifluoroacetamidu (BSTFA) (odczynnik derywatyzujący) i próbkę ogrzewano w temperaturze 60°C aż do odparowania. Następnie rozpuszczono w 0,3 ml chloroformu.
Aparatura pomiarowa: Chromatograf gazowy sprzężony ze spektrometrem mas firmy Agilent Technology. Chromatograf gazowy 6890N Network GC system z kolumną HP-5MS o długości 30 m, średnicy 0,25 mm i grubości filmu fazy stacjonarnej 0,25 um. Spektrometr mas 5973 Network Mass Selective z kwadrupolowym analizatorem mas.
Chromatograf gazowy: Temperatura dozownika 250°C, temperatura pieca 110°C, (9°C/min) 200°C, (30°C/min) 290°C, gaz nośny hel, szybkość przepływu gazu nośnego 0,9 ml/min, objętość nastrzyku 1 ul, nastrzyk w trybie splitless.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Drożak J, Bryła J: Dopamina-nie tylko neuroprzekaźnik, Postępy Hig i Med Dośw 2005; 59: 405-420. 2. Woo-Yeon Pyo et al.: An effective high-performance liquid chromatographic-mass spectrometric assay for catecholamines, as the N(O,S)-ethoxycarbonyl ethyl esters, in human urine, Chromatographia 2006; 64: 731-737. 3. Murray RK et al.: Biochemia Harpera, PZWL, Warszawa 2006. 4. Patrick GL: Chemia medyczna, WNT, Warszawa 2003. 5. Human Metabolome Database, Homovanilic acid. 6. Guneral F, Bachmann C: Age-related reference values for urinary organic acids in a healthy Turkish pediatric population, Clin Chem 1994; 40: 862-866. 7. Mashige F et al.: High-performance liquid chromatographic determination of catecholamine metabolites and 5-hydroxyindoloacetic acid in human urine using mixed-mode column and eight-channel electrode electrochemical detector, J Chromatogr B Biomed Appl 1994; 658: 63-68. 8. Dale G et al.: Urinary excretion of HMMA and HVA in infants, Ann Clin Biochem 1988; 25: 233-236. 9. Bowron A et al.: Increased HVA detected on organic acid analysis in a patient with Costello syndrome, J Inherit Metab Dis 2005; 28: 1155-1156. 10. Xu H et al.: Determination of isatin and monoamine neurotransmitters in rat brain with liquid chromatography using palladium hexacyanoferrate modified electrode, Anal Chim Acta 2006; 577: 207-213. 11. Van Der Heyden JC, Rotteveel JJ, Wevers RA: Decreased homovanillic acid concentrations in cerebrospinal fluid in children without a known defect in dopamine metabolism, Eur J Pediatr Neurol 2003; 7: 31-37. 12. Adcock JL et al.: Lewis, Determination of selected neurotransmitter metabolites using monolithic column chromatography coupled with chemiluminescence detection, Talanta 2005; 67: 585-589. 13. Bose D et al.: Micellar liquid chromatography determination of some biogenic amines with electrochenical detection, J Pharm Biomed Anal 2004; 36: 357-363. 14. Wierzbiński P et al.: Zaburzenia ośrodkowej neurotransmisji w przebiegu autyzmu dziecięcego, Postępy Psychiatr Neurol 2005; 14: 57-63. 15. NeuroScience: Autism and neurotoxins, www.neuroscienceinc.com. 16. Tsai LY: Psychopharmacology in autism, Psychosom Med 1999; 61: 651-665. 17. Minderaa RB et al.: Neurochemical study of dopamine functioning in autistic and normal subjects, J Am Acad Child Adolesc Psychiatry 1989; 28: 190-194.

