© Borgis - Postępy Fitoterapii 1/2006, s. 16-22
*Loretta Pobłocka-Olech, Karina Marcinkowska, Mirosława Krauze-Baranowska
Naryngenina i jej pochodne – flawanony o wielokierunkowej aktywności farmakologicznej*
Naringenin and its derivatives – flavanones with multidirectional pharmacological activity
Katedra i Zakład Farmakognozji z Ogrodem Roślin Leczniczych Akademii Medycznej w Gdańsku
Kierownik Katedry i Zakładu: prof. dr hab. Wojciech Cisowski
Summary
Naringenin and its derivatives are constituents of some fruits (grapefruits, oranges, mandarins) and herbal medicinals (Salicis cortex). Over last years pharmacological activity of flavanones was extensively investigated – including naringenin and its prenyl derivatives (6-PN and 8-PN). The article presents the results of research on estrogenic, antiarteriosclerotic, antiulcer, antioxidant and neuroprotective activities of these compounds

Flawanony należą do grupy związków flawonoidowych rzadko spotykanych w świecie roślinnym, stanowiących jednocześnie składniki codziennej diety człowieka (naryngenina i jej pochodne) oraz leczniczych surowców roślinnych (kora wierzby – Salicis cortex). Dotychczas na tle innych połączeń flawonoidowych – flawonoli oraz flawonów, aktywność farmakologiczna flawanonów pozostawała w dużym stopniu nieznana. Badania ostatnich lat, szczególnie naryngeniny i jej pochodnych, przyniosły wiele interesujących wyników oraz wskazały na nowe możliwości zastosowania w lecznictwie pojedynczych, izolowanych związków, bądź zawierających je surowców roślinnych.
Naryngenina (5,7,4´-trihydroksyflawanon) (rycina 1) jest aglikonem – pochodną uwodornionego flawonu, nie zawierającego podwójnego wiązania między atomami węgli C-2 i C-3 (flawanon). Większość flawanonowych połączeń glikozydowych w świecie roślinnym stanowią O-glikozydy obok rzadko spotykanych form C-glikozydowych (1). Dotychczas wyodrębniono i zidentyfikowano około 100 struktur aglikonów oraz 350 glikozydów flawanonowych, w tym 5 związków o charakterze C – glikozydów. Flawanony występują zazwyczaj w formie rutynozydów z fragmentem cukrowym przyłączonym w pozycji C-7 (2). W przyrodzie bogatym źródłem flawanonów są owoce cytrusowe, przede wszystkim pomarańcze ( Citrus sinensis) i mandarynki ( Citrus reticulata), zawierające narirutynę (7-O-rutynozyd 5,7,4´-trihydroksyflawonu) (ryc. 1) i hesperydynę (7-O-rutynozyd 5,7,3´-trihydroksy-4´-metoksyflawanonu-hesperetyny) (ryc. 1) (2, 3).
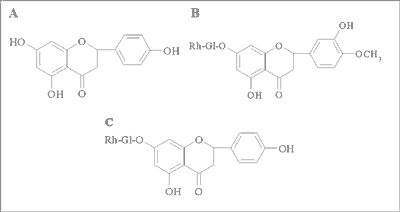
Ryc. 1. Wzory strukturalne flawanonów: A – naryngeniny, B – hesperydyny i C – narirutyny (izonarynginy).
Narirutyna i naryngina, nadająca gorzki smak owocom, są obecne w grejpfrutach ( Citrus paradisi) (20% i 70%, odpowiednio) (3). Niewielkie stężenia naryngeniny wykryto w pomidorze i jego przetworach (3). Prenylowe pochodne flawanonowe w formie wolnych aglikonów występują w gatunkach rodzin Moraceae, Leguminosae, Asteraceae i Cannabaceae, m.in. 6- i 8-prenylonaryngeninę (6-PN i 8-PN) zidentyfikowano w szyszkach chmielu (Humulus lupulus) oraz w piwie, obok izoksantohumolu i chalkonu ksantohumolu (2).
Do kierunków aktywności farmakologicznej naryngeniny i jej pochodnych należą: działanie estrogenne (3-11), obniżające poziom cholesterolu (3, 12-14), przeciwzapalne (3), przeciwwrzodowe (15-17), rozkurczowe (18, 19), ochronne na skórę (20, 21) i przeciwnowotoworowe (7, 8).
Działanie estrogenopodobne
Estrogeny pełnią funkcję regulacyjną w obrębie układu krwionośnego, nerwowego i kostnego oraz układu moczowo-płciowego – męskich i żeńskich organów rozrodczych (4). W lecznictwie są stosowane w zapobieganiu i łagodzeniu symptomów przekwitania oraz w antykoncepcji (4). Posiadają one korzystny wpływ w leczeniu osteoporozy i chorób układu sercowo-naczyniowego (4). Efektem ubocznym terapii estrogenami jest stymulacja zmian nowotworowych, m.in. rozwój nowotworu piersi (4).
Fitoestrogeny to polifenolowe, niesteroidowe związki roślinne wiążące się z receptorami estrogenowymi (ERs) o działaniu podobnym do fizjologicznych estrogenów (4). Liczne doniesienia naukowe podkreślają znaczenie diety bogatej w fitoestrogeny, głównie obecne w soji, jako czynnik zmniejszający ryzyko rozwoju raka prostaty, okrężnicy oraz schorzeń układu sercowo-naczyniowego. Z drugiej strony należy brać pod uwagę potencjalne ryzyko „spożycia” znacznych ilości tych związków, jako składników żywności.
Mechanizm działania fitoestrogenów opiera się na wiązaniu receptorów estrogenowych dwóch typów: ERα i ERβ. Receptor ERα wykazuje wysoką ekspresję w macicy oraz w jądrach, jajnikach i nerkach, podczas gdy ERβ głównie w prostacie oraz w macicy, jajnikach, jądrach, kościach, płucach i mózgu (4). Jednocześnie fitoestrogeny oddziałują na enzymy uczestniczące w biosyntezie estrogenów (4). Fitoestrogeny, podobnie jak leki syntetyczne, będąc selektywnymi modulatorami ER (SERMs), mogą pełnić funkcje agonistów lub antagonistów receptorów estrogenowych w zależności od izoformy receptora. Do grupy roślinnych estrogenów są zaliczane izoflawonoidy – kumestrol, genisteina, ekwol, daidzeina, biochanina A, flawanony pochodne naryngeniny oraz stilbeny i lignany (4). Stwierdzono, że naryngenina wywiera działanie antyestrogenne w obecności receptorów ERα, natomiast w obecności receptorów ERβ wykazuje działanie podobne do 17β-estradiolu (8).
Naryngenina, w mniejszym stopniu niż 4,4´-dihydroksychalkon, genisteina i izolikwirytygenina, współzawodniczy z 17β-estradiolem o wiązanie z receptorem estrogenowym w komórkach COS-7 (6). Aktywność estrogenową flawonoidowych związków naturalnych opisano w następującej kolejności: 17β-estradiol>> 4,4´-dihydroksychalkon = izolikwirytygenina = genisteina> floretyna = 4´,7-dihydroksyflawanon = naryngenina = apigenina. Siła oddziaływania z receptorem zwiększa się ze wzrostem stężenia analizowanych związków. Działanie estrogenopodobne naryngeniny jest 103-104-krotnie słabsze niż 17β-estradiolu (6).
Wysoce aktywnym fitoestrogenem w warunkach in vitro jest 8-prenylonaryngenina (8-PN) (ryc. 2) występująca w drewnie Anaxagorea luzonensis oraz w szyszkach chmielu i w piwie (9).
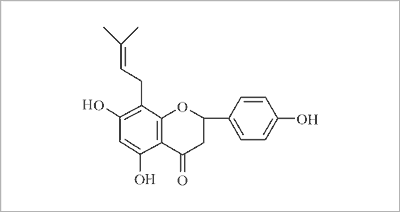
Ryc. 2. Wzór strukturalny 8-prenylonaryngeniny (8-PN).
Zbliżoną aktywnością do 8-PN charakteryzuje się 6-(1,1-dimetyloallilo)-naryngenina (6-DMAN) (ryc. 3) z liści afrykańskiego drzewa Monotes engleri.
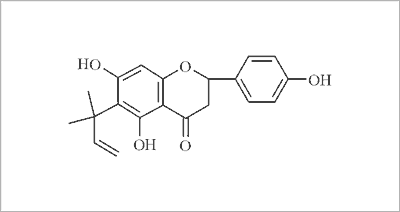
Ryc. 3. Wzór strukturalny 6-(1,1-dimetylallilo)-naryngeniny (6-DMAN).
Powinowactwo 8-prenylonaryngeniny do receptorów ERα i ERβ jest większe niż w przypadku uznanych za najbardziej aktywne izoflawonoidów: kumestrolu i genisteiny (ryc. 4) (22). Zmiana położenia podstawnika prenylowego z pozycji C-8 na C-6 powoduje zanik aktywności estrogennej. Dla obydwu prenylowych pochodnych naryngeniny wykazano in vitro działanie przeciwnowotworowe poprzez wpływ na kompleks białek adhezyjnych E-kadheryny/kateniny. Odkrycie to wymaga dalszych badań w warunkach in vivo.
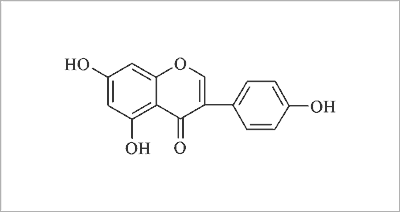
Ryc. 4. Wzór strukturalny genisteiny.
Aktywność pochodnych naryngeniny badano w modelu receptora estrogenowego w komórkach drożdży oraz na linii komórek MVLN-ERα-pozytywne komórki ludzkiego nowotworu piersi MCF-7 (9). 8-Prenylonaryngenina i 6-DMAN w eksperymencie z użyciem komórek MVLN były aktywne w stężeniach 5x10-6 i 10-6 M odpowiednio, w porównaniu do estradiolu aktywnego w stężeniu 10-8 M. W innych badaniach na komórkach MVLN, 6-DMAN ujawniła nieznacznie silniejszy efekt od genisteiny i 8-prenylonaryngeniny (10). Na linii komórek raka piersi (MCF-7) wykazano, że aktywność estrogenna 8-prenylonaryngeniny była 25 razy wyższa od aktywności izoflawonu – genisteiny (23). Podobnie, w eksperymentach na receptorze ERβ w drożdżach, 8-prenylonaryngenina charakteryzowała się silniejszą aktywnością estrogenową w porównaniu do 6-DMAN i genisteiny (24).
Estrogeny są odpowiedzialne za rozwój raka piersi (5). Hamowanie aromatazy i dehydrogenazy 17β-hydroksysteroidowej (17β-HSD) – enzymów uczestniczących w biosyntezie hormonów steroidowych, może zmniejszać ryzyko wystąpienia nowotworu (5). Naryngenina oraz 4-hydroksychalkon najsilniej spośród testowanych flawanonów (7-hydroksyflawanon, eriodykcjol, hesperetyna) i chalkonów (2´-hydroksychalkon, 4´-hydroksychalkon, 2´,4´-dihydroksychalkon, 2´,4-dihydroksychalkon, 2´-hydroksy-4´-metoksychalkon, pinostrobina, izolikwirytygenina, chalkon naryngeniny, floretyna, chalkon eriodykcjolu, chalkon hesperetyny) hamowały aktywność aromatazy i dehydrogenazy 17b-hydroksysteroidowej (17b-HSD) (5). Wykazano, że naryngenina, w stężeniu 50 mM hamuje aktywność aromatazy w ponad 90%, natomiast dehydrogenazy 17b-hydroksysteroidowej w 76,5% (5).
8-Prenylonaryngeninę, 6-DMAN i naryngeninę badano pod kątem aktywności antyandrogennej w modelu receptora androgenowego w komórkach drożdży i analizę specyficznego antygenu prostaty (PSA = prostate specific antigen) (11). 6-DMAN i 8-PN hamowały aktywność dihydrotestosteronu, natomiast naryngenina nie wykazała aktywności antyandrogennej. 6-DMAN hamowała powstawanie PSA, jakkolwiek związek okazał się mniej aktywny od bikalutamidu – antyandrogenu stosowanego w leczeniu raka prostaty. Eksperyment wykazał, że efekt antyandrogenny związków jest niezależny od aktywności estrogenowej (11).
Wpływ flawanonów na receptory estrogenowe oraz ich aktywność pro- i antynowotworowa nie zostały jeszcze dokładnie zbadane i są one w ostatnich latach obiektem szczególnego zainteresowania naukowców.
Naryngenina wykazuje działanie antyproliferacyjne wobec szeregu linii ludzkich nowotworów m.in. MCF-7. W jego mechanizmie wymienia się m.in. stymulację aktywacji p38/MAPK prowadzącą do aktywacji proapoptotycznej kaspazy 3 (8), hamowanie stymulowanego insuliną wychwytu glukozy (o około 25%) (8). Należy podkreślić, że hamowanie wychwytu glukozy występuje w stężeniach naryngeniny osiąganych w warunkach fizjologicznych – 10 μM, co wskazuje na potencjalne znaczenie terapeutyczne związku (8).
Aktywność przeciwnowotworową naryngeniny oceniano w modelu chemicznie indukowanego 7,12-dimetylobenz(a)antracenem (DMBA) raka piersi u szczurów (7). W eksperymencie jednej grupie szczurów podawano sok grejpfrutowy, a drugiej naryngeninę w stężeniu porównywalnym do zawartego w soku z grejpfruta. W obu przypadkach odnotowano spowolnienie rozwoju zmian nowotworowych.
Działanie obniżające poziom cholesterolu oraz przeciwmiażdżycowe
Naryngenina silniej obniża poziom cholesterolu całkowitego oraz słabiej poziom frakcji HDL (High-Density Lipoprotein) w porównaniu z rutyną i kwasem nikotynowym, stosowanym jako lek przeciwmiażdżycowy (14). Obserwowano w badaniach na królikach z dietą bogatą w cholesterol, że podawanie naryngeniny powoduje spadek poziomu LDL (Low Density Lipoprotein) w osoczu i cholesterolu w wątrobie (3). W przypadku TAG (triacyloglicerole), naryngenina obniża ich poziom porównywalnie z kwasem nikotynowym (14). W warunkach in vitro z użyciem testu TBARS wykazano, że naryngenina w stężeniu 25 μM wywiera efekt proutleniający w oksydacji LDL w środowisku siarczanu miedzi. Natomiast jej prenylowe pochodne (6-PN i 8-PN), obecne w chmielu i piwie, ujawniły właściwości antyoksydacyjne.
Nadprodukcja w wątrobie apolipoprotein (apoB-Lp) stanowi podłoże szeregu hiperlipoproteinemii, włączając hiperlipidemię oraz hipercholesterolemię, prowadząc w rezultacie do zmian miażdżycowych w obrębie naczyń obwodowych i mózgowych. Naryngenina w stężeniu 200 μM zmniejsza wydzielanie o około 52% apolipoproteiny (apoB) i selektywnie zwiększa jej degradację w hepatocytach (12). Badania przeprowadzone na linii komórek nowotworu wątroby HepG2 wykazały, że hamowanie wydzielania apoB jest spowodowane zmniejszeniem gromadzenia triglicerydów w siateczce endoplazmatycznej w wyniku inhibicji MTP (białko transportujące mikrosomalne triglicerydy) (12). Ponadto naryngenina hamuje syntezę estrów cholesterolu poprzez inhibicję ekspresji i aktywności acylotransferazy cholesterolu (ACAT), enzymu katalizującego jego estryfikację (3).
Naryngenina wykazuje również działanie antyagregacyjne w wyniku hamowania fosfodiesterazy cyklicznych nukleotydów w płytkach krwi, dzięki czemu zapobiega miażdżycy.
Jedną z przyczyn hipercholesterolemii jest brak równowagi pomiędzy produkcją wolnych rodników a działaniem mechanizmów ochronnych (13). Zarówno erytrocyty jak i wątroba mają enzymy o właściwościach antyoksydacyjnych, są to katalaza i dysmutaza nadtlenkowa. Katalaza jest jednym z najważniejszych enzymów uczestniczących w przemianach H2O2, który chroni erytrocyty przed reaktywnymi związkami tlenu. Enzymem o podobnym działaniu jest paraoksonaza osoczowa, związana z HDL, hydrolizująca nadtlenki lipidów. Inne enzymy, jak glutation (GSH) chronią komórki przed toksycznymi związkami chemicznymi pochodzenia egzo- i endogennego.
Przeciwmiażdżycowe właściwości naryngeniny i jej eteru 7-O-acetylowego badano na szczurach karmionych przez 6 tygodni pożywieniem wzbogaconym w cholesterol obserwując zmiany aktywności enzymów: katalazy i dysmutazy nadtlenkowej, paraoksonazy osoczowej i peroksydazy glutationu (13). Naryngenina, a także w większym stopniu jej eter, hamowały w wątrobie oraz zwiększały w erytrocytach aktywność katalazy i dysmutazy nadtlenkowej, powodując obniżenie poziomu anionów nadtlenkowych. Odnotowano podwyższoną aktywność paraoksonazy osoczowej w stosunku do grupy kontrolnej. Obydwa związki obniżały aktywność peroksydazy glutationu, zwiększając poziom glutationu w wątrobie. Naryngenina i jej eterowa pochodna znacząco zmniejszały poziom produktów peroksydacji lipidów w osoczu. Hamowanie utleniania lipidów blokuje powstawanie komórek piankowatych, dzięki czemu spada ryzyko wystąpienia miażdżycy.
Działanie wazorelaksacyjne i przeciwskurczowe
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Iwashina T.: The structure and distribution of the flavonoids in plants. J. Plant Res. 2000, 113, 287. 2. Tomas-Barberan F.A., Clifford M.N.: Flavanones, chalcones and dihydrochalcones – nature, occurence and dietary burden. J. Sci. Food Agric. 2000, 80, 1073. 3. Erlund I.: Review of the flavonoids quercetin, hesperetin, and naringenin. Dietary sources, bioactivities, bioavailability and epidemiology. Nutr. Res. 2004, 24, 851. 4. Cos P. et al: Phytoestrogens: Recent developments. Planta Med. 2003, 69, 589. 5. Le Bail J.C. et al: Chalcones are potent inhibitors of aromatase and 17b-hydroxysteroid dehydrogenase activities. Life Sci. 2001, 68, 751. 6. Miksicek R.J.: Commonly occuring plant flavonoids have estrogenic activity. Mol. Pharmacol. 1993, 44, 37. 7. So F.V. et al: Inhibition of human breast cancer cell proliferation and delay of mammary tumorigenesis by flavonoids and citrus juices. Nutr. Cancer 1996, 26, 167. 8. Totta P. et al: Mechanisms of naringenin-induced apoptotic cascade in cancer cells: Involvement of estrogen receptor a and b signalling. IUBMB Life 2004, 56, 491. 9. Zierau O. et al: Estrogenic activity of the phytoestrogens naringenin, 6-(1,1-Dimethylallyl)naringenin and 8-Prenylnaringenin. Planta Med. 2002, 68, 449. 10. Zierau O. et al: Naringenin-type flavonoids show different estrogenic effects in mammalian and teleost test systems. Biochem. Biophys. Res. Commun. 2005, 326, 909. 11. Zierau O. et al: Antiandrogenic activity of the phytoestrogens naringenin, 6-(1,1-Dimethylallyl)naringenin and 8-Prenylnaringenin. Planta Med. 2003, 69, 856. 12. Borradaile N.M. et al: Inhibition of hepatocyte apoB secretion by naringenin: Enhanced rapid intracellular degradation independent of reduced microsomal cholesteryl esters. J. Lipid Res. 2002, 43, 1544. 13. Lee M.K. et al: Supplementation of naringenin and its synthetic derivative alters antioxidant enzyme activities of erythrocyte and liver in high cholesterol-fed rats. Bioorg. Med. Chem. 2002, 10, 2239. 14. Santos K.F.R. et al: Hypolipidaemic effects of naringenin, rutin, nicotinic acid and their associations. Pharmacol. Res. 1999, 40, 493. 15. Bae E.A., Han M.J., Kim D.H.: In vitro anti- Helicobacter pylori activity of some flavonoids and their metabolites. Planta Med. 1999, 65, 442. 16. Martin M.J., Motilva V., De la Lastra A.: Quercetin and naringenin: effects on ulcer formation and gastric secretion in rats. Phytother. Res. 1993, 7, 150. 17. Shin J.E. et al: In vitro inhibitory effect of flavonoids on growth, infection and vacuolation of Helicobacter pylori. Planta Med. 2005, 71, 197. 18. Hammad H.M., Shtaywy A.H.: Pharmacological effects of selected flavonoids on rat isolated ileum: Structure – activity relationship. Gen. Pharmac. 1997, 28, 767. 19. Orallo F. et al: Implication of cyclic nucleotide phosphodiesterase inhibition in the vasorelaxant activity of the citrus-fruits flavonoid (±)-naringenin. Planta Med. 2005, 71, 99. 20. Bonina F. et al: Flavonoids as potential protective agents against photo-oxidative skin damage. Int. J. Pharm. 1996, 145, 87. 21. Saija A. et al: Influence of different penetration enhancers on in vitro skin permeation and in vivo photoprotective effect of flavonoids. Int. J. Pharm. 1998, 175, 85. 22. Miligan S. R. et al: The endocrine activities of 8-prenylnaringenin and related hop ( Humulus lupulus L.) flavonoids. J. Clin. Endocr. Metab. 2000, 85, 4912. 23. Kitaoka M. et al: Prenylflavonoids: A new class of non-steroidal phytoestrogen (Part 1). Isolation of 8-isopentenylnaringenin and an initial study on its structure – activity relationship. Planta Med. 2002, 68, 449. 24. Miligan S. R. et al: Identification of a potent phytoestrogen in hops ( Humulus lupulus L.) and beer. J. Clin. Endocr. Metab. 1999, 83, 2249. 25. Saija A. et al: Flavonoids as antioxidant agents: importance of their interaction with biomembranes. Free Radic. Biol. Med. 1995, 19, 481. 26. Mira L. et al: Interactions of flavonoids with iron and copper ions: A mechanism for their antioxidant activity. Free Radic. Res. 2002, 36, 1199. 27. Edwards D.J., Bernier S.M.: Naringin and naringenin are not the primary CYP3A inhibitors in grapefruit juice. Life Sci. 1996, 59, 1025. 28. Ho P.C. et al: Content of CYP3A4 inhibitors, naringin, naringenin and bergapten in grapefruit and grapefruit juice products. Pharm. Acta Helv. 2000, 74, 379. 29. Heo H.J. et al: Effect of antioxidant flavanone, naringenin, from Citrus junos on neuroprotection. J. Agric. Food Chem. 2004, 52, 1520. 30. Chiou G.C.Y., Xu X.-R.: Effects of some natural flavonoids on retinal function recovery after ischemic insult in the rat. J. Ocul. Pharmacol. Ther. 2004, 20, 107. 31. Park Y.H., Chiou G.C.Y.: Structure-activity relationship (SAR) between some natural flavonoids and ocular blood flow in the rabbit. J. Ocul. Pharmacol.Ther. 2004, 20, 35.




