© Borgis - Postępy Fitoterapii 4/2006, s. 170-182
*Tadeusz Wolski, Wanda Zwolan, Tomasz Baj, Anna Lewandowska1
Rzepień pospolity ( Xanthium strumarium L.) – analiza fitochemiczna steroli i triterpenów
Rough cocklebur (Xanthium Strumarium L.) – fitochemical analysis of sterols and triterpenes
1Katedra i Zakład Farmakognozji z Pracownią Roślin Leczniczych, AM Lublin
Kierownik Katedry i Zakładu: prof. dr hab. Kazimierz Głowniak
Summary
The present work relates to analysis of composition of sterols and triterpenes fraction. It is a continuation of fitochemical research considering this unknown medicinal plant. There is presented depicted data about sterols and triterpenes, their structure, properties and medicinal use.
In experimantal part of the paper, there is presented analysis of precentage content of sterols and triterpenes. Moreover there is described analysis of their qualitative and quantitative composition. For the first time the determination of precentage content of the sum of sterols and triterpenes was carried. Also there was carried qualitative and quantitative analysis using GC/MS furthemore the ability of physical and chemical factors (ultrasound and temperature) on procedures of extraction and isomerisation was showed. In the investigated extracts the main componet of sterol fraction was β-sitosterol, and of triterpene fraction was lupeol.

Prezentowana praca jest kontynuacją systematycznych badań fitochemicznych nad mało znanym surowcem zielarskim, jakim jest rzepień pospolity ( Xanthium strumarium L.). Pierwsza część tych badań dotyczyła omówienia właściwości biologicznych rzepienia i jego przetworów oraz ich zastosowania, a także analizy fitochemicznej związków fenolowych (1). Kolejną, ważną grupą związków występujących w rzepieniu są sterole i triterpeny, w dostępnej literaturze brak jest szczegółowych informacji na ten temat. Badania nad tą grupą związków są fragmentaryczne i dotyczą one niezmydlającej części tłuszczów występujących w korzeniu, określonych jako frakcja steroidowa (2, 3). Ponadto Khafagy i wsp. (4, 5) opisali obecność β-sitosterolu, fukosterolu i sterolu o wzorze sumarycznym C28H48O2. We frakcji triterpenowej wykryli oni dwa alkohole triterpenowe o wzorach sumarycznych: C30H50O2 oraz C39H50O5.
Zarówno interesujący skład chemiczny rzepienia pospolitego, jak i jego przetworów oraz właściwości i możliwości zastosowania surowca w lecznictwie, skłoniły nas do podjęcia systematycznych badań nad składem ważnej grupy związków farmakologicznie czynnych, jakimi są sterole i triterpeny (6).
Sterole – budowa, właściwości i zastosowanie
Fitosterole to związki o budowie sterolu (1,2-cyklopentanoperhydrofenantrenu) występujące w roślinach, otrzymywane z niezmydlających się frakcji tłuszczu roślinnego. Są to związki tetracykliczne, o różnym stopniu nasycenia łańcucha podstawowego oraz różnej liczbie i charakterze podstawników bocznych. Sterole charakteryzują się obecnością grupy hydroksylowej przy węglu C-3 w pozycji β, grup metylenowych przy węglach C-10 i C-13 oraz łańcucha alifatycznego przy węglu C-17 w pozycji β (7-10).
Prekursorem w syntezie steroli u roślin jest skwalen. Biosynteza rozpoczyna się od aktywnego octanu i prowadzi przez kwas mewalonowy, pirofosforan farnezylu, fosforan preskwalenu, skwalen, cykloartenol, 31-norlanosterol do cholesterolu lub kampesterolu (11). Naturalnie występujące sterole są pochodnymi układów węglowodorowych: cholestanu, ergostanu i stigmastanu. Sterole występują zarówno w stanie wolnym, jak i związanym – w postaci estrów i glikozydów. Szczególnie rozpowszechnione w świecie roślin wyższych są sitosterole (głównie β-sitosterol, mniej częste są α- i γ-sitosterole). β-Sitosterol występuje w nasionach kiełkujących zbóż. Wykazuje działanie przeciwzapalne, przeciwgorączkowe, obniża poziom cholesterolu we krwi. Może służyć jako produkt wyjściowy do półsyntezy hormonów steroidowych. Rzadziej spotyka się stigmasterol, występujący m.in. w dużych ilościach w nasionach soi i fasoli indyjskiej. Odgrywa on pewną rolę w metabolizmie fosforanów. Może służyć, podobnie jak β-sitosterol, jako produkt wyjściowy do częściowej syntezy hormonów steroidowych. Pochodne lanosterolu spotykane są głównie u roślin niższych. Ergosterol występuje w wielu grzybach, np. Saccharomyces cerevisiae oraz w sporyszu (buławince purpurowej). Służy do otrzymywania witaminy D2 (7-9).
Fitosterole po podaniu doustnym lub pozajelitowym ulegają fosforylacji. Szybko wchłaniają się z jelit do krwi i limfy. Witaminy D i A oraz tłuszcze nienasycone zwiększają przyswajanie steroli roślinnych (10). Sterole roślinne wykazują różnorodne właściwości farmakologiczne, w zależności od liczby i charakteru podstawników bocznych, szczególnie przy węglu C-17. Fitosterole są prekursorami syntezy hormonów steroidowych, w tym estrogenów i testosteronu. W normalnych warunkach pobudzają syntezę białek, wzrost i mineralizację kości oraz rozwój mięśni. W ustroju regulują także stosunek ilościowy między estrogenami i androgenami w razie nieprawidłowości, nie zmniejszając przy tym efektu anabolicznego, bowiem wpływ tych hormonów na przemiany aminokwasów, tłuszczów i białek pozostaje ten sam (10, 12, 13).
Aktywność przeciwcholesterolowa fitosteroli jest dobrze udokumentowana w literaturze. Obecnie wiadomo, że 4-demetylosterole lub stanole w formie wolnej lub zestryfikowanej obniżają we krwi stężenie frakcji LDL cholesterolu i β-lipoprotein, działając konkurencyjnie w stosunku do nich (10, 13-15), natomiast zwiększają stężenie α-lipoprotein i zmniejszają stężenie cholesterolu całkowitego we krwi. Ponadto mechanizm działania fitosteroli polega prawdopodobnie na hamowaniu absorpcji cholesterolu w jelitach. β-Sitosterol tworzy w żołądku trudno rozpuszczalne połączenia z cholesterolem, które słabo wchłaniają się w świetle jelit (16-21).
W badaniach in vitro i in vivo wykazano, że fitosterole wywierają wpływ przeciwzakrzepowy i przeciwmiażdżycowy. Mają one zdolność do hamowania hiperproliferacji komórek mięśni gładkich naczyń krwionośnych, zapobiegając rozwojowi blaszki miażdżycowej (21, 22). Wywierają wpływ ochronny na krwinki czerwone, zmniejszając ich zdolność do hemolizy oraz agregacji. Ponadto zmniejszają krzepliwość krwi przez obniżanie stężenia fibrynogenu (23). Fitosterole rozszerzają również naczynia krwionośne, usprawniając krążenie i zwiększając przepuszczalność ścian naczyń krwionośnych. W badaniach na zwierzętach wykazano, że systematyczne przyjmowanie sitostanolu hamowało rozwój blaszek miażdżycowych w naczyniach wieńcowych (24).
Sterole roślinne hamują odczyny alergiczne i autoimmunologiczne, powstrzymując procesy autoagresji, a przez zmniejszenie liczby limfocytów we krwi, hamują także rozwój tkanek limfocytotwórczych. Znoszą one działanie histaminy i hormonów grasicy. Unieczynniają hialuronidazę, zmniejszając w ten sposób przepuszczalność ścian naczyń. Fitosterole zmniejszają produkcję TNF-α, interleukiny-6 i monocytów. Powoduje to odizolowanie ogniska zapalnego od sąsiednich tkanek i zahamowanie jego poszerzania się. Wpływają także na reakcję alergenu z przeciwciałem, co hamuje odczyn alergiczny. Równocześnie działają stymulująco i stabilizująco na układ odpornościowy (10, 21, 25-27).
Szeroko opisywana jest także aktywność przeciwnowotworowa fitosteroli (28). β-Sitosterol w badaniach in vitro i in vivo wykazuje znaczące działanie hamujące proliferację nowotworowych linii komórkowych, m.in. raka okrężnicy i odbytnicy, raka żołądka, raka piersi, raka płuc, raka przełyku, raka endometrium, raka jajników (29-33). Mechanizm działania opiera się na ograniczeniu syntezy cholesterolu oraz hamowaniu aktywności fosfatazy białkowej 2A i fosfolipazy D – enzymów niezbędnych w syntezie sfingomielin i prawidłowym wykształcaniu błon komórkowych (34). Sterole roślinne stosowane są również w łagodnym przeroście prostaty. β-Sitosterol w postaci wolnej zwiększa sekrecję gruczołu krokowego, normalizuje skład jego wydzieliny i wpływa regenerująco na komórki nabłonka, zapobiegając hiperplazmii. Ponadto łagodzi objawy ze strony układu moczowego (10, 34).
Kolejnym ważnym działaniem, jakie wywierają fitosterole, jest wpływ antyoksydacyjny. Metanolowy ekstrakt z nasion soi, który zawiera sitosterole, tokoferol oraz wielonienasycone kwasy tłuszczowe, wykazuje w badaniach in vitro silne działanie protekcyjne w stosunku do DNA komórek śródbłonka. Ponadto w warunkach in vitro β-sitosterol oraz jego glukozyd hamują peroksydację lipidów w błonach płytek krwi oraz oksydację frakcji LDL cholesterolu. Powyżej przedstawione działanie antyoksydacyjne może mieć także korzystny wpływ w zapobieganiu miażdżycy i chorób nowotworowych (35-37).
W Indiach opisano działanie przeciwwrzodowe fitosteroli występujących w roślinach z rodzaju Dolichos. Estry fitosteroli działają ochronnie w przypadku owrzodzenia odźwiernika, zaś wolne formy steroli działają ochronnie w przypadku ostrej choroby wrzodowej, natomiast fosfolipidy, obecne w rodzaju Dolichos,działają skutecznie w obu formach choroby wrzodowej. Z tego wynika, że obecność steroli, ich estrów oraz fosfolipidów w diecie, chroni przed występowaniem wrzodów trawiennych, natomiast nie wpływa na powstawanie tychże w wyniku działania Helicobacter pylori (38).
Triterpeny – budowa, właściwości i zastosowanie
Triterpeny, podobnie jak sterole, wywodzą się biogenetycznie z izoprenu. Oprócz skwalenu, wszystkie mają budowę cykliczną. Mogą być zbudowane z czterech (tetracykliczne), lub częściej, z pięciu pierścieni (pentacykliczne). Związki te mają zwykle jedno wiązanie podwójne i drugorzędową grupę alkoholową. Różnią się natomiast rozmieszczeniem, liczbą i rodzajem tlenowych grup funkcyjnych. Najbardziej rozpowszechnione są kwasy triterpenowe, mniej alkohole i związki ketonowe (7-9).
W procesie biosyntezy powstają, w zależności od pofałdowania łańcucha w skwalenie lub 2,3-epoksyskwalenie, dwa podstawowe układy triterpenów: prostanu i damaranu. Układy te różnią się konfiguracją przy atomach C-8, C-14, C-17 i C-20 (9, 11).
Triterpeny są szeroko rozpowszechnione w świecie roślinnym. Spośród wolnych triterpenów szczególnie rozpowszechnione są α- i β-amyryna, kwas ursolowy, kwas oleanolowy i betulina. Związki te spotyka się w żywicach, sokach mlecznych, a także w tkankach okrywających (9).
Związki triterpenowe mają szeroki wachlarz właściwości farmakologicznych. Głównymi kierunkami działań tej grupy związków są: aktywność przeciwzapalna, przeciwnowotworowa i przeciwwirusowa.
W ostatnim okresie wiele ośrodków naukowych skoncentrowało badania nad aktywnością biologiczną związków triterpenowych. Szczególną uwagę poświęcono badaniom aktywności przeciwzapalnej. W wyniku przeprowadzonych doświadczeń z wykorzystaniem różnych modeli farmakologicznych, stwierdzono istotną aktywność przeciwzapalną lupeolu, betuliny, kwasu betulinowego, kwasu ursolowego oraz ich form glikozydowych. Związki te mają zdolność do redukcji wysięku i hamowania ogólnej liczby leukocytów. Prawdopodobny mechanizm działania opiera się na hamowaniu migracji komórek do miejsc objętych stanem zapalnym, zmniejszaniu produkcji tlenku azotu przez makrofagi oraz zmniejszaniu syntezy czynników prozapalnych. Lupeol podany doustnie lub dootrzewnowo, w dawce 25-200 mg/kg, wykazuje efekt przeciwzapalny w ostrych i chronicznych stanach zapalnych u szczurów i myszy. Silną aktywność przeciwzapalną obserwowano na modelu chronicznego zapalenia stawów, w którym efekt działania był porównywalny z efektem doustnego podania kwasu acetylosalicylowego (ASA) w dawce 100 mg/kg (39-44).
Badania przeprowadzone na przestrzeni ostatnich lat dowodzą istotnej aktywności przeciwnowotworowej triterpenów. Kwas betulinowy selektywnie indukuje apoptozę komórek czerniaka skóry, nie wykazując cytotoksyczności w stosunku do zdrowych komórek. Wyjaśnienie molekularnego mechanizmu działania kwasu betulinowego znajduje się w fazie badań. Warto zauważyć, że kwas betulinowy pozbawiony jest cytotoksyczności w stosunku do zdrowych komórek (pH> lub = 7) nawet po 48 godzinach ekspozycji, natomiast wykazuje cytotoksyczność w warunkach panujących wewnątrz komórek nowotworowych (pH 1 do S (41, 45-48).
Jak podaje piśmiennictwo pochodne damaranu wykazują aktywność przeciwko wirusowi opryszczki typu I i II. Pochodne lupanu, takie jak kwas betulinowy oraz jego syntetyczne pochodne (aminoalkoholowe estry kwasu betulinowego), wydają się chronić, komórki systemu odpornościowego człowieka przed atakiem wirusa HIV. Hamują one replikację wirusa HIV w zainfekowanych limfocytach i chronią otaczające komórki przed rozprzestrzenianiem się HIV. Chociaż mechanizm ten nie jest całkowicie wyjaśniony, badacze uważają, że pochodne kwasu betulinowego blokują płaszcz proteinowy wirusa, uniemożliwiając wiązanie się z błoną zewnętrzną komórek gospodarza. Bez tego połączenia wirus nie ma możliwości reprodukcji. Związki te nie są jednak skuteczne przeciwko wszystkim liniom wirusa. Pochodne kwasu betulinowego wymagają dalszych badań klinicznych i laboratoryjnych w celu wyjaśnienia ich przeciwwirusowego działania i wyselekcjonowania najaktywniejszych związków z tej grupy (41, 49-51).
Zaobserwowano także aktywność przeciwbakteryjną triterpenów. Kwas fusydowy wyodrębniony z Fusidium coccineum oraz kwas betulinowy, stosowane są jako antybiotyki przeciwko bakteriom Gram-dodatnim. Octan lupeolu, dioctan betuliny i octan betuliny wykazują działanie przeciwko Mycobacterium tuberculosis (52, 53).
Triterpeny wykazują działanie hipolipemiczne i przeciwmiażdżycowe. Kwas glicyrytynowy obniża poziom cholesterolu i triglicerydów we krwi. Mechanizm jego działania polega na stymulacji katabolizmu kwasów tłuszczowych i produkcji ATP niezbędnego do procesów naprawczych. Pochodne oleanolowe o aktywności przeciwcholesterolowej hamują biosyntezę cholesterolu w wątrobie. Triterpeny pochodne lanostanu hamują konwertazę angiotensyny II i mogą mieć zastosowanie w leczeniu nadciśnienia (54-56).
Celem badań było otrzymanie ekstraktów frakcji steroli i triterpenów z organów nadziemnych i podziemnych rzepienia pospolitego ( Xanthium strumarium L.), oznaczenie ich procentowej zawartości, a także analiza składu tej grupy związków metodami chromatograficznymi.
Materiały i metody
Materiał do badań stanowiły części nadziemne i podziemne (ziele, owoce i korzenie) rzepienia pospolitego, pochodzące z uprawy w Ogrodzie Roślin Leczniczych Akademii Medycznej w Lublinie. Rośliny zebrano jesienią 2005 r., następnie suszono w cieniu, w miejscu przewiewnym, rozdrobniono i stosowano do przygotowania ekstraktów. Do izolacji steroli i triterpenów z rozdrobnionego materiału roślinnego zastosowano dwie metody ekstrakcji: ekstrakcję w aparacie Soxhleta oraz ekstrakcję wspomaganą ultradźwiękami na łaźni wodnej pod chłodnicą zwrotną w temp. 50 i 80°C.
Triterpeny i sterole jako związki hydrofobowe należą do frakcji lipidowej. Jako ekstrahenta użyto eteru naftowego. Otrzymany wyciąg następnie zagęszczono i poddano reakcji zmydlania przez ogrzewanie z alkoholowym roztworem 10% KOH pod chłodnicą zwrotną na wrzącej łaźni wodnej. Po ostudzeniu i rozdzieleniu frakcji, do dalszych badań użyto frakcję niezmydlającą się, którą poddano ekstrakcji eterem dietylowym (5 x 10 ml). Warstwa eterowa zawierała zarówno sterole, jak i triterpeny. W celu oddzielenia steroli od triterpenów wykorzystano reakcję z digitoniną, która dała trudno rozpuszczalne kompleksy ze sterolami. Otrzymany po odsączeniu digitonidów steroli przesącz zawierał triterpeny (57). Dla lepszego zobrazowania procedur ekstrakcyjnych, na rycinie 1 przedstawiono schemat wyodrębniania steroli i triterpenów z badanych surowców.
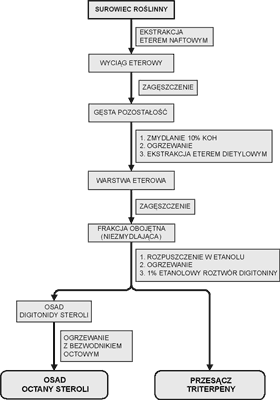
Ryc. 1. Schemat izolacji frakcji steroli i triterpenów.
Oznaczenie procentowej zawartości steroli wykonano metodą wagową, zaś oznaczenie sumy steroli i triterpenów wykonano metodą spektrofotometryczną według uprzednio opisanych procedur (57, 58). Zawartość procentową triterpenów obliczano z różnicy pomiędzy sumą steroli i triterpenów a zawartością samych steroli.
Do badań chromatograficznych TLC, LC i GC/MS stosowano roztwory metanolowe octanów steroli oraz roztwory etanolowe triterpenów. Badania chromatograficzne TLC prowadzono na płytkach pokrytych żelem krzemionkowym Si 60G oraz na płytkach HPTLC szklanych Si GF 254, w różnych układach chromatograficznych. Najkorzystniejszym był układ: benzen – octan etylu (102+18 v/v). Chromatogramy wizualizowano roztworem kwasu fosforowolframowego lub odczynnikiem Liebermanna-Burcharda.
W celu oczyszczenia i wstępnego rozdziału otrzymanych ekstraktów zastosowano chromatografię kolumnową (LC) na kolumnie szklanej o długości 50 cm i średnicy 4 cm, wypełnionej żelem krzemionkowym o średnicy ziaren 230-240 Mesh ASTM. Żel zawieszano w eterze naftowym, podobnie jak ekstrakty otrzymane z badanych surowców, a następnie dozowano na kolumnę i eulowano stosując po 100 ml eluentów o następujących składach: eter naftowy 100%; eter naftowy – benzen (2+1 v/v; 1+1 v/v;); benzen 100%; benzen – chloroform (9+1 v/v; 6+2 v/v;1+1 v/v; 2+6 v/v; 1+9 v/v) i chloroform 100%. Poszczególne eluaty z kolumny analizowano techniką TLC. Frakcje zawierające jednorodne związki łączono i ponownie badano metodą chromatografii cienkowarstwowej.
Wykonano również chromatografię preparatywną TLC stosując płytki pokryte żelem krzemionkowym Si 60G o grubości warstwy 0,75 mm. Na płytkę nanoszono pasmowo roztwór frakcji wyeluowanej z kolumny i rozwijano w układzie benzen – octan etylu (102+18 v/v). Po rozwinięciu i wysuszeniu część płytki wywoływano przez spryskanie odczynnikiem Liebermanna-Burcharda. Pasmo na wysokości barwnej plamy zeskrobywano do zlewki i ekstrahowano metanolem, a następnie przesączono przez twardy sączek. Klarowny przesącz pozostawiono do odparowania. Otrzymany w ten sposób osad sterolu oczyszczano przez 3-krotną krystalizację z metanolu, po czym mierzono temperaturę topnienia w aparacie Boethiusa oraz porównano wartości Rf z wzorcami. Analogiczne metody stosowano do analizy frakcji triterpenowej.
Wyizolowane frakcje steroli i triterpenów poddano analizie metodą chromatografii gazowej połączoną ze spektrometrią masową (GC/MS). Do badań wykorzystano chromatograf gazowy, (Thermo-Finnigan, USA), typ Trace GC ultra, sprzężony z detektorem masowym Trace DSQ. Chromatogram wyposażony był w dozownik PTV pracujący w trybie split i w kolumnę kapilarną Rtx o długości 20 m, średnicy 0,18 mm i grubości filmu fazy stacjonarnej 0,2 ?m. Analizę chromatograficzną GC prowadzono stosując program temperatury 200-240°C, przy czym wzrost temperatury następował co 4°C/min., zaś przepływ gazu nośnego (hel) wynosił 1 ml/min. Temperatura dozownika wynosiła 340°C, a energia jonizacji – 70eV. Analizę jakościową przeprowadzono na podstawie widm MS, porównując je z widmami biblioteki NIST/EPA/NIH (59) oraz z biblioteką terpenów – Libr (tr) dostarczoną przez Finningan MAT (60). Tożsamość związków potwierdzano indeksami retencji z danych literaturowych (61) oraz czasami retencji związków wzorcowych.
Wyniki i omówienie
W tabeli 1 zebrano wyniki oznaczenia zawartości procentowej steroli w badanych surowcach, w zależności od metody ekstrakcji. Dla lepszego zilustrowania wpływu metody ekstrakcji i rodzaju surowca na zawartość procentową steroli na rycinie 2 przedstawiono graficznie tę zależność.
Tabela 1. Zawartość procentowa steroli w badanych surowcach w zależności od metody ekstrakcji.
| Badany surowiec | Zawartość steroli xi (%) | Przedział ufności μ (%) | Liczba oznaczeń n | Odchylenie standardowe SD | Współczynnik zmienności RSD (%) |
| Ekstrakcja w aparacie Soxhleta |
| Ziele | 0,0382 | 0,0381?0,0003 | 3 | 0,00013 | 0,344 |
| 0,0382 |
| 0,0380 |
| Owoce | 0,1386 | 0,1386?0,0003 | 3 | 0,00012 | 0,092 |
| 0,1385 |
| 0,1387 |
| Korzenie | 0,0521 | 0,0520?0,0003 | 3 | 0,00012 | 0,247 |
| 0,0529 |
| 0,0521 |
| Ekstrakcja wspomagana ultradźwiękami w temp. 50°C |
| Ziele | 0,0366 | 0,0384?0,0037 | 3 | 0,00151 | 3,936 |
| 0,0386 |
| 0,0392 |
| Owoce | 0,1529 | 0,1537?0,0037 | 3 | 0,00149 | 0,973 |
| 0,1592 |
| 0,1555 |
| Korzenie | 0,0594 | 0,0568?0,0064 | 3 | 0,00258 | 4,545 |
| 0,0542 |
| 0,0568 |
| Ekstrakcja wspomagana ultradźwiękami w temp. 80°C |
| Ziele | 0,0366 | 0,0375?0,0134 | 3 | 0,00151 | 4,028 |
| 0,0366 |
| 0,0392 |
| Owoce | 0,1036 | 0,1019?0,0134 | 3 | 0,00539 | 5,29 |
| 0,1062 |
| 0,0959 |
| Korzenie | 0,0516 | 0,0508?0,0037 | 3 | 0,00149 | 2,935 |
| 0,0516 |
| 0,0491 |
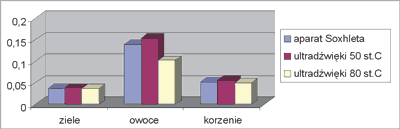
Ryc. 2. Porównanie zawartości procentowej steroli w badanych surowcach w zależności od metody ekstrakcji.
Jak wynika z danych liczbowych (tab.1 oraz ryc. 2). Najwyższą zawartość procentową steroli wykazują owoce Xanthium strumarium L. Jest ona prawie dwukrotnie większa niż w korzeniu. Najniższa zawartość tych związków jest w zielu. Z tych danych wynika również, że najkorzystniejszą metodą ekstrakcji jest ekstrakcja wspomagana ultradźwiękami w temp. 50°C.
Stosując metodę spektrofotometryczną oznaczono sumę zawartości procentowej steroli i triterpenów w badanych surowcach. Odejmując od sumy steroli i triterpenów zawartość steroli otrzymano zawartość procentową triterpenów. Dane liczbowe obrazujące średnią procentową zawartość triterpenów podaje tabela 2, zaś rycina 3 przedstawia porównanie zawartości procentowej triterpenów w zależności od metody ekstrakcji.
Tabela 2. Zawartość procentowa triterpenów w badanych surowcach w zależności od metody ekstrakcji.
| Badany surowiec | Zawartość triterpenów xi (%) | Przedział ufności μ (%) | Liczba oznaczeń n | Odchylenie standardowe SD | Współczynnik zmienności RSD (%) |
| Ekstrakcja w aparacie Soxhleta |
| Ziele | 0,371 | 0,3420?0,0659 | 3 | 0,0252 | 7,3798 |
| 0,325 |
| 0,330 |
| Owoce | 0,0810 | 0,0810?0,0578 | 3 | 0,0225 | 27,7801 |
| 0,1040 |
| 0,1260 |
| Korzenie | 0,059 | 0,0547?0,0311 | 3 | 0,0121 | 22,1284 |
| 0,041 |
| 0,064 |
| Ekstrakcja wspomagana ultradźwiękami w temp. 50°C |
| Ziele | 0,271 | 0,2910?0,0761 | 3 | 0,0296 | 10,1709 |
| 0,277 |
| 0,325 |
| Owoce | 0,143 | 0,1517?0,0200 | 3 | 0,0078 | 5,1214 |
| 0,154 |
| 0,158 |
| Korzenie | 0,046 | 0,0480?0,0051 | 3 | 0,0020 | 4,1667 |
| 0,050 |
| 0,048 |
| Ekstrakcja wspomagana ultradźwiękami w temp. 80°C |
| Ziele | 0,302 | 0,2967?0,0129 | 3 | 0,0050 | 1,6966 |
| 0,292 |
| 0,296 |
| Owoce | 0,140 | 0,1370?0,0228 | 3 | 0,0089 | 6,4877 |
| 0,144 |
| 0,127 |
| Korzenie | 0,035 | 0,0340?0,0026 | 3 | 0,0010 | 2,9412 |
| 0,033 |
| 0,034 |
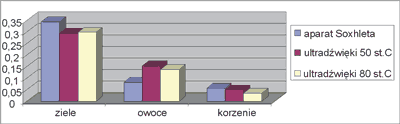
Rys. 3. Porównanie zawartości procentowej triterpenów w badanych surowcach w zależności od metody ekstrakcji.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Wolski T. i wsp.: Rzepień pospolity ( Xanthium strumarium L.) surowiec zielarski, o wielokierunkowym działaniu farmakologicznym – analiza fitochemiczna związków fenolowych. Post. Fitoter. 2006, 3, 118. 2. Mannan S.C. Ahmad K.: Preliminary study of sex hormone of medical importance in Bangladesh plants. Bangladesh Med. Res. Coun. Bull. 1978, 4, 78. 3. Kapoor V.K. i wsp.: Studies on the oil of Xanthium strumarium L. J. Am. Oil Chem. Soc. 1976, 53, 524. 4. Khafagy S.M. i wsp.: Phytochemical investigation of Xanthium strumarium.Planta Med. 1974, 26, 75. 5. Khafagy S.M., Metwally A.M.: Isolation of a crystalline sesquiterpenic keto-lactone from Xanthium occidentale.Planta Med. 1970, 18, 318. 6. Ziętek E.: Analiza steroli i triterpenów w częściach podziemnych i nadziemnych Xanthium strumarium L. Praca magisterska AM Lublin 2005. 7. Strzelecka H., Kowalski J.: Encyklopedia zielarstwa i ziołolecznictwa. PWN, Warszawa 2000, 645. 8. Otałęga Z. (red.): Encyklopedia biologiczna. OPRES, Kraków. 1999, t.10, 142, 414. 9. Kohlmünzer S.: Farmakognozja. Podręcznik dla studentów farmacji. PZWL, Warszawa 2000, 309, 341. 10. Różański H.: Naturalne substancje anaboliczne. http://luskiewnik.strefa.pl/fitosterole/sterole/pages/p6.htm. 11. Kączkowski J.: Biochemia roślin. T.1 PWN, Warszawa 1987. 12. Van den Heuvel M.R i wsp.: Assessment of the reproductive-endocrine disrupting potential of chlorine dioxide oxidation products of plant sterols. Environ. Sci. Technol. 2006, 40, 2594. 13. Krygier K.: Fitosterole – istotny czynnik obniżający poziom cholesterolu we krwi. Przem. Spoż. 2002, 56, 18. 14. Lees A.M. i wsp: Plant sterols as cholesterol-lowering agents: clinical trials in patients with hypercholesterolemia and studies of sterol balance. Atherosclerosis 1977, 28, 325. 15. Hendriks H.F. i wsp.: Spreads enriched with three different levels of vegetable oil sterols and the degree of cholesterol lowering in normocholesterolaemic and mildly hypercholesterolaemic subjects. Eur. J. Clin. Nutr. 1999, 53, 319. 16. Hamada T. i wsp.: Solubility in and affinity for the bile salt micelle of plant sterols are important determinants of their intestinal absorption in rats. Lipids 2006, 41, 551. 17. Ostlund R.E. i wsp.: Sitostanol administered in lecithin micelles potently reduces cholesterol absorption in humans. Am. J. Clin. Nutr. 1999, 70, 826. 18. Hallikainen M.A. i wsp.: Comparison of the effects of plant sterol ester and plant stanol ester-enriched margarines in lowering serum cholesterol concentrations in hypercholesterolaemic subjects on a low-fat diet. Eur. J. Clin. Nutr. 2000, 54, 715. 19. Thomsen A.B. i wsp.: Effect of free plant sterols in low-fat milk on serum lipid profile in hypercholesterolemic subjects. Eur. J. Clin. Nutr. 2004, 58, 860. 20. Plat J. i wsp.: Plant sterols and stanols: effects on mixed micellar composition and LXR (target gene) activation. J. Lipid. Res. 2005, 46, 2468. 21. Berger A. i wsp.: Plant sterols: factors affecting their efficacy and safety as functional food ingredients. Lipids Health Dis. 2004, 3, 5. 22. Devaraj S., Jialal I.: The role of dietary supplementation with plant sterols and stanols in the prevention of cardiovascular disease. Nutr. Rev. 2006, 64, 348. 23. Moghadasian M.H. i wsp.: Proatherogenic and antiatherogenic effects of probucol and phytosterols in apolipoprotein E-deficient mice: possible mechanisms of action. Circulation 1999, 99, 1733. 24. Ntanios F.Y. i wsp.: Dietary sitostanol reduces plaque formation but not lecithin cholesterol acyl transferase activity in rabbits. Atherosclerosis 1998, 138, 101. 25. Business Wire. http://www.businesswire.com/cgi-bin/photo.cgi?pw.020502/bb9. 26. Bouic P.J.: The role of phytosterols and phytosterolins in immune modulation: a review of the past 10 years. Curr. Opin. Clin. Nutr. Metab. Care 2001, 4, 471. 27. Bouic P.J. i wsp.: Plant sterol/sterolin supplement use in a cohort of South African HIV-infected patients – effects on immunological and virological surrogate markers. S. Afr. Med. J. 2001, 91, 848. 28. Awad A.B., Fink C.S.: Phytosterols as anticancer dietary components: evidence and mechanism of action. J. Nutr. 2000, 130, 2127. 29. Awad A.B. i wsp.: Dietary phytosterol inhibits the growth and metastasis of MDA-MB-231 human breast cancer cells grown in SCID mice. Anticancer Res. 2000, 20, 821. 30. Normén A.L. i wsp.: Plant sterol intakes and colorectal cancer risk in the Netherlands Cohort Study on Diet and Cancer. Am. J. Clin. Nutr. 2001, 74, 141. 31. Mendilaharsu M. i wsp.: Phytosterols and risk of lung cancer: A case-control study in Uruguay. Lung Cancer 1998, 21, 37. 32. De Stefani E. i wsp.: Vegetables, fruits, related dietary antioxidants, and risk of squamous cell carcinoma of the esophagus: A case-control study in Uruguay. Nutr. Cancer 2000, 38, 23. 33. McCann S.E. i wsp.: Diet in the epidemiology of endometrial cancer in western New York (United States). Cancer Causes Control 2000, 11, 965. 34. Awad A.B. i wsp.: Effect of β-sitosterol, a plant sterol, on growth, protein phosphatase 2A, and phospholipase D in LNCaP cells. Nutr. Cancer. 2000, 36, 74. 35. Wang T. i wsp.: Antioxidant activity of phytosterols, oryzanol, and other phytosterol conjugates. J. Am. Oil. Chem. Soc. 2002, 79, 1201. 36. Van Rensburg S.J. i wsp.: A comparative study of the effects of cholesterol, β-sitosterol, β-sitosterol glucoside, dehydroepiandrosterone sulphate and melatonin on in vitro lipid peroxidation. Metab. Brain. Dis. 2000, 15, 257. 37. Loscalzo J: Oxidant stress: A key determinant of atherothrombosis. Biochem. Soc. Trans. 2003, 31, 1059. 38. Paul Jayaraj A. i wsp.: Duodenal ulcer prevalence: Research into the nature of possible protective dietary lipids. Phytother. Res. 2003, 17, 391. 39. Della Loggia R. i wsp.: The role of triterpenoids in the topical anti-inflamatory activity of Calendula officinalis flowers. Planta Med. 1994, 60, 516. 40. De Miranda A.L. i wsp.: Anti-inflammatory and analgesic activities of the latex containing triterpenes from Himatanthus sucuuba. Planta Med. 2000, 66, 284. 41. Mahato S.B. i wsp.: Triterpenoids. Phytochemistry 1992, 31, 2199. 42. Recio M.C. i wsp.: Investigation on the steroidal anti-inflamatory activity of triterpenoids from Diospyros leucomelas. Planta Med. 1995, 61, 9. 43. Recio M.C. i wsp.: Structural requirement for the anti-inflammatory activity of antural triterpenoids. Planta Med. 1995, 61, 182. 44. Ryo S.Y. i wsp.: Anti-allergic and anti-inflammatory triterpenoids from the herb of Prunella vulgaris. Planta Med. 2000, 66, 358. 45. Fulda S. i wsp.: Betulinic acid: A new cytotoxic agent against malignant brain-tumor cells. Int. J. Cancer. 1999, 82, 435. 46. Fulda S. i wsp.: Betulinic acid triggers CD95 (APO-1/Fas)- and p53-independent apoptosis via activation of caspases in neuroectodermal tumors. Cancer Res. 1997, 57, 4956. 47. Hostanska K. i wsp.: Evaluation of cell death caused by triterpene glycosides and phenolic substances from Cimicifuga racemosa extract in human MCF-7 breast cancer cells. Biol. Pharm. Bull. 2004, 27, 1970. 48. Cioffi G. i wsp.: Antiproliferative triterpene saponins from Entada africana. J. Nat. Prod. 2006, 69, 1323. 49. Kashiwada Y. i wsp.: 3-O-Glutaryl-dihydrobetulin and related monoacyl derivatives as potent anti-HIV agents. Bioorg. Med. Chem. Lett. 2004, 14, 5851. 50. Kashiwada Y. i wsp.: Anti-AIDS agents. 30. Anti-HIV activity of oleanolic acid, pomolic acid, and structurally related triterpenoids. J. Nat. Prod. 1998, 61, 1090. 51. Fujioka T. i wsp.: Anti-AIDS agents. 11. Betulinic acid and platanic acid as anti-HIV principles from Syzigium claviflorum, and the anti-HIV activity of structurally related triterpenoids. J. Nat. Prod. 1994, 57, 243. 52. Konig G.M. i wsp.: Assessment of anti-micobacterial activity of a series of mainly marine derived natural products. Planta Med. 2000, 66, 337. 53. Schuhly W. i wsp.: New triterpenoids with anti-bacterial activity from Zizyphus joazeiro. Planta Med. 1999, 65, 740. 54. Sudhahar V. i wsp.: Role of lupeol and lupeol linoleate on lipemic-oxidative stress in experimental hypercholesterolemia. Life Sci. 2006, 78, 1329. 55. Yoshikawa M. i wsp.: Floratheasaponins A-C, acylated oleanane-type triterpene oligoglycosides with anti-hyperlipidemic activities from flowers of the tea plant ( Camellia sinensis). J. Nat. Prod. 2005, 68, 1360. 56. Chen H.W. i wsp.: Effect of alisol B acetate, a plant triterpene, on apoptosis in vascular smooth muscle cells and lymphocytes. Eur. J. Pharmacology 2001, 419, 127. 57. Jerzmanowska Z.: Substancje roślinne – metody wyodrębniania. PWN, Warszawa 1970. 58. Ostrowski W., Filipowicz B.: Ćwiczenia z chemii ogólnej i fizjologicznej. PWRiL, Warszawa 1954. 59. NIST/EPA/NIH: Mas Spectral Library. USA 2002. 60. Finningan MAT. Terpene Library, Finningan: Electronic database. USA 1990. 61. Joulain D., König W.A.: The atlas of spectral data of sesquiterpene hydrocarbons. E.B. Verlag. Hamburg 1998. 62. Kołodziejczyk A. Naturalne związki organiczne. PWN, Warszawa 2003, 427. 63. Kopcewicz J., Lewak S. (red): Fizjologia roślin. PWN, Warszawa 2005, 369.



