© Borgis - Postępy Nauk Medycznych 10/2007, s. 386-394
Małgorzata Sacewicz1, Agnieszka Siejka2, Hanna Ławnicka1, Tomasz Stępień3, Jan Komorowski2, *Henryk Stępień1
Działanie biologiczne somatoliberyny (ghrh) i analogów tego neurohormonu: spojrzenie w przyszłość
Biological action of somatoliberin (ghrh) and its analogs: a look to the future
1Zakład Immunoendokrynologii
2Klinika Endokrynologii
3Klinika Chirurgii Endokrynologicznej i Ogólnej Katedry Endokrynologii Uniwersytetu Medycznego w Łodzi
Kierownik Katedry: prof. dr hab. med. Jan Komorowski
Streszczenie
Hormon uwalniający hormon wzrostu (GHRH, somatoliberyna) jest neuropeptydem podwzgórzowym, który pobudza syntezę i wydzielanie hormonu wzrostu (GH) przez przedni płat przysadki. GHRH i jego analogi stosowane są w diagnostyce chorób układu podwzgórzowo-przysadkowego i w leczeniu niskorosłości u dzieci. Nieliczne doniesienia sugerują, że hormon ten może być wykorzystany w terapii niedoboru GH u pacjentów z niedoczynnością przysadki, u osób w podeszłym wieku, a także w leczeniu zaburzeń snu.
W 1985 roku Roggerecht i wsp. zsyntetyzowali pierwszego antagonistę somatoliberyny o strukturze [Ac-Tyr1, D-Arg2]hGHRH(1-29). Opisany antagonista i kolejne analogi tego neurohormonu w warunkach in vitro i in vivo hamują wzrost ludzkich nowotworowych linii komórkowych, m.in. płuc, jajnika, jelita grubego, trzustki, nerki, kości, mózgu, prostaty, piersi. Ich działanie antyproliferacyjne związane jest z blokowaniem osi GHRH/GH/IGF-I (mechanizm pośredni), a także może być wynikiem bezpośredniego oddziaływania na komórki guza (wpływ auto/ parakrynny). Zlokalizowano receptor dla GHRH i jego czterech wariantów na wielu typach komórek nowotworowych. Przedstawione wyniki badań wskazują, że w przyszłości analogi GHRH mogą znaleźć zastosowanie w terapii niektórych nowotworów oraz nefropatii i retinopatii cukrzycowej.
Summary
The hormone that releases the growth hormone (GHRH, somatoliberin) is a hypothalamic hormone, which stimulates the synthesis and secretion of the growth hormone (GH) by the anterior lobe of the pituitary gland. GHRH and its analogues are applied in the diagnostics of the hypothalamus-pituitary system diseases and in the treatment of short stature in children. Rare reports suggest that this hormone and its synthetic agonists may be applied in the therapy of hyposomatotropism in patients with hypopituitarism, in elderly patients, and in the treatment of sleep disorders.
In 1985 Roggerecht et al. synthetised the first somatoliberin antagonist of the following structure: [Ac-Tyr1, D-Arg2]hGHRH(1-29). The described antagonist and the following analogues of this neurohormone inhibit both in vivo and in vitro the growth of human tumour cell lines: of lung, ovary, colon, pancreas, kidney, bone, brain, prostate, and breast cancer, among others. Their antiproliferative action is connected with blocking the GHRH/GH/IGF-I axis (an intermediate mechanism), and may also be the result of direct influence on tumour cells (auto/ paracrine influence). A receptor for GHRH and its four variants has been located on many types of tumour cells. The presented research results indicate that in the future the GHRH analogues may be applied in therapy of some tumours, as well as nephropathy and diabetic retinopathy.

Wstęp
Hormon uwalniający hormon wzrostu (GHRH; growth hormone-releasing hormone), znany również pod nazwą somatoliberyna, jest neuropeptydem podwzgórzowym, który odpowiada za sekrecję GH (hormon wzrostu) przez przedni płat przysadki (1). GHRH po raz pierwszy został wyizolowany w 1980 roku z guza trzustki u pacjenta z akromegalią, a dopiero w następnej kolejności z tkanki podwzgórza (2-5). Opisano dwie jego izoformy, o podobnej aktywności biologicznej, składające się z 40 i 44 aminokwasów (6). Aktywnym biologicznie jest N-końcowy fragment peptydu, składający się z 29 aminokwasów (1). GHRH powstaje z 107 lub108-aminokwasowego prekursora w wyniku degradacji postranslacyjnej (7-9). Wykazuje podobną strukturę chemiczną do m.in. VIP, sekretyny, PACAP, GIP, glukagonu (10). Gen dla somatoliberyny został zlokalizowany w obrębie 20 chromosomu i składa się z pięciu eksonów (8). Struktura chemiczna hormonu zbudowanego z 44 aminokwasów jest następująca (5):
Tyr-Ala-Asp-Ala-Ile-Phe-Thr-Asn-Ser-Tyr-Arg-Lys-Val-Leu-Gly-Gln-Leu-Ser-Ala-Arg-Lys-Leu-Leu-Gln-Asp-Ile-Met-Ser-Arg-Gln-Gln-Gly-Glu-Ser-Asn-Gln-Glu-Arg-Gly-Ala-Arg-Ala-Arg-Leu-NH2.
Poza podwzgórzem i przysadką somatoliberynę udało się zlokalizować w wielu ludzkich tkankach, m.in. w łożysku, jajniku, jądrze, trzustce, a także w komórkach nerki, prostaty, wątroby, płuc, sutka, grasicy i komórkach układu immunologicznego (11-15). Ekspresję mRNA dla GHRH stwierdzono w komórkach nowotworowych, np. trzustki, płuc, jelit, rakowiaka, żołądka, mózgu, prostaty, jajnika, sutka, trzonu macicy, węzłów chłonnych (12, 16-19). Znane jest także zjawisko ekotopowego wydzielania GHRH przez neuroendokrynne guzy przewodu pokarmowego (rakowiak, guzy trzustki), raka drobnokomórkowego płuc, guzy nadnercza i przysadki, pheochromocytoma (20).
Synteza GHRH ma miejsce w neuronach podwzgórzowych, zlokalizowanych w jądrze łukowatym i brzuszno-bocznym. Z ich aksonów, sięgających wyniosłości przyśrodkowej do przestrzeni okołonaczyniowej uwalniana jest somatoliberyna. Następnie siecią naczyń wrotnych dostaje się do części gruczołowej przysadki (21). Tutaj, łącząc się z receptorem (GHRH-R) na komórkach somatotropowych, pobudza syntezę i wydzielanie hormonu wzrostu (1).
Somatoliberyna, poza stymulacją wydzielania GH, jest odpowiedzialna za prawidłowy wzrost i różnicowanie się komórek somatotropowych przysadki (22). Wykazano, że jej niedobór, np. w wyniku mutacji receptora, prowadzi do hipoplazji przysadki i zmniejszenia sekrecji hormonu wzrostu (23). Poza tym GHRH wpływa na procesy snu i czuwania (24). Interleukina 1, która zwiększa ekspresję mRNA dla GHRH i GHRH-R w podwzgórzu, jest silnym stymulatorem snu (25, 26). Hormon ten może także oddziaływać modulująco na układ immunologiczny człowieka (13-15). Somatoliberynę i jej receptor zlokalizowano bowiem na niektórych komórkach układu odpornościowego, a także na splenocytach i tymocytach. Jednakże dokładna rola GHRH w regulacji procesów odpornościowych nie została poznana.
Ponadto GHRH uważany jest za jeden z kluczowych czynników biorących udział w onkogenezie. Na wielu typach komórek nowotworowych wykryto obecność receptora dla GHRH (12, 16), wykazano ekspresję mRNA dla tego neurohormonu w tkankach nowotworowych (12, 16-19). Udowodniono, że neuropeptyd ten w warunkach in vitro pobudza proliferację komórek raka płuc, jajnika, trzustki, jelita grubego, żołądka, glejaka wielopostaciowego (16, 27-29). Należy dodać, że zaobserwowano zwiększoną częstość zachorowań na raka jelita grubego u osób z akromegalią (30). GHRH reguluje także sekrecję innych potencjalnych czynników kancerogenezy: hormonu wzrostu i insulinopodobnych czynników wzrostowych.
GH wpływa na proliferację guza sutka (31). Wykazano, że po usunięciu przysadki u myszy z osteosarcoma i fibrosarcoma masa przerzutów do płuc uległa zmniejszeniu (32, 33). Natomiast IGF-I, łącząc się z receptorem IGF-IR, wpływa stymulująco na procesy proliferacji i różnicowania tkanek organizmu, bierze udział w procesie angiogenezy i ma działanie antyapoptyczne. Receptor dla IGF-I zlokalizowano na wielu typach komórek nowotworowych, a także zaobserwowano ektopowe wydzielanie tego czynnika przez różne guzy. IGF-II (insulinopodobny czynnik wzrostowy typu drugiego), którego synteza jest niezależna od GHRH, jest również syntetyzowany przez tkanki nowotworowe. Działanie fizjologiczne tego czynnika odbywa się poprzez aktywację receptorów dla IGF-I (34).
Regulacja wydzielania somatoliberyny zależna jest od osi GHRH/GH/IGF-I. Na zasadzie ujemnego sprzężenia zwrotnego zarówno GH, jak i IGF-I hamują produkcję i wydzielanie GHRH. Sekrecja somatoliberyny jest także zależna od wpływu mediatorów ośrodkowego układu nerwowego. Acetylocholina, dopamina i noradrenalina (przez receptory beta) ją nasila, a GABA (kwas gamma-aminomasłowy) i noradrenalina (przez receptory alfa) hamuje (35). Natomiast glikokortykosteroidy pobudzają ekspresję receptora dla GHRH (36). Należy wspomnieć także o somatostatynie, która szczególnie poprzez receptor SSTR2 hamuje wydzielanie hormonu wzrostu przez komórki somatotropowe przysadki i pośrednio wpływa na stężenie GHRH (37). Poza tym wzrost sekrecji GH powoduje hipoglikemia poinsulinowa, a jej zmniejszenie następuje pod wpływem glikokortykosteridów i IGF-I (35). Innym czynnikiem regulującym wydzielanie powyższych hormonów jest ghrelina, peptyd produkowany głównie przez komórki żołądka i dwunastnicy. Ghrelina hamuje wydzielanie somatostatyny, a także jest odpowiedzialna za wzrost stężenia w surowicy krwi GH (38).
Receptor dla somatoliberyny
GHRH-R należy do II klasy receptorów sprzężonych z białkami G, w skład której wchodzą także receptory dla VIP (wazoaktywny peptyd jelitowy), sekretyny, PACAP (przysadkowy polipeptyd aktywujący cyklazę adenylową), glukagonu, GLP-1 (glukagenopodobny peptyd-1), GLP-2 (glukagenopodobny peptyd-2), glukozozależnego peptydu insulinotropowego, GIP (żołądkowy peptyd hamujący) i PHM (peptyd histydynowo-metioninnowy) (10). Receptory dla powyższych peptydów wykazują znaczną homologię budowy, np. sekwencja aminokwasów receptora dla VIP i GHRH jest zgodna w 47%. Gen dla GHRH-R zlokalizowano w obrębie chromosomu 7p14-15 i składa się z 13 eksonów. Ekspresję receptora regulują liczne czynniki transkrypcyjne, m.in. Pit-1, NF-1, Brn-2, Oct-1, AP-1, CRE (czynnik zależny od cAMP). Ponadto glikokortykosteroidy i przypuszczalnie hormony tarczycy zwiększają ekspresję tego receptora, a estrogeny (estradiol) ją zmniejszają (39). Receptor dla somatoliberyny zbudowany jest z siedmiu śródbłonowych domen, zewnątrzkomórkowego, hydrofilnego odcinka wiążącego ligand i długiej domeny cytoplazmatycznej. Na powierzchni błony komórkowej powiązany jest z kompleksem białka G – białka regulatorowego składającego się z trzech podjednostek: alfa, beta i gamma (40). Przyłączenie ligandu do receptora skutkuje wymianą GDP (związanego z podjednostką alfa) na GTP, a następnie oderwaniem się kompleksu GTP-alfa od pozostałych podjednostek. Powstałe w ten sposób dwa kompleksy: GTP-alfa i beta-gamma oddziaływają na efektory, takie jak cyklaza adenylanowa oraz fosfolipaza C. Cyklaza adenylanowa katalizuje przekształcenie ATP w cAMP, który aktywuje kinazę białkową A (PKA), która z kolei jest odpowiedzialna za fosforylację i zmianę konfiguracji białek kanału wapniowego. Konsekwencją tego procesu jest napływ jonów wapnia do wnętrza komórki. Wzrost stężenia wewnątrzkomórkowych jonów wapnia prowadzi do pobudzenia sekrecji hormonu wzrostu z komórek somatotropowych przysadki. Inna droga (cAMP-niezależna) wiąże się z pobudzeniem przez kompleks białka G aktywności fosfolipazy C, co powoduje wzrost stężenia trójfosforanu inozytolu (IP3) i w konsekwencji zwiększenie koncentracji jonów wapnia w komórce (22, 41-43) (Ryc. 1).
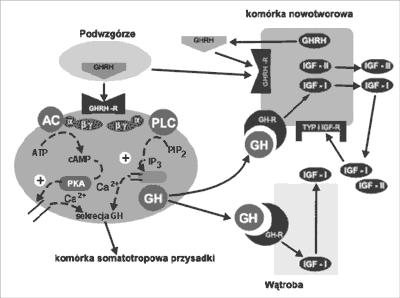
Ryc. 1. Hipotetyczny mechanizm działania GHRH i analogów tego neurohormonu na czynność wydzielniczą i procesy proliferacji komórkowej (44).
GHRH pobudza proliferację komórek najprawdopodobniej na drodze aktywacji szlaku białek Ras, Raf i MAPK, poprzez ich fosforylację. Kompleks kinaz białkowych MAPK ma udowodnione działanie mitogenne (45).
GHRH-R zlokalizowany jest głównie na komórkach somatotropowych przysadki i charakteryzuje się dużą swoistością wiązania z somatoliberyną, ale wykazano jego występowanie na komórkach innych tkanek, m.in. wątroby, płuca, nerki, prostaty, łożyska, sutka i jajnika (11, 12). Poza tym zaobserwowane w wielu pracach badawczych, hamujące działanie antagonistów GHRH na proliferację nowotworowych linii komórkowych in vitro, sugerujące miejscowy wpływ hamujący antagonistów na autokrynną produkcję GHRH (46), skłoniło do poszukiwań receptorów zlokalizowanych na komórkach nowotworowych. Kolejne projekty badawcze nie potwierdzały jednak powyższych założeń (47). Biorąc pod uwagę homologię budowy receptorów dla VIP (VPAC-R) i GHRH, fakt, że GHRH łączy się z VPAC-R, a także że receptory dla VIP i GHRH są zlokalizowane w błonie komórkowej różnych typów komórek nowotworowych, sugerowano wpływ GHRH na proliferację guzów poprzez oddziaływanie z VPAC-R (10, 48, 49). Hipoteza ta nie znalazła jednak potwierdzenia w dalszych projektach badawczych (50).
Według najnowszych doniesień w laboratorium prof. Schally´ego wyizolowano mRNA dla GHRH-R i jego czterech tzw. „splice” wariantów (SV1-4) z nowotworowych ludzkich linii komórkowych trzustki, prostaty, piersi, jajnika, płuca, mózgu, kości, jelita grubego, żołądka i węzłów chłonnych, kości, a także z komórek prawidłowych tkanek przysadki, płuc, prostaty, wątroby i nerki (12, 16, 18, 19, 51, 52). We wcześniejszych pracach opisano możliwość występowania splice wariantów receptora dla somatoliberyny na komórkach gruczolaka przysadki (53). Wszystkie badane nowotwory i zdrowe tkanki charakteryzowały się ekspresją mRNA dla przysadkowego GHRH-R i prawie wszystkie dla somatoliberyny (dla raka żołądka, jelita grubego analizy nie przeprowadzono). Z opisanych czterech wariantów receptorów GHRH-R podtyp SV1 wykazuje najwyższą strukturalną homologię do receptora przysadkowego i prawdopodobnie ma największy wpływ na procesy transformacji nowotworowej komórki. Jego obecność stwierdzono na błonie komórkowej wszystkich badanych tkanek, z wyjątkiem linii komórkowej raka płuc (tutaj występował tylko wariant SV4) (12).
Badając sekwencję nukleotydów cDNA kodującego SV1, wykazano brak trzech pierwszych eksonów na 5´ końcu nici DNA, z zachowaniem intronu trzeciego, który zawiera starter (kodon startu). Pozostała część nici DNA dla GHRH-R i SV1 jest identyczna, a różnica dotyczy 334 pierwszych nukleotydów. Brak trzech pierwszych eksonów skutkuje najprawdopodobniej utratą N-końcowej, pozakomórkowej domeny receptora, którą zstąpił 25 aminokwasowy fragment, spełniający jednak funkcję sygnałową. Natomiast nić cDNA kodująca wariant SV2, oprócz trzech pierwszych eksonów, nie zawiera także eksonu 7, dlatego białko receptora skrócone jest już po drugiej błonowej przez domenie. Receptor SV4 zbudowany jest tylko z pozakomórkowej domeny łączącej się z ligandem, gdyż w jego DNA brak jest także eksonu 5 i 6. Z kolei sekwencja nukleotydów dla SV3 jest zupełnie inna w porównaniu z pGHRH-R i SV1. Może to oznaczać odmienną strukturę białka i niewielkie znaczenie w procesach neoplastycznych (52, 54).
Wydaje się, że obecny na wielu typach nowotworów przysadkowy receptor dla somatoliberyny i jego cztery warianty, pełnią istotną rolę w patogenezie nowotworów.
Antagoniści somatoliberyny
Pierwszy antagonista GHRH ([N-Ac, Tyr, D- Arg]h GHRH(1-29)] został zsyntetyzowany przez Roggerecht´a i współpracowników w 1985 roku (55). Punktem wyjścia do otrzymania antagonisty GHRH była krótka forma somatoliberyny hGHRH(1-29), o pełnej aktywności biologicznej, składająca się z 29 aminokwasów. Zespół badaczy wykazał, że zamiana w drugiej pozycji alaniny na D-argininę powoduje, że tak zsyntetyzowany peptyd blokuje aktywność cyklazy adenylanowej w szczurzych komórkach przysadki, konsekwencją czego jest spadek wydzielania GH przez przysadkę szczura (55, 56). Obiecujące właściwości pierwszego antagonisty skłoniły do poszukiwania dalszych zastosowań, m.in. w endokrynologii i onkologii oraz syntezy pochodnych o większej aktywności biologicznej. Wzrost stabilności heliakalnej struktury białek otrzymano poprzez zamianę niektórych aminokwasów standardowego antagonisty na parachlorofenyloalaninę [Phe(4-Cl)], kwas aminobutyrowy (Abu) i norleucynę (Nle). Natomiast lepsza lipofilność, a tym samym łatwiejszą zdolność wiązania się z receptorem dla GHRH i przepuszczalność przez błony komórkowe były wynikiem acetylacji N-końca izobutylem czy fenacetylem. Zamiana w pozycji 29 argininy (Arg) na agmetynę (Agm) skutkowało powstaniem grupy związków, z których preparaty oznakowane symbolem MZ-4-71 i MZ-5-156 wykazały się najlepszą skutecznością. MZ-5-156 blokował wydzielanie GH z szczurzej przysadki in vitro 63-200 x silniej niż standardowy antagonista, natomiast in vivo spadek wydzielania był 20x większy (46, 57, 58). Podobnie antagonistyczne analogi JV-1-36 (w jego strukturze na pozycji 9 znajduje się arginina (Arg)), JV-1-38 (z sekwencją D-Arg-Har-NH2), JV-1-65 (z cytruliną w 9 pozycji), czy MZ-J-7-72 (z amidynofenalaniną z 9 pozycji) charakteryzują się silniejszym i dłuższym działaniem na oś przysadki szczura niż standardowy antagonista (59, 60).
Kolejnym etapem syntezy skuteczniejszych związków o działaniu antagonistycznym do GHRH była acetylacja N-końców JV-1-36, JV-1-38 i JV-1-65 jednokarboksylowymi lub dwukarboksylowymi kwasami, np. octanowym, dekanowym, laurynowym, palmitynowym, co znacznie zwiększyło lipofilność tych peptydów. Nowa grupa związków (głównie MZ-J-7-46, MZ-J-7-30) silnie blokowała wydzielanie GH z przysadki szczura, wykazywała się znacznie większą zdolnością wiązania z GHRH-R in vitro (MZ-J-7-46 prawie całkowicie blokował GHRH-R przez pierwsze 90 min) w porównaniu z JV-1-36, ale efekt hamowania GH in vivo był słabszy, chociaż bardziej długotrwały. Wykazano także, że antagonistyczne analogi GHRH hamowały proliferację komórek MiaPaCa (ludzka nowotworowa linia komórkowa trzustki) in vitro i komórek P-C3 (ludzka nowotworowa linia komórkowa prostaty hodowana na myszach) in vivo w znacząco większym stopniu, niż poprzedni antagoniści. Powyższe badania potwierdziły, że nowe lipopeptydy charakteryzują się lepszą aktywnością biologiczną w porównaniu z poprzednimi antagonistami i w przyszłości mogą być użyteczne jako potencjalne leki przeciwnowotworowe (61) (Tab. 1).
Tabela 1. Struktura chemiczna najczęściej badanych antagonistów GHRH.
| Standardowy antagonista | [ Ac-Tyr1, D-Arg2] hGH-RH(1-29)NH2 |
| MZ-4-71 | [Ibu-Tyr1, D-Arg2, Phe(4-Cl)6, Abu15, Nle27]hGH-RH(1-28)Agm |
| MZ-5-156 | [PhAc-Tyr1, D-Arg2, Phe(4-Cl)6, Abu15, Nle27]hGH-RH(1-28)Agm |
| MZ-4-243 | [Nac0-Tyr1, D-Arg2, Phe(4-Cl)6, Abu15, Nle27]hGH-RH(1-28)Agm |
| JV-1-10 | [PhAc-Tyr1, D-Arg2, Phe(4-Cl)6, Arg9, Abu15, Nle27, D-Arg29]hGH-RH(1-29)NH2 |
| JV-1-36 | [PhAc-Tyr1, D-Arg2, Phe(4-Cl)6, Arg9, Abu15, Nle27, D-Arg28, Har29]hGH-RH(1-29)NH2 |
| JV-1-38 | [PhAc-Tyr1, D-Arg2, Phe(4-Cl)6, Har9, Tyr(Me)10 Abu15, Nle27, D-Arg28, Har29]hGH-RH(1-29)NH2 |
| MZ-J-7-30 | [HOOC-(CH2)12-CO-Tyr1, D-Arg2, Phe(4-Cl)6, Arg9, Abu15, Nle27, D-Arg28, Har29]hGH-RH(1-29)NH2 |
| MZ-J-7-46 | [CH3-(CH2)4-CO-Tyr1, D-Arg2, Phe(4-Cl)6, Arg9, Abu15, Nle27, D-Arg28, Har29]hGH-RH(1-29)NH2 |
| MZ-J-7-110 | [HOOC-(CH2)12-CO-Tyr1, D-Arg2, Phe(4-Cl)6, Amp9, Tyr(Me)10, Abu15, Nle27, D-Arg28, Har29]hGH-RH(1-29)NH2 |
| MZ-J-7-114 | [CH3-(CH2)6-CO-Tyr1, D-Arg2, Phe(4-Cl)6, Amp9, Tyr(Me)10, Abu15, Nle27, D-Arg28, Har29]hGH-RH(1-29)NH2 |
Wykorzystanie somatoliberyny w diagnostyce i terapii
Somatoliberyna i jej syntetyczne analogi, jako najważniejsze czynniki pobudzające sekrecję hormonu wzrostu przez przysadkę, znalazły zastosowanie w diagnostyce chorób układu podwzgórzowo-przysadkowego i w leczeniu niskorosłości u dzieci.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Vance M.L.: Growth-hormone-releasing hormone. Clin. Chem., 1990; 36: 415-20.
2. Frohman L., Szabo M., et al.: Partial purification and characterization of a peptide with growth hormone releasing activity from extrapituitary tumors in patients with acromegaly. J. Clin. Invest., 1980; 65: 43-53.
3. Rivier J., Spiess J., et al.: Characterization of a growth hormone-releasing factor from a human pancreatic islet tumour. Nature 1982; 300: 276-8.
4. Guillemin R., Brazeau P., et al.: Growth hormone-releasing factor from a human pancreatic tumor that caused acromegaly. Science 1982; 218: 585-7.
5. Ling N., Esch F., et al.: Isolation primary structure and synthesis of human hypothalamic somatocrinin: Growth hormone releasing factor. Proc. Natl. Acad. Sci., USA 1984; 81: 4302-03.
6. Böhlen P., Brazeau P., et al.: Human hypothalamic growth hormone-releasing factor (GRF). Evidence for two forms identical to tumor derived GRF-44 NH2 and GRF-40 NH2. Biochem. Biophys. Res. Commun., 1983; 114: 930-36.
7. Gubler U., Monahan J.J., et al.: Cloning and sequence analysis of cDNA for the precursor of human growth hormone-releasing factor, somatocrinin. Proc. Natl. Acad. Sci., USA 1983; 80: 4311-4.
8. Mayo K.E., Cerelli G.M., et al.: Gene encoding human growth hormone-releasing factor precursor: structure, sequence, and chromosomal assignment. Proc. Natl. Acad. Sci., USA 1985; 82: 63-7.
9. Nillni E.A., Steinmetz R., Pescovitz O.H.: Posttranslational processing of progrowth hormone-releasing hormone. Endocrinology 1999; 140: 5817-27.
10. Sherwood N.M., Krueckl S.L., McRory J.E.: The origin and function of the pituitary adenylate cyclase-activating polypeptide (PACAP)/glucagon superfamily. Endocr. Rev., 2000; 21: 619-70.
11. Gaylinn B.D., Nass R., et al.: Growth hormone-releasing hormone and growth hormone secretagous: basic physiology and clinical implications. In: DeGroot J.L., Jameson J.L., editors. 4 ed. Saunders Company; 2001. p. 405-426.
12. Havt A., Schally A.V., et al.: The expression of the pituitary growth hormone-releasing hormone receptor and its splice variants in normal and neoplastic human tissues. Proc. Natl. Acad. Sci., USA 2005; 48: 17424-17429.
13. Guarcello V., Weigent D.A., Blalock J.E.: Growth hormone releasing hormone receptors on thymocytes and splenocytes from rats. Cell Immunol., 1991; 136: 291-302.
14. Khorram O., Yeung M., et al.: Effects of [norleucine27]growth hormone-releasing hormone (GHRH) (1-29)-NH2 administration on the immune system of aging men and women. J. Clin. Endocrinol. Metab., 1997; 82: 3590-6.
15. Khorram O., Garthwaite M., Golos T.: The influence of aging and sex hormones on expression of growth hormone-releasing hormone in the human immune system. J. Clin. Endocrinol. Metab., 2001; 86: 3157-61.
16. Busto R., Schally A.V., et al.: The expression of growth hormone-releasing hormone (GHRH) and splice variants of its receptor in human gastroenteropancreatic carcinomas. Proc. Natl. Acad. Sci., USA 2002; 99: 11866-71.
17. Kahan Z., Arencibia J.M., et al.: Expression of growth hormone-releasing hormone (GHRH) messenger ribonucleic acid and the presence of biologically active GHRH in human breast, endometrial and ovarian cancers. J. Clin. Endocrinol. Metab., 1999; 84: 582-89.
18. Chopin L.K., Herington A.C.: A potential autocrine pathway for growth hormone releasing hormone (GHRH) and its receptor in human prostate cancer cell lines. Prostate 2001; 49: 116-21.
19. Garcia-Fernandez M.O., Schally A.V., et al.: The expression of growth hormone-releasing hormone (GHRH) and its receptor splice variants in human breast cancer lines; the evaluation of signaling mechanism in the stimulation of cell proliferation. Breast Cancer Res. Treat., 2003; 77: 15-26.
20. Doga M., Bonadonna S., et al.: Ectopic secretion of growth hormone-releasing hormone (GHRH) in neuroendocrine tumors: relevant clinical aspects. Ann. Oncol., 2001; 12, (supl. 2): 389-94.
21. Marecka J.: Układ wydzielania wewnętrznego. W: Cichocki T., Litwin J.A., Marecka J., red. Kompendium histologii. 2 wyd. Wydawnictwo Uniwersytetu Jagiellońskiego, Kraków; 1998; p. 275-282.
22. Billestrup N., Swanson L.W., Vale W.: Growth hormone-releasing factor stimulates proliferation of somatotrophs in vitro. Proc. Natl. Acad. Sci., USA 1986; 83: 6854-6857.
23. Lin S.C., Lin C.R., et al.: Molecular basis of the little mouse phenotype and implications for cell type-specific growth. Nature 1993; 364: 190-1.
24. Obal F. Jr, Krueger J.M.: GHRH and sleep. Sleep Med. Rev., 2004; 8: 367-77.
25. Taishi P., De A., et al.: Interleukin-1beta stimulates growth hormone-releasing hormone receptor mRNA expression in the rat hypothalamus in vitro and in vivo. J. Neuroendocrinol 2004; 16: 113-8.
26. Obal F Jr., Fang J., et al.: Growth-hormone-releasing hormone mediates the sleep-promoting activity of interleukin-1 in rats. Neuroendocrinology 1995; 61: 559-65.
27. Kiaris H., Schally A.V., et al.: Growth hormone-releasing hormone: an autocrine growth factor for small cell lung carcinoma. Proc. Natl. Acad. Sci., USA 1999; 96: 14894-8.
28. Chatzistamou I., Schally A.V., et al.: Antagonists of growth hormone-releasing hormone and somatostatin analog RC-160 inhibit the growth of the OV-1063 human epithelial ovarian cancer cell line xenografted into nude mice. J. Clin. Endocrinol. Metab., 2001; 86: 2144-52.
29. Kiaris H., Schally A.V., Varga J.L.: Antagonists of growth hormone-releasing hormone inhibit the growth of U-87 MG human glioblastoma in nude mice. Neoplasia 2000; 2: 242-50.
30. Jenkins P., Besser M.: Clinical perspective: acromegaly and cancer: a problem. J. Clin. Endocrinol. Metab., 2001; 86: 2935-41.
31. Szepeshazi K., Schally A.V., et al.: Antagonists of GHRH decrease production of GH and IGF-I in MXT mouse mammary cancers and inhibit tumor growth. Endocrinology 2001; 142: 4371-78.
32. Sekyi-Otu A., Bell R., et al.: Metastatic behavior of the RIF-1 murine fibrosarcoma: inhibited by hypophysectomy and partially restored by growth hormone replacement. J. Natl. Cancer Inst., 1994; 86: 628-32.
33. Pollak M., Sem A.W., et al.: Inhibition of metastatic behavior of murine osteosarcoma by hypophysectomy. J. Natl. Cancer Inst., 1992; 84: 966-71.
34. Khandwala H.M., McCutcheon I.E., et al.: The effects of insulin-like growth factors on tumorigenesis and neoplastic growth. Endocrine Reviews 2000; 21: 215-244.
35. Pawlikowski M.: Regulacja wydzielania hormonu wzrostu (GH) i insulinopodobnego czynnika wzrostowego I (IGF-I). Endokrynol Pol 1999; 50(supl2): 5-10.
36. Miller T.L., Mayo K.E.: Glucocorticoids regulate pituitary growth hormone-releasing hormone receptor messengerribonucleic acid expression. Endocrinology 1997; 138: 2458-2465.
37. Shimon I., Mehmed S.: Structure and function of somatostatin receptors in growth hormone control. Journal of Endocrinology 1997; 155: 3-6.
38. Tannenbaum G., Epelbaum J., Bowers C.Y.: Interrelationship between the novel peptide ghrelin and somatostatin/growth hormone-releasing hormone in regulation of pulsatile growth hormone secretion. Endocrinology 2003; 144: 967–974.
39. Petersenn S., Rasch A.C., et al.: Structure and regulation of the human growth hormone-releasing hormone receptor gene. Mol. Endocrinol., 1998; 12: 233-247.
40. Gaylinn B.D.: Growth hormone releasing hormone receptor. Receptors Channels 2002; 8: 155-62.
41. Horwajth J.E., Groot K., Schally A.V.: Growth hormone-releasing hormone stimulates cAMP release in superfused rat pituitary cells. Proc. Natl. Acad. Sci., USA 1995; 92: 1856-1860.
42. Mayo K.E., Miller T.L., et al.: The growth-hormone-releasing hormone receptor: signal transduction, gene expression, and physiological function in growth regulation. Ann. NY Acad. Sci., 1996; 805: 184-203.
43. Ramirez J.L., Castano J.P., et al.: Growth hormone (GH)-releasing factor differentially activates cyclic adenosine 3*,5* monophosphate- and inositol phosphate-dependent pathways to stimulate GH release in two porcine somatotrope subpopulations. Endocrinology 1999; 40: 1752-59.
44. Kineman R.D.: Antitumorigenic actions of growth hormone-releasing hormone antagonists. Proc. Natl. Acad. Sci. USA. 1999 Dec 21; 96: 14894-8.
45. Siriwardana G., Bradford A., et al.: Autocrine/paracrine regulation of breast cancer cell proliferation by growth hormone releasing hormone via Ras., Raf., and mitogen-activated protein kinase. Mol. Endocrinol., 2006; 20: 2010-19.
46. Schally A.V., Varga J.L.: Antagonistic analogs of growth hormone-releasing hormone: new potential antitumor agents. Trends Endocrinol. Metab., 1999; 10: 383-391.
47. Tang J., Lagace G., et al.: Identification of human growth hormone-releasing hormone receptor splicing variants. J. Clin. Endocrinol. Metab., 1995; 80: 2381-7.
48. Rekasi Z., Varga J.L., et al.: Antagonistic actions of analogs related to growth hormone-releasing hormone (GHRH) on receptors for GHRH and vasoactive intestinal peptide on rat pituitary and pineal cells in vitro. Proc. Natl. Acad. Sci. USA 2000; 97: 1218-1223.
49. Reubi J.C.: In vitro identification of vasoactive intestinal peptide receptors in human tumors: implications for tumor imaging. J. Nucl. Med., 1995; 36: 1846-53.
50. Rekasi Z., Varga J.L., et al.: Antagonists of growth hormone-releasing hormone and vasoactive intestinal peptide inhibit tumor proliferation by different mechanisms: evidence from in vitro studies on human prostatic and pancreatic cancers. Endocrinology 2000; 141: 2120-2128.
51. Halmos G., Schally A.V., et al.: Characterization of receptors for growth hormone-releasing hormone in human osteosarcomas and Ewing´s sarcomas. Int. J. Oncol., 2006; 29: 463-9.
52. Halmos G., Schally A.V., et al.: Human renal cell carcinoma expresses distinct binding sites for growth hormone-releasing hormone. Proc. Natl. Acad. Sci. USA 2000; 97: 10555-10560.
53. Hashimoto K., Koga M., et al.: Identification of alternativly spliced messenger ribonucleic acid encoding truncated growth hormone-releasing hormone receptor in human pituitary adenomas. J. Clin. Endocrinol. Metab., 1995; 80: 2933-39.
54. Rekasi Z., Czomploy T., et al.: Isolation and sequencing of cDNA for splice variants of growth hormone-releasing hormone receptors for human cancers. Proc. Natl. Acad. Sci., USA 2000; 97: 10561-66.
55. Robberecht P., Coy D.H., et al.: Structural requirements for the activation of rat anterior pituitary adenylate cyclase by growth hormone-releasing factor (GRF): discovery of (N-Ac-Tyr1, D-Arg2)-GRF(1-29)-NH2 as a GRF antagonist on membranes. Endocrinology 1985; 117: 1759-64.
56. Lumpkin M.D., Mulroney S.E., Haramati A.: Inhibition of pulsatile growth hormone (GH) secretion and somatic growth in immature rats with a synthetic GH-releasing factor antagonist. Endocrinology 1989; 124: 1154-59.
57. Zarandi M., Horvath J.E., et al.: Synthesis and biological activities of highly potent antagonists of growth hormone-releasing hormone. Proc. Natl. Acad. Sci., USA 1994; 91: 12298-301.
58. Zarandi M., Kovacs M., et al.: Synthesis and in vitro evaluation of new potent antagonists of growth hormone-releasing hormone (GH-RH) Peptides 1997; 18: 423-30.
59. Varga J.L., Schally A.V., et al.: Synthesis and biological evaluation of antagonists of growth hormone-releasing hormone with high and protracted in vivo activities. Proc. Natl. Acad. Sci., USA 1999; 96: 692-97.
60. Varga J.L., Schally A.V., et al.: Increased activity of antagonist of growth hormone-releasing hormone substituted at positions 8,9, and 10. Proc. Natl. Acad. Sci., USA 2004; 10: 1708-13.
61. Zarandi M., Varga J.L., et al.: Lipopeptide antagonists of growth hormone-releasing hormone with improved antitumor activities. Proc. Natl. Acad. Sci., USA 2006; 103: 4610-15.
62. Bozzola M., Tato L., et al.: Synthetic growth hormone-releasing hormone (GHRH 1-44) in the differential diagnosis between hypothalamic and pituitary GH deficiency. J. Endocrinol. Invest 1986; 9: 503-6.
63. Thorner M.O., Reschke J., et al.: Acceleration of growth in two children treated with human growth hormone-releasing factor. N. Engl. J. Med., 1985; 312: 4-9.
64. Ross R.J., Rodda C., et al.: Treatment of growth-hormone deficiency with growth-hormone-releasing hormone. Lancet 1987; 1: 5-8.
65. Thorner M., Rochiccioli P., et al.: Once daily subcutaneous growth hormone-releasing hormone therapy accelerates growth in growth hormone-deficient children during the first year of therapy. Geref International Study Group. J. Clin. Endocrinol. Metab., 1996; 81: 1189-96.
66. Alba M., Fintini D., et al.: Once-daily administration of CJC-1295, a long-acting growth hormone-releasing hormone (GHRH) analog, normalizes growth in the GHRH knockout mouse. Am. J. Physiol. Endocrinol. Metab., 2006; 291: 1290-4.
67. Schussler P., Yassouridis A., et al.: Growth hormone-releasing hormone and corticotropin-releasing hormone enhance non-rapid-eye-movement sleep after sleep deprivation. Am. J. Physiol. Endocrinol. Metab., 2006; 291: E549-56.
68. Khorram O., Laughlin G.A., Yen S.S.C.: Endocrine and metabolic effects of long-term administration of [Nle27]growth hormone-releasing hormone-(1–29)-NH2 in age-advanced men and women. J. Clin. Endocrinol. Metab., 1997; 82: 1472-1479.
69. Ghigo E., Ceda G.P., et al.: Low doses of either intravenously or orally administered arginine are able to enhance growth hormone response to growth hormone releasing hormone in elderly subjects. J. Endocrinol. Invest., 1994; 17: 113-7.
70. Schriock E.A., Hulse J.A., et al.: Evaluation of hypothalamic dysfunction in growth hormone (GH)-deficient patients using single versus multiple doses of GH-releasing hormone (GHRH-44) and evidence for diurnal variation in somatotroph responsiveness to GHRH in GH-deficient patients. J. Clin. Endocrinol. Metab., 1987; 65: 1177-82.
71. Chatzistamou I., Schally A.V., et al.: Inhibition of growth and metastases of MDA-MB-435 human estrogen-independent breast cancers by an antagonist of growth hormone-releasing hormone. Anticancer Drugs 2001; 12: 761-8.
72. Hohla F., Schally A.V., et al.: Synergistic inhibition of growth of lung carcinomas by antagonists of growth hormone-releasing hormone in combination with docetaxel. Proc. Natl. Acad. Sci., USA 2006; 103: 14513-8.
73. Szepeshazi K., Schally A.V., et al.: Antagonists of growth hormone-releasing hormone (GH-RH) inhibit IGF-II production and growth of HT-29 human colon cancers. Br. J. Cancer 2000; 82: 1724-31.
74. Szepeshazi K., Schally A.V., et al.: Antagonists of growth hormone-releasing hormone (GH-RH) inhibit in vivo proliferation of experimental pancreatic cancers and decrease IGF-II levels in tumours. Eur. J. Cancer 2000; 36: 128-36.
75. Szereday Z., Schally A.V., et al.: Antagonists of growth hormone-releasing hormone inhibit the proliferation of experimental non-small cell lung carcinoma. Cancer Res., 2003; 63: 7913-9.
76. Pinski J.: Inhibition of growth of human small-cell and non-small-cell lung carcinomas by antagonists of growth hormone-releasing hormone (GH-RH). Int. J. Oncol., 1996; 9: 1099-105.
77. Plonowski A., Schally A.V., et al.: Inhibition of proliferation of PC-3 human prostate cancer by antagonists of growth hormone-releasing hormone: lack of correlation with the levels of serum IGF-I and expression of tumoral IGF-II and vascular endothelial growth factor. Prostate 2002 Aug 1; 52: 173-82.
78. Lamharzi N., Schally A.V., et al.: Growth hormone-releasing hormone antagonist MZ-5-156 inhibits growth of DU-145 human androgen-independent prostate carcinoma in nude mice and suppresses the levels and mRNA expression of insulin-like growth factor II in tumors. Proc. Natl. Acad. Sci., USA 1998; 95: 8864-8.
79. Jungwirth A., Schally A.V., et al.: Growth hormone-releasing hormone (GH-RH) antagonist MZ-4-71 inhibits in vivo proliferation of Caki-I renal adenocarcinoma. Proc. Natl. Acad. Sci., USA 1997; 94: 5810-13.
80. Braczkowski R., Schally A.V., et al.: Inhibition of proliferation in human MNNG/HOS osteosarcoma and SK-ES-1 Ewing sarcoma cell lines in vitro and in vivo by antagonists of growth hormone-releasing hormone: effects on insulin-like growth factor II. Cancer 2002; 95: 1735-45.
81. Kovacs M., Zarandi M., et al.: Effects of acute and chronic administration of a new potent antagonist of growth hormone-releasing hormone in rats: mechanism of action. Endocrinology 1996; 137: 5364-5369.
82. Kovacs M., Kineman R.D., et al.: Effects of antagonists of growth hormone-releasing hormone (GHRH) on GH and insulin-like growth factor I levels in transgenic mice overexpressing the human GHRH gene, an animal model of acromegaly. Endocrinology 1997; 138: 4536-4542.
83. Csernus V.J., Schally A.V., et al.: Inhibition of growth, production of insulin-like growth factor-II (IGF-II), and expression of IGF-II mRNA of human cancer cell lines by antagonistic analogs of growth hormone-releasing hormone in vitro. Proc. Natl. Acad. Sci., USA 1999; 96: 3098-103.
84. Rekasi Z., Varga J.L., et al.: Antiproliferative actions of growth hormone-releasing hormone antagonists on MiaPaCa-2 human pancreatic cancer cell involve cAMP independent pathways. Peptides 2001; 22: 879-86.
85. Melmed S.: Medical progress: Acromegaly. N Engl J Med 2006; 355: 2558-73.
86. Shimon I., Melmed S.: Genetic basis of endocrine disease: pituitary tumor pathogenesis. J. Clin. Endocrinol. Metab., 1997; 82: 1675-81.
87. Asa S.L., Scheithauer B.W., et al.: A case for hypothalamic acromegaly: a clinicopathalogical study of six patients with hypothalamic gangliocytomas producing growth hormone-releasing factor. J. Clin. Endocrinol. Metab., 1984; 58: 796-803.
88. Renner U., Brockmeier S., et al.: Growth hormone (GH)-releasing peptide stimulation of GH release from human somatotroph adenoma cells: interacton with GH-releasing hormone, thyrotropin-releasing hormone, and octreotide. J. Clin. Endocrinol. Metab., 1994; 78: 1090-6.
89. Webb C.B., Thominet J.L., Frohman L.A.: Ectopic growth hormone releasing factor stimulates growth hormone release from human somatotroph adenomas in vitro. J. Clin. Endocrinol. Metab., 1983; 56: 417-9.
90. Mayo K.E., Hammer R.E., et al.: Dramatic pituitary hyperplasia in transgenic mice expressing a human growth hormone-releasing factor. Mol. Endocrinol., 1988; 2: 606-12.
91. Asa S.L., Kovacs K., et al.: Pituitary adenomas in mice transgenic for growth hormone-releasing hormone. Endocrinology 1992; 131: 2083-9.
92. Hanew K., Utsumi A., et al.: Secretory mechanisms of growth hormone (GH)-releasing peptide-, GH-releasing hormone-, and thyrotropin-releasing hormone-induced GH release in patients with acromegaly. J. Clin. Endocrinol. Metab., 1998; 83: 3578-83.
93. Spada A., Vallar L.: G-protein oncogenes in acromegaly. Horm Res., 1992; 38: 90-93.
94. Hanew K., Tanaka A., et al.: Plasma GH responses to human GHRH-antagonist in normal subjects. Eur. J. Endocrinol., 1996; 134: 67-72.
95. Jaffe C.A., DeMott-Friberg R., Barkan A.L.: Suppression of growth hormone (GH) secretion by a selective GH-releasing hormone (GHRH) antagonist. J. Clin. Invest., 1993; 92: 695-701.
96. Jaffe C.A., Demmot-Friberg R., et al.: Suppression of growth hormone (GH) hypersecretion due to ectopic GH-Releasing Hormone (GHRH) by a selective GHRH antagonist. J. Clin. Endocrinol. Metab., 1997; 82: 634-637.
97. Adams E.F., Law H., et al.: Presence of GHRH mRNA in human pituitary somatotrophinomas and its relationship to in vitro effects of a GHRH-antagonist on GH secretion and cAMP production. Pituitary 1998; 1: 7-12.
98. Dimaraki E.V., Chandler W.F., et al.: The role of endogenous growth hormone-releasing hormone in acromegaly. J. Clin. Endocrinol. Metab., 2006; 91: 2185-2190.
99. Hellstrom A., Carlsson B., et al.: IGF-I is critical for normal vascularization of the human retina. J. Clin. Endocrinol. Metab., 2002; 87: 3413-6.
100. Wilkimson-Berka J.L., Wraight C., Wethet G.: The role of growth hormone, insulin-like growth factor and somatostatin in diabetic retinopathy. Curr. Med. Chem., 2006; 13: 3307-17.
101. Rymaszewski Z., Cohen R.M., Chomczynski P.: Human growth hormone stimulates proliferation of human retinal microvascular endothelial cells in vitro. Proc. Natl. Acad. Sci., USA 1991; 88: 617-21.
102. Boehm B.O.: Use of long-acting somatostatin analogue treatment in diabetic retinophaty. Dev. Ophthalmol., 2007; 39: 111-21.
103. Grant M.B., Caballero S Jr.: The potential role of octreotide in the treatment of diabetic retinopathy. Treat. Endocrinol., 2005; 4: 199-203.

