© Borgis - Postępy Fitoterapii 3/2012, s. 192-196
*Edyta Gheribi
Znaczenie fitoestrogenów roślinnych w profilaktyce osteoporozy
The importance of plant phytoestrogens in the prevention of osteoporosis
Wyższa Szkoła Zawodowa Łódzkiej Korporacji Oświatowej, Łódź
Rektor: prof. nadzw. dr inż. Janusz Baranowski
Summary
Osteoporosis is the gradual declining in bone mass with age, leading to increased bone fragility and fractures. Fractures in hip and spine are known to be the most important complication of the disease. Menopause is one of the most common risk factors of osteoporosis. Dietary phytoestrogens are emerging as a valid alternative to estrogens in the treatment of menopause-related diseases, such as osteoporosis. Phytoestrogens are numerous and nearly ubiquitous in the plant kingdom, having been found in almost all plants. They are subdivided into many classes but for human use the most interesting are isoflavones, lignans and coumestans. The major sources of isoflavones in the human diet are soy and its derivatves.

Wstęp
Fitoestrogeny to związki pochodzenia roślinnego o budowie niesteroidowej. Wykazują one wiele działań estrogenopodobnych (1). Wyróżnia się trzy klasy fitoestrogenów: izoflawony, lignany i kumestany (2, 3) (tab. 1). Głównym źródłem izoflawonów w diecie człowieka są soja i jej produkty. Do lignanów należą sekoizolaricirezynol oraz matairezynol, które występują głównie w nasionach lnu i słonecznika. Występują one zwykle w postaci nieaktywnych glikozydów lub w formie prekursorowej (4, 5) (ryc. 1).
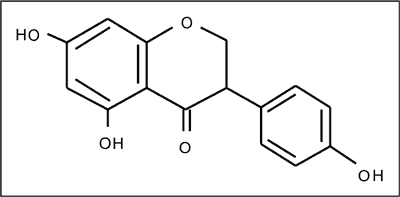
Ryc. 1. Forma prekursorowa izoflawonów.
W ostatnich latach prowadzonych jest wiele badań nad znaczeniem fitoestrogenów w profilaktyce i leczeniu osteoporozy, która jest obecnie istotnym problemem zdrowotnym na całym świecie. WHO definiuje osteoporozę jako układową chorobę szkieletu, cechującą się niską masą kostną, upośledzoną gęstością tkanki kostnej, a w konsekwencji zwiększoną jej łamliwością i podatnością na złamania. Osteoporoza jest przewlekłą, metaboliczną chorobą kości, która prowadzi stopniowo do obniżenia ich masy, zaburzeń struktury i wytrzymałości, co w konsekwencji grozi złamaniami.
Osteoporoza powoduje dolegliwości bólowe, niesprawność fizyczną i znacznie obniża jakość życia, a ponadto prowadzi do złamań, które są podstawowym objawem klinicznym ujawniającym chorobę (6). Chorobę tę poprzedza długi okres osteopenii, czyli stanu zmniejszonego stopnia mineralizacji kości w stosunku do wartości normalnych. Dane epidemiologiczne wskazują na wzrastającą liczbę przypadków złamań spowodowanych osteoporozą. Zjawisko to dotyczy zarówno kobiet, jak i mężczyzn, jednak w przypadku kobiet przyczyną osteoporozy typu I, czyli pomenopauzalnej, są zmiany hormonalne po menopauzie, gdyż wskaźnik utraty masy kostnej u kobiet jest w tym okresie najwyższy. Osteoporoza występuje sześciokrotnie częściej u kobiet niż u mężczyzn.
Rozwój osteoporozy związany jest z wielkością szczytowej masy kostnej oraz z wiekiem i stanem hormonalnym. Estrogeny zatem odgrywają podstawową rolę w utrzymaniu masy kostnej i stabilizują metabolizm kostny, doprowadzając do hamowania aktywności resorpcyjnej osteoklastów oraz aktywności kościotwórczej osteoblastów (7). Osteoblasty natomiast hamują sekrecję cytokin, które stanowią parakrynne stymulatory metabolizmu osteoklastów. W przypadku niedoboru estrogenów dochodzi do zwiększonej resorpcji kości, której towarzyszy uwalnianie dużej ilości wapnia. Intensywne badania wskazują, że dieta bogata w fitoestrogeny może mieć pozytywny wpływ na profilaktykę i leczenie osteoporozy.
Tabela 1. Podział fitoestrogenów i ich źródła.
| Klasa | Podtyp | Źródła |
| Glikozydy | Aglikony |
| Izoflawony | genisteina
biochanina A | genisteina | soja, orzechy ziemne |
daidzeina
formononetyna | daidzeina | koniczyna,
nasiona słonecznika |
| glicyteina | | orzechy włoskie |
| Lignany | sekoizolaricirezynol | enterodiol | zboża |
| matairezynol | enterolakton | nasiona (lnu, słonecznika),
chleb żytni,
warzywa,
owoce |
| Kumestany | | kumestrol | fasola,
kiełki sojowe,
kiełki alfa alfa,
koniczyna |
Metabolizm i biodostępność fitoestrogenów
Większość fitoestrogenów występuje w roślinach jako glikozydy lub prekursory. Aktywne formy fitoestrogenów, o strukturze chemicznej zbliżonej do estrogenów, powstają w przewodzie pokarmowym w wyniku złożonych przemian enzymatyczno-metabolicznych. Dla przykładu, izoflawon genisteina powstaje z biochaniny A, a daidzeina z formononetyny (8). Lignany również występują w roślinach w postaci glikozydów (9). Metabolizm ich nie jest jeszcze do końca poznany.
Z badań wynika, że biotransformacja aglikonów izoflawonów zachodzi w wątrobie, przy udziale enzymów:
– I fazy (hydroksylacja, demetylacja – cytochrom P450),
– II fazy (0-metylacja, sprzęganie z kwasem glukuronowym lub siarkowym), częściowo już w jelicie (10) (ryc. 2).
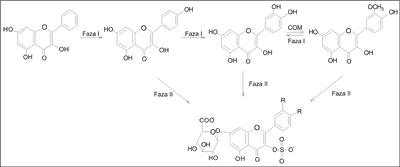
Ryc. 2. Metaboliczne drogi biotransformacji aglikonów izoflawonów (11).
Hydroliza glikozydów zachodzi w przewodzie pokarmowym pod wpływem kwasu żołądkowego oraz jelitowych i bakteryjnych β-glukozydaz zawartych w pożywieniu. W wyniku tego procesu powstają aktywne aglikony, m.in. genisteina i daidzeina. Dalszy metabolizm, obejmujący reakcje dehydroksylacji, redukcji i demetylacji zachodzi w jelicie.
Dominującą formą, w jakiej aglikony zostaną wchłonięte z przewodu pokarmowego, są glukuronowe pochodne tych związków. W wątrobie i nerkach zachodzi intensywne siarczanowanie i etylowanie, a powstające koniugaty wracają wraz z żółcią do przewodu pokarmowego lub są wydalane z moczem. Na intensywność metabolizmu wskazuje fakt, że zaledwie 1-2% niezmienionych związków jest wydalanych z moczem.
Produkty metabolizmu są wydalane z moczem oraz z żółcią. Niewchłonięte i wydzielone z żółcią metabolity są przetwarzane przez mikroflorę jelitową (2). Procesy te zachodzą głównie w jelicie grubym.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Adlecreutz H. Phytoestrogens. State of the art. Environ Toxicol Pharmacol 1999; 7:201-7. 2. Brouns F. Soya isoflavones: a new and promising ingredient for the health foods sector. Food Res Intern 2002; 35:187-93. 3. Adlercreutz H. Phytoestrogens and cancer. Lancet Oncol 2002; 3:364-73. 4. Barnes S, Sfakianos J, Coward L. Soy isoflavonoids and cancer prevention. Underlying biochemical and pharmacological issues. Adv Exp Med Biol 1996; 401:87-100. 5. Chechi LM, Micheli L. Utility of dietary phytoestrogens in preventing postmenopausal osteoporosis. Nutraceut Res 2005; 3,1:15-28. 6. Cummings S, Melton L. Epidemiology and outcomes of osteoporotic fractures. Lancet 2002; 359:1761-7. 7. Seeman E, Karlson MK, Duan Y. On exposure to anorexia nervosa, the temporal variation in axial and appendicular skeletal development predisposes to site-specific deficits in bone size and density, a cross-sectional study. J Bone Min Res 2000; 5:2259-65. 8. Barnes S, Sfakianos J, Coward L i wsp. Soy isoflavonoids and cancer prevention. Underlying biochemical and pharmacological issues. Adv Exp Med Biol 1996; 401:87-100. 9. Meagher L, Beecher G. Assesment of data on the lignin content of foods. J Food Comp Anal 2000; 13:935-47. 10. Hodek P. Flavonoids-potent and versatile biologically active compounds interacting with cytochromes P450. Chem Biol Interact 2002; 139, 141. 11. Rasmussen SE, Breinholt VM. Non-nutritive bioactive food constituents of plants: bioavailability of flavonoids. Int J Vitam Nutr Res 2003; 73(2):101-11. 12. Adlercreutz H, Fotsis T, Bannwart C i wsp. Determination of urinary lignans and phytoestrogen metabolites, potential antiestrogens and anticarcinogens, in urine of women on various habitual diets. J Steroid Biochem 1986; 25:191-7. 13. Rowland I, Wiseman H, Sanders T i wsp. Interindividual variation in metabolism of soy isoflavones and lignans: influence of habitual diet on equal production by the gut microflora. Nutr Cancer 2000; 36:27-32. 14. Walsh K, Zhang Y, Vodovotz Y i wsp. Stability and bioaccessibility of isoflavones from soy bread during in vitro digestion. J Agric Food Chem 2003; 51:4603-9. 15. Kurzer M, Xu X. Dietary phytoestrogens. Ann Rev Nutr 1997; 17:353-81. 16. Murkies A, Wilcox G, Davis S. Phytoestrogens. J Clin Endocrinol Metab 1998; 83:297-303. 17. Bingham S, Atkinson C, Liggins J i wsp. Phytooestrogens: where are we now? Br J Nutr 1998; 79:393-406. 18. Dixon RA, Ferreira D. Genistein. Phytochem 2002; 60:205-11. 19. Liggins J, Bluck L, Runswick S i wsp. Daidzein and genistein content of fruits and nuts. J Nutr Biochem 2000; 11:326-31. 20. Liggins J, Bluck L, Runsick S i wsp. Daidzein and genistein content of vegetables. Br J Nutr 2000; 84:717-25. 21. Thompson LU, Boucher BA, Lui Z. Phytoestrogen content of foods consumed in Canada, including isoflavones, lignans and coumestan. Nutr Cancer 2006; 54(2):184-201. 22. Kim J-S, Kwon C-S. Estimated dietary isoflavone intake of Korean population based on national nutrition survey. Nutr Res 2001; 21: 947-53. 23. Cassidy A. Potential risk and benefits of phytoestrogen-rich diets. Int J Vitam Nutr Res 2003; 73(2):120-6. 24. Mei J, Yeung SSC, Kung AWC. High dietary phytoestrogen intake is associated with higher bone mineral density in postmenopausal but not premenopausal women. J Clin Endocrinol Metab 2001; 86:5217-21. 25. Marini H, Inutoli LM, Polito F i wsp. Effects of the phytoestrogen genistein on bone metabolism in osteopenic postmenopausal woman. Ann Intern Med 2007; 146:839-47. 26. Brandi ML. Natural and synthetic isoflavones in the prevention and treatment of chronic diseases. Calcif Tissue Iny 1997; 60(1):S5-8. 27. Kleszcz H: Osteoporoza – wielki problem zdrowotny. Mag Med 1994; 6:34-6. 28. Setchell KDR, Cassidy A. Dietary isoflavones – biological effects and relevance to human health. J Nutr 1999; 129:758-67. 29. Coxam V. Prevention of osteopaenia by phytoestrogens: animal studies. Br J Nutr 2003; 89(Suppl 1):S75-85. 30. Hegsted M, Warner S, Heaton S i wsp. Soy diet increases tibial cortical bone formation in ovariectomized retired breeder rats. J Bone Mineral Res 1999; 14:S531. 31. Arjmandi BH, Alekel L, Hollis BW i wsp. Dietary soyben protein prevents bone loss in an ovariectomized rat model of osteoporosis. J Nutr 1996; 126:161-7. 32. Uesugi T, Fukui Y, Yamori Y. Beneficial effects of soybean isoflavone supplementation on bone metabolism and serum lipids in postmenopausal Japanese women: a four-week study. J Am Coll Nutr 2002; 21:97-102. 33. Lucas EA, Wild RD, Hammond LJ i wsp. Flaxseed improves lipid profile without altering biomarkers of bone metabolism in postmenopausal women. J Clin Endocrin Metab 2002; 87:1527-32. 34. Atkinson C, Compston JE, Day NE i wsp. The effects of phytoestrogen isoflavones on bone density in women: a double-blind, randomized, placebo-controlled trial. Am J Clin Nutr 2001; 79(2):326-33. 35. Potter SM, Baum JA, Teng G i wsp. Soya protein and isoflavones: their effect on blood lipids and bone density in postmenopausal woman. Am J Clin Nutr 1998; 68:1375-9. 36. Blair H, Jordan E, Peterson T i wsp. Variable effects of tyrosine kinase inhibitors on avian osteoclastic activity and reduction of bone loss in ovariectomized rats. J Cell Biochem 1996; 61:629-37. 37. Fanti P, Monier-Faugere M, Geng Z i wsp. The phytoestrogen genistein reduces bone loss in short-term ovariectomized rats. Osteopor Int 1998; 8:274-81. 38. Picherit C, Chanteranne B, Bennetau-Pelissero C i wsp. Dose-dependent bone-sparing effects of dietary isoflavones in the ovariectomised rat. Br J Nutr 2001; 85:307-16. 39. Blum S, Heaton S, Bowman B i wsp. Dietary soy protein maintains some indices of bone mineral density and bone formation in aged ovariectomized rats. J Nutr 2003; 133:1244-9.


