© Borgis - Postępy Nauk Medycznych 6/2015, s. 361-366
*Jan Styczyński1, Karolina Siewiera2, Krzysztof Czyżewski1, Jowita Frączkiewicz2, Krzysztof Kałwak2, Ewa Gorczyńska2, Alicja Chybicka2, Olga Zając-Spychała3, Jacek Wachowiak3, Jolanta Goździk4, Agnieszka Zaucha-Prażmo5, Jerzy Kowalczyk5, Mariusz Wysocki1
Inwazyjne zakażenia grzybicze u dzieci i młodzieży po przeszczepieniu komórek krwiotwórczych
Invasive fungal infections in children and adolescents after hematopoietic stem cell transplantation
1Katedra Pediatrii, Hematologii i Onkologii, Collegium Medicum, Uniwersytet Mikołaja Kopernika, Szpital Uniwersytecki im. Jurasza, Bydgoszcz
Kierownik Katedry: prof. dr hab. med. Mariusz Wysocki
2Katedra i Klinika Transplantacji Szpiku, Onkologii i Hematologii Dziecięcej, Uniwersytet Medyczny, Wrocław
Kierownik Kliniki: prof. dr hab. med. Alicja Chybicka
3Klinika Onkologii, Hematologii i Transplantologii Pediatrycznej, Uniwersytet Medyczny, Poznań
Kierownik Kliniki: prof. dr hab. med. Jacek Wachowiak
4Katedra Immunologii i Transplantologii Klinicznej, Uniwersytet Jagielloński Collegium Medicum, Ośrodek Transplantacji Uniwersyteckiego Szpitala Dziecięcego, Kraków
Kierownik Katedry: prof. dr hab. med. Maciej Siedlar
5Klinika Hematologii, Onkologii i Transplantologii Dziecięcej, Uniwersytet Medyczny, Lublin
Kierownik Kliniki: prof. dr hab. med. Jerzy Kowalczyk
Streszczenie
Wstęp. Pacjenci poddawani procedurze transplantacji komórek krwiotwórczych (HSCT) stanowią grupę, w której ryzyko inwazyjnych zakażeń grzybiczych (IFI) jest szczególnie wysokie. Zakażenia grzybicze są częstą przyczyną chorobowości i śmiertelności wśród dzieci poddawanych przeszczepieniu komórek krwiotwórczych.
Cel pracy. Analiza częstości i wyników terapii zakażeń grzybiczych w pięciu polskich pediatrycznych ośrodkach przeszczepiania komórek krwiotwórczych Polskiej Pediatrycznej Grupy ds. Przeszczepiania Komórek Krwiotwórczych (PPGdsPKK) w okresie 24 miesięcy.
Materiał i metody. Badania przeprowadzono w oparciu o projekt „Zakażenia w polskich pediatrycznych ośrodkach onkohematologii i/lub przeszczepiania komórek krwiotwórczych 2012-2013” (iPhot-13). W badanym okresie w ośrodkach uczestniczących w projekcie wykonano 308 HSCT, w tym 232 allo-HSCT i 76 auto-HSCT.
Wyniki. Mediana czasu od HSCT do rozpoznania IFI wynosiła 1 miesiąc. Częstość inwazyjnych zakażeń grzybiczych wynosi 27,3% wśród dzieci po HSCT. Częstość IFI była szczególnie wysoka u dzieci z ostrą białaczką limfoblastyczną (ALL; 31,3%) i ostrą białaczką mieloblastyczną (AML; 44,7%). W zależności od poziomu rozpoznania stwierdzono 11 (3,6%) IFI potwierdzonych, 29 (9,4%) prawdopodobnych i 44 (14,3%) możliwych. 100-dniowe przeżycie u wszystkich pacjentów z IFI wyznaczone metodą Kaplana-Meiera wyniosło 75%, w tym odpowiednio 92,3, 61,5, i 82,6% w potwierdzonym, prawdopodobnym i możliwym IFI. Nie stwierdzono znamiennych różnic wyleczalności IFI pomiędzy pacjentami po auto- vs. allo-HSCT, podobnie jak pomiędzy ALL vs. AML.
Wnioski. Pojawiające się dane z polskich pediatrycznych ośrodków HSCT wskazują na wysoką częstość powikłań infekcyjnych w populacji dziecięcej. Częstość zakażeń grzybiczych jest wyższa w porównaniu z danymi dostępnymi z ostatniej dekady. Jednocześnie u około 75% dzieci z IFI po HSCT dochodzi do wyleczenia.
Summary
Introduction. Infections are the main cause of morbidity and mortality in children with cancer or undergoing stem cell transplantation. Patients undergoing hematopoietic stem cell transplantation (HSCT) are at particularly high risk of invasive fungal infections (IFI).
Aim. The aim of this study was the analysis of incidence and outcome of fungal infections in five Polish centers of pediatric hematopoietic stem cell transplantation (HSCT) units of Polish Pediatric Group for Hematopoietic Stem Cell Transplantation over a period of 24 months. Material and methods. The study was performed within the project „Infections in Polish pediatric hematology, oncology and stem cell transplant setting 2013 (iPhot-13)”. During this period a total number of 308 HSCTs were performed in participating centers.
Results. Median time from HSCT to development of IFI was 1 month. The incidence of patients with at least one episode of fungal infection was 27.3% among children undergoing HSCT. The incidence of IFI was prominently high in acute lymphoblastic leukemia (ALL; 31.3%) and acute myeloblastic leukemia patients (AML; 44.7%). With respect to level of diagnosis the incidence was: 3.6% (n = 11) for proven, 9.4% (n = 29) probable and 14.3% (n = 44) possible IFI. 100-day survival from IFI was 75%, and 92.3, 61.5, and 82.6% for proven, probable, and possible IFI, respectively. No differences were found in outcome from IFI between auto- vs. allo-HSCT patients, as well as between ALL vs. AML.
Conclusions. Emerging data from Polish pediatric hematopoietic stem cell transplant centers indicate high incidence of infectious complications in pediatric population. The incidence of IFI after HSCT, and particularly in ALL and AML is much higher than it was recently anticipated. The rate of survival after IFI in HSCT setting is 75%, what is comparable with the best results obtained worldwide.

Wstęp
Powikłania infekcyjne są jednym z głównych czynników wpływających na śmiertelność po chemioterapii i allo-HSCT (ang. hematopoietic stem cell transplantation – HSCT). Zakażenia są przyczyną 12% zgonów po HSCT od zgodnych dawców rodzinnych, 17% zgonów po HSCT od dawców niespokrewnionych i 8% po auto-HSCT (1). W USA po allo-HSCT zakażenia występują u 82% dzieci (2), natomiast po auto-HSCT u 21% dzieci z guzami litymi i chłoniakami oraz u 49% u dzieci z ostrymi białaczkami (3). W raporcie Srinivasana i wsp. częstość inwazyjnych zakażeń grzybiczych (ang. invasive fungal infections – IFI) w St. Jude Hospital po allo-HSCT u dzieci wynosiła 12% w przeciągu pierwszych 30 dni po HSCT, 8% pomiędzy 31-100 dniem oraz 17% pomiędzy dniem +100 a końcem drugiego roku (2), natomiast zakażenia grzybicze po auto-HSCT występowały stosunkowo rzadko (3). Zakażenia przyczyniają się do zgonów 8% dzieci poddawanych allo-HSCT. Wśród nich są zakażenia: grzybicze – 53%, bakteryjne – 20%, wirusowe – 24% i pasożytnicze – 3% (2). Uważa się, że zgony z powodu infekcji u dzieci poddawanych auto-HSCT zdarzają się rzadko (3).
Cel pracy
Celem pracy była analiza częstości zachorowań i wyników leczenia inwazyjnych zakażeń grzybiczych u dzieci i młodzieży poddawanych przeszczepieniu komórek krwiotwórczych w pięciu ośrodkach Polskiej Pediatrycznej Grupy ds. Przeszczepiania Komórek Krwiotwórczych (PPGdsPKK).
Materiał i metody
Retrospektywnej analizie poddano 308 transplantacji komórek krwiotwórczych przeprowadzonych u dzieci i młodzieży, w latach 2012-2013, w pięciu polskich pediatrycznych ośrodkach przeszczepowych. W zależności od typu przeszczepienia, wykonano 232 allo-HSCT oraz 76 auto-HSCT. W zależności od typu ostrej białaczki, wykonano 67 przeszczepień u pacjentów z ostrą białaczką limfoblastyczną (ang. acute lymphoblastic leukemia – ALL) oraz 47 u pacjentów z ostrą białaczką mieloblastyczną (ang. acute myeloblastic leukemia – AML).
Analizowano występowanie oraz leczenie IFI. W oparciu o kryteria EORTC/MSG (European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group) w zależności od precyzji diagnostyki przyjęto definicje i podział inwazyjnych grzybic na: możliwe (possible), prawdopodobne (probable) i potwierdzone (proven) (tab. 1) (4, 5).
Tabela 1. Kryteria rozpoznania IFI wg EORTC/MSG.
| Zakażenia | Kryteria |
| Potwierdzone (proven) | Dodatni wynik badania histologicznego lub hodowli z materiału biopsyjnego lub z płynu biologicznego, sterylnego w warunkach prawidłowych (z wyjątkiem BAL – bronchio-alveolar lavage) |
| Prawdopodobne (probable) | Kryterium mikologiczne (markery grzybicze) ORAZ kryterium radiologiczne |
| Możliwe (possible) | Kryterium mikologiczne (markery grzybicze) LUB kryterium radiologiczne |
Przyjęto definicje strategii diagnostyczno-terapeutycznej inwazyjnych zakażeń grzybiczych: leczenia profilaktycznego, leczenia empirycznego, leczenia wyprzedzającego i leczenia celowanego (6). Profilaktyka przeciwgrzybicza to podawanie leków przeciwgrzybiczych u pacjentów z obecnymi czynnikami ryzyka. Terapia empiryczna to podawanie leków przeciwgrzybiczych u pacjentów z neutropenią z przetrwałą lub nawrotową gorączką, pomimo podaży szerokospektralnych antybiotyków. Leczenie wyprzedzające to podawanie leków przeciwgrzybiczych u pacjentów z neutropenią oraz specyficznym obrazem klinicznym (np. grzybicze zapalenie płuc) i/lub biologicznymi markerami inwazyjnej choroby grzybiczej (np. galaktomannan). Leczenie celowane to podawanie leków przeciwgrzybiczych u pacjentów z rozpoznaniem potwierdzonym inwazyjnej choroby grzybiczej.
Kryteria efektywności terapii przeciwgrzybiczej: skuteczna terapia wyjściowego IFI, nieobecność IFI z przełamania oraz przeżycie > 7 dni po zakończeniu terapii przeciwgrzybiczej (7-10).
Analiza statystyczna
Częstości zakażeń porównano testem chi-kwadrat lub testem Fishera, z uwzględnieniem ilorazu szans (ang. odds ratio – OR) oraz 95% przedziału ufności (ang. confidence interval – CI). Częstości kumulacyjne występowania zakażeń oraz śmiertelność zależną od infekcji wirusowej (ang. infection-related mortality – IRM) wyznaczono metodą Kaplana-Meiera i porównano testem log-rank. Ryzyko wystąpienia zakażenia określono w modelu Coxa.
Wyniki
Bezwzględne liczby zakażeń
W okresie kolejnych 24 miesięcy w pięciu ośrodkach transplantacyjnych stwierdzono 126 IFI, w tym 13 zakażeń potwierdzonych, 48 prawdopodobnych i 55 możliwych. Wiek pacjentów w momencie przeprowadzenia HSCT wynosił 0,2-22 lat (mediana 9,8 roku). Mediana czasu od HSCT do rozpoznania IFI wynosiła 1 miesiąc (zakres od 0 do 17 miesięcy).
Większość IFI rozwinęła się we wczesnym okresie poprzeszczepowym. Do dnia +30 wystąpiło 50% wszystkich zakażeń, a w pierwszych 12 miesiącach po HSCT – 96% IFI (ryc. 1A). Uwzględniając wszystkie przeszczepienia, częstość zakażeń w pierwszym miesiącu wnosiła 11,7% (36/308), a w pierwszym roku 23,4% (72/308). Tyko 4% IFI wystąpiło w okresie późniejszym niż 1 rok po przeszczepieniu. Stwierdzono tendencję do wcześniejszego rozpoznawania zakażeń możliwych oraz prawdopodobnych (ryc. 1B).
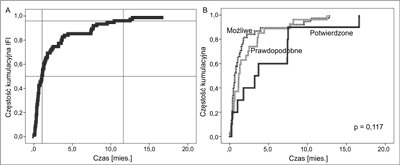
Ryc. 1. Czas od dnia przeszczepienia do rozpoznania inwazyjnego zakażenia grzybiczego: (A) łącznie, (B) w zależności od poziomu rozpoznania IFI.
W roku 2013 nastąpił wzrost bezwzględnej liczby rozpoznanych IFI: łącznie 71 vs. 45, w tym IFI potwierdzone – 10 vs. 3, prawdopodobne – 32 vs. 16 oraz możliwe – 29 vs. 26, w stosunku do roku 2012. Wzrost liczby IFI dotyczył allo-HSCT (65 vs. 38), lecz nie auto-HSCT (6 vs. 7). Połowa IFI (58/116) wystąpiła u pacjentów z ostrymi białaczkami, wśród których również nastąpił niewielki wzrost bezwzględnej liczby rozpoznań IFI w ALL (17 vs. 13) i w AML (16 vs. 12). W zależności od poziomu rozpoznania, u pacjentów z ALL w całym dwuletnim okresie stwierdzono 5 IFI potwierdzonych, 11 prawdopodobnych i 14 możliwych, natomiast wśród pacjentów z AML stwierdzono 3 IFI potwierdzone, 9 prawdopodobnych i 16 możliwych.
Częstości zakażeń
Inwazyjne zakażenia grzybicze wystąpiły łącznie u 89 pacjentów. Pięciu, u których HSCT wykonano przed 2012 r., wykluczono z dalszej analizy. U 27/89 (30,3%) pacjentów wystąpiły nawroty IFI. Częstość IFI u pacjentów, którzy mieli wykonane HSCT w okresie 1.01.2012-31.12.2013 r. wyniosła 27,3% (84/308), a w zależności od poziomu rozpoznania stwierdzono 11 (3,7%) IFI potwierdzonych, 29 (9,4%) prawdopodobnych i 44 (14,3%) możliwych (ryc. 2). U niektórych pacjentów stawiano więcej niż jedno rozpoznanie, w różnych fazach terapii.
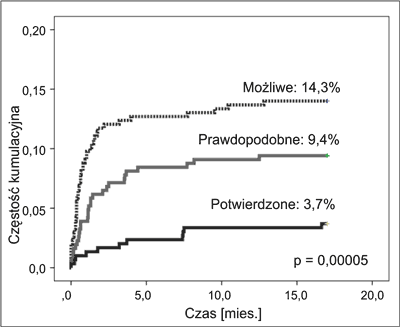
Ryc. 2. Częstość kumulacyjna IFI po przeszczepieniu w zależności od poziomu rozpoznania.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Pasquini MC, Wang Z: Current use and outcome of hematopoietic stem cell transplantation: CIBMTR Summary Slides. Available at: http://www.cibmtr.org 2013.
2. Srinivasan A, Wang C, Srivastava DK et al.: Timeline, epidemiology, and risk factors for bacterial, fungal, and viral infections in children and adolescents after allogeneic hematopoietic stem cell transplantation. Biol Blood Marrow Transplant 2013; 19: 94-101.
3. Srinivasan A, McLaughlin L, Wang C et al.: Early infections after autologous hematopoietic stem cell transplantation in children and adolescents: the St. Jude experience. Transpl Infect Dis 2014; 16: 90-97.
4. Ascioglu S, Rex JH, de Pauw B et al.: Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus. Clin Infect Dis 2002; 34: 7-14.
5. De Pauw B, Walsh TJ, Donnelly JP et al.: Revised definitions of invasive fungal disease from the European Organization for Research and Treatment of Cancer/Invasive Fungal Infections Cooperative Group and the National Institute of Allergy and Infectious Diseases Mycoses Study Group (EORTC/MSG) Consensus Group. Clin Infect Dis 2008; 46: 1813-1821.
6. Styczyński J, Gil L: Inwazyjna aspergilloza u dzieci po transplantacji komórek hematopoetycznych. Współcz Onkol 2010; 14: 44-53.
7. Walsh TJ, Finberg RW, Arndt C et al.: Liposomal amphotericin B for empirical therapy in patients with persistent fever and neutropenia. National Institute of Allergy and Infectious Diseases Mycoses Study Group. N Engl J Med 1999; 340: 764-771.
8. Maertens J, Marchetti O, Herbrecht R et al.: European guidelines for antifungal management in leukemia and hematopoietic stem cell transplant recipients: summary of the ECIL 3 – 2009 update. Bone Marrow Transplant 2011; 46: 709-718.
9. Kobayashi R, Suzuki N, Yoshida M et al.: Efficacy and safety of micafungin for febrile neutropenia in pediatric patients with hematological malignancies: a multicenter prospective study. J Pediatr Hematol Oncol 2013; 35: e276-279.
10. Racil Z, Toskova M, Kocmanova I et al.: Micafungin as empirical antifungal therapy in hematological patients: a retrospective, multicenter study in the Czech and Slovak Republics. Leuk Lymphoma 2013; 54: 1042-1047.
11. Styczyński J, Gil L: Prevention of infectious complications in pediatric HSCT. Bone Marrow Transplant 2008; 42 (suppl. 2): S77-81.
12. Groll AH, Castagnola E, Cesaro S et al.: Fourth European Conference on Infections in Leukaemia (ECIL-4): guidelines for diagnosis, prevention, and treatment of invasive fungal diseases in paediatric patients with cancer or allogeneic haemopoietic stem-cell transplantation. Lancet Oncol 2014; 15: e327-340.
13. Rubio PM, Sevilla J, Gonzalez-Vicent M et al.: Increasing incidence of invasive aspergillosis in pediatric hematology oncology patients over the last decade: a retrospective single centre study. J Pediatr Hematol Oncol 2009; 31: 642-646.
14. Hol JA, Wolfs TF, Bierings MB et al.: Predictors of invasive fungal infection in pediatric allogeneic hematopoietic SCT recipients. Bone Marrow Transplant 2014; 49: 95-101.
15. Hale KA, Shaw PJ, Dalla-Pozza L et al.: Epidemiology of paediatric invasive fungal infections and a case-control study of risk factors in acute leukaemia or post stem cell transplant. Br J Haematol 2010; 149: 263-272.
16. Kurosawa M, Yonezumi M, Hashino S et al.: Epidemiology and treatment outcome of invasive fungal infections in patients with hematological malignancies. Int J Hematol 2012; 96: 748-757.
17. Nucci M, Garnica M, Gloria AB et al.: Invasive fungal diseases in haematopoietic cell transplant recipients and in patients with acute myeloid leukaemia or myelodysplasia in Brazil. Clin Microbiol Infect 2013; 19: 745-751.
18. Kontoyiannis DP, Marr KA, Park BJ et al.: Prospective surveillance for invasive fungal infections in hematopoietic stem cell transplant recipients, 2001-2006: overview of the Transplant-Associated Infection Surveillance Network (TRANSNET) Database. Clin Infect Dis 2010; 50: 1091-1100.
19. Herbrecht R, Caillot D, Cordonnier C et al.: Indications and outcomes of antifungal therapy in French patients with haematological conditions or recipients of haematopoietic stem cell transplantation. J Antimicrob Chemother 2012; 67: 2731-2738.
20. Styczyński J: Diagnostyka i leczenie inwazyjnych zakażeń grzybiczych u dzieci: rekomendacje pediatrycznej grupy ECIL4. Zakażenia 2012; 12: 73-82.


