© Borgis - Postępy Fitoterapii 2/2016, s. 111-118
Marta Kula, *Mirosława Krauze-Baranowska
Jagoda kamczacka (Lonicera caerulea L.) – aktualny stan badań fitochemicznych i aktywności biologicznej
Blue-berried honeysuckle fruits (Lonicera caerulea L.) – current status of phytochemical and biological activity investigations
Katedra i Zakład Farmakognozji z Ogrodem Roślin Leczniczych, Wydział Farmaceutyczny z Oddziałem Medycyny Laboratoryjnej, Gdański Uniwersytet Medyczny
Kierownik Katedry i Zakładu: prof. dr hab. n. farm. Mirosława Krauze-Baranowska
Summary
Blue-berried honeysuckle fruits (Lonicera caerulea L.), in Poland commonly named “kamchatka berry”, have been known for centuries in folk medicine of Russia, China and Japan, and are also used as a food product. Phytochemical analysis of different cultivars suggests that the honeysuckle fruits are one of the richest sources of anthocyanins among berry fruits. Antoxidant activity research reveals strong antioxidant properties of L. caerulea fruit extracts and they are often higher than those displayed by berries commonly thought to be effective antioxidants. Biological activities displayed by the fruit are strongly associated with their high antioxidant capacity and include anti-inflammatory, radioprotective and anti-diabetic activities. Antimicrobial activities of the fruit extracts have also been reported. Compared to other berries, the number of biological activity research on the blue-berried honeysuckle is relatively low. Research conducted up to date on the blue-berried honeysuckle, including some of the Polish national varieties, indicates their potential in civilization diseases prevention, however this needs to be verified in a greater number of clinical trials.

Wstęp
Prozdrowotne właściwości i rola w zapobieganiu chorobom cywilizacyjnym decydują o wzrastającym zainteresowaniu surowcami leczniczymi pochodzenia roślinnego. Poszukiwania nowych surowców o działaniu terapeutycznym, często inspirowane medycyną tradycyjną, obejmują badania składu chemicznego i aktywności biologicznej.
Wiciokrzew siny (Lonicera caerulea L.) (Capri-foliaceae) jest rośliną znaną od wieków w medycynie ludowej północnej Rosji, Chin oraz Japonii. Owoce nazywane są „eliksirem życia” przez tubylczy lud Ajnów, zamieszkujący wyspę Hokkaido (1). Kwiaty, liście, gałęzie oraz kora są surowcami pozyskiwanymi z regionalnych gatunków rodzaju Lonicera jako remedia o działaniu moczopędnym (gałęzie), przeciwprzeziębieniowym (kwiaty), czy też przeciwzapalnym, w zakażeniach gardła i stanach zapalnych oczu (liście). Jednak tylko dla owoców L. caerulea wykazano szerokie spektrum właściwości leczniczych. Są one wykorzystywane w medycynie ludowej jako surowiec wzmacniający, o działaniu hipotensyjnym i obniżającym ryzyko zawału serca, zapobiegający anemii, spowalniający rozwój jaskry, jako lek przeciwmalaryczny, pomocny w chorobach układu pokarmowego oraz zakażeniach bakteryjnych (2). Natomiast zastosowanie owoców wiciokrzewu sinego w przemyśle spożywczym obejmuje produkcję dżemów, wina, słodyczy i jogurtów, z przeznaczeniem głównie na rynek japoński. Ograniczeniem zwiększenia produkcji przemysłowej owoców są wysokie koszty ich pozyskiwania, związane z ręcznym zbiorem (możliwości zbioru mechanicznego są ograniczone) (3).
Celem pracy jest przedstawienie obecnego stanu wiedzy o składzie chemicznym, kierunkach aktywności biologicznej i potencjalnych właściwościach prozdrowotnych owoców wiciokrzewu sinego.
Opis botaniczny
Lonicera caerulea L. (ryc. 1) jest suchodrzewem należącym do rodziny Przewiertniowatych (Caprifoli-aceae) i jednym ze 180 gatunków krzewów należących do rodzaju Lonicera, szeroko rozprzestrzenionych na półkuli północnej, głównie w strefie klimatu umiarkowanie chłodnego. Występuje w północnej Rosji, Chinach i Japonii. Uprawiana jest jako roślina użytkowa o jadalnych owocach i roślina lecznicza, stanowiąca źródło surowców stosowanych w medycynie tradycyjnej (4). W Europie, w środowisku naturalnym, jest spotykana na terenie Alp oraz w Skandynawii. W Ameryce Północnej i Europie wciąż jest mało znana, jakkolwiek owoce L. caerulea w ciągu ostatnich lat stopniowo zyskują popularność (5).

Ryc. 1. Jagoda kamczacka (źródło: internet)
Lonicera caerulea ma liczne odmiany, z których kilka jest szeroko uprawianych, m.in. pochodzące z Rosji – L. caerulea var. edulis, L. caerulea var. kamtshatica, L. caerulea var. altaica, L. caerulea var. boczkarnikovae oraz z wyspy Hokkaido z Japonii – L. caerulea var. emphyllocalyx (6). Do Polski odmianę L. caerulea var. edulis sprowadzono z Rosji około 30 lat temu i obecnie stanowi ona obiekt zainteresowania prywatnych hodowców oraz instytutów hodowlanych. W Polsce opracowano szereg odmian krajowych, do których należą m.in. Wojtek, Brązowa i Zielona (7).
Krzewy osiągają od 0,8 do 3 metrów wysokości, są długowieczne i mogą przeżyć od 25 do 30 lat. Rosną na glebach piaszczystych bądź też gliniastych, których pH może wahać się od 5 do 7 (4). Charakteryzują się wysoką odpornością na mrozy, nawet dochodzące do temperatury -46°C (8), są również bardzo odporne na choroby i szkodniki (2). Krzewy są obcopylne i zaczynają owocować po roku od założenia uprawy, na przełomie maja i czerwca. Po 3 latach osiąga się plony – ok. 500 g owoców z jednej rośliny. Jagody są koloru ciemnoniebieskiego bądź ciemnofioletowego, wielkości od 1,5 do 3 cm i wadze 0,6-2 g. Kształt owoców jest różny, najczęściej cylindryczny, koloru granatowego z woskowym nalotem (2, 4).
Problemy w botanicznej klasyfikacji gatunku L. caerulea wynikają z faktu opisywania niektórych odmian jako innych gatunków (np. L. caerulea var. edulis jako L. edulis) oraz stosowania szeregu nazw synonimicznych jak „haskap”, „jagoda kamczacka” czy „suchodrzew jadalny” dla odmiennych gatunków (4). Nazwa „haskap” (znana również jako „zimolost”) w Rosji oznacza przeważnie odmiany L. caerulea var. kamtshatica, L. caerulea var. edulis i L. caerulea var. boczkarnikovae, podczas gdy w Japonii nazywana jest tak odmiana L. caerulea var. emphyllocalix (6). W Polsce, choć popularnie funkcjonuje nazwa „jagoda kamczacka”, to opracowane krajowe odmiany hodowlane pochodzą z L. caerulea var. edulis. Klasyfikacja botaniczna wiciokrzewu sinego została przedstawiona na rycinie 2.
| Lonicera caerulea: | |
| Królestwo | Plantae |
| Podkrólestwo | Tracheophyta – Naczyniowe |
| Klad | Spermatophyta – Nasienne |
| Klasa | Magnoliophyta – Okrytonasienne |
| Klad | Asteridae – Astrowe |
| Rząd | Dipsacales – Szczeciowce |
| Rodzina | Caprifoliaceae – Przewiertniowate |
| Rodzaj | Lonicera L. – Wiciokrzew |
| Gatunek | Lonicera caerulea – Wiciokrzew siny |
Ryc. 2. Klasyfikacja botaniczna wiciokrzewu sinego
Skład chemiczny
Owoce jagodowe uważane są za jedno z najważniejszych i najbogatszych źródeł związków fenolowych w codziennej diecie, takich jak antocyjany, flawonoidy, proantocyjanidyny oraz kwasy fenolowe (9). Aktywność biologiczna polifenoli i prostych fenoli obejmuje głównie działanie przeciwutleniające oraz przeciwzapalne (10), przeciwbakteryjne (11), chemoochronne (12) oraz zapobiegawcze w chorobie niedokrwiennej serca (13).
Wykazano, że skład chemiczny owoców L. caerulea jest zależny od stopnia dojrzałości oraz warunków przechowywania (4). Badania polskich odmian wiciokrzewów ujawniły, że dojrzałe owoce z końca sezonu charakteryzują się wyższą zawartością związków fenolowych (zwłaszcza antocyjanów), ale niższą kwasowością oraz zawartością witaminy C (14). Interesującym jest fakt, że warunki uprawy (rodzaj gleby oraz sposób nawożenia) nie mają wpływu na zawartość metabolitów wtórnych w owocach wiciokrzewu (15), co powoduje, że owoce pochodzące z różnych ośrodków hodowlanych charakteryzują się bardzo podobnymi profilami związków czynnych (16).
Stosując metodę Folina-Ciocalteau (F-C) oznaczono całkowitą zawartość fenoli w owocach L. caerulea mieszczącą się w zakresie od 140,5 do 1142 mg ekwiwalentów kwasu galusowego (GAE) na 100 g świeżej masy (ś.m.) (7, 17-22). Są to wartości wielokrotnie wyższe w porównaniu do innych owoców jagodowych, takich jak owoce truskawki (238,0 mg GAE/100 g ś.m.) (23), maliny czerwonej (455,5 mg GAE/100 g ś.m.) (18) czy owoce gatunku Vaccinium virgatum – borówki z południowo-wschodnich terenów Ameryki Północnej (330,0 mg GAE/100 g ś.m.) (24).
Oznaczając całkowitą zawartość antocyjanów spektrofotometryczną metodą różnicową (25), wykazano, że zawartość tych związków w owocach L. caerulea wynosi 1300 mg ekwiwalentów 3-O-glukozydu cyjanidyny (ryc. 3) (CE)/100 g ś.m. (18, 20). W porównaniu do wartości otrzymanych dla innych popularnych w Europie owoców jagodowych stanowiących źródło antocyjanów, takich jak owoce maliny czerwonej (22,2-436,9 CE/100 g ś.m.) (26), maliny czarnej (125,6-152,2 CE/100 g ś.m.), czerwonej porzeczki (1,4-7,8 CE/100 g ś.m.) (27) czy borówki wysokiej (99,9 CE/100 g ś.m.) (28), L. caerulea zawiera wielokrotnie wyższe stężenia antocyjanów.
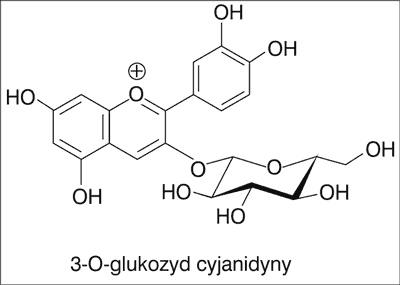
Ryc. 3. Wzór chemiczny 3-O-glukozydu cyjanidyny
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Thompson MM. Introducing Haskap, Japanese blue honeysuckle. J Am Pomolog Soc 2006; 60(4):164-8. 2. Celli GB, Ghanem A, Brooks MSL. Haskap berries (Lonicera caerulea L.) – a critical review of antioxidant capacity and health-related studies for potential value-added products. Food Bioprocess Technol 2014; 7(6):1541-54. 3. Liu C, Zheng X, Shi J i wsp. Optimising microwave vacuum puffing for blue honeysuckle snacks. Intern J Food Sci Technol 2010; 45(3):506-11. 4. Svarcova I, Heinrich J, Valentova K. Berry fruits as a source of biologically active compounds: the case of Lonicera caerulea. Biomedical papers of the Medical Faculty of the University Palacký, Olomouc, Czechoslovakia 2007; 151(2):163-74. 5. Hummer KE. Blue honeysuckle: A new berry crop for North America. J Am Pomol Soc 2006; 60(1):3-8. 6. Thompson MM, Barney DL. Evaluation and breeding of haskap in North America. J Am Pomol Soc 2007; 61(1):25-33. 7. Skupień K, Oszmiański L, Ochmian I i wsp. Characterization of selected physico-chemical features of blue honeysuckle fruit cultivar „Zielona”. Pol J Natural Sci 2007; 4:101-7. 8. Plekhanova MN. Blue honeysuckle (Lonicera caerulea L.) – A new commercial berry crop for temperate climate: Genetic resources and breeding. Acta Horticult 2000; 159-64. 9. Fukumoto LR, Mazza G. Assessing antioxidant and prooxidant activities of phenolic compounds. J Agric Food Chem 2000; 48(8):3597-604. 10. Middleton JE. Effect of plant flavonoids on immune and inflammatory cell function. Adv Exper Med Biol 1998; 175-82. 11. Puupponen-Pimiä R, Nohynek L, Meier C i wsp. Antimicrobial properties of phenolic compounds from berries. J Appl Microbiol 2001; 90(4):494-507. 12. Doll R. An overview of the epidemiological evidence linking diet and cancer. Proc Nutr Soc 1990; 49(2):119-31. 13. Armstrong BK, Mann JI, Adelstein AM i wsp. Commodity consumption and ischemic heart disease mortality, with special reference to dietary practices. J Chron Dis 1975; 28(9):455-69. 14. Ochmian I, Smolik M, Dobrowolska A i wsp. The influence of harvest date on fruit quality of several cultivars of blue honeysuckle berries. Electron J Polish Agricult Univ 2013; 16(1):1. 15. Szot I, Wieniarska J. Effect of foliar applications of Goëmar® BM 86 and soil applied calcium nitrate on yield and berry quality of two blue honeysuckle cultivars. Acta Scient Polon Hortor Cult 2012; 11(1):133-44. 16. Kusznierewicz B, Piekarska A, Mrugalska B i wsp. Phenolic composition and antioxidant properties of polish blue-berried honeysuckle genotypes by HPLC-DAD-MS, HPLC postcolumn derivatization with ABTS or FC, and TLC with DPPH visualization. J Agric Food Chem 2012; 60(7):1755-63. 17. Thompson MM, Chaovanalikit A. Preliminary observations on adaptation and nutraceutical values of blue honeysuckle (Lonicera caerulea) in Oregon, USA. Acta Horticult 2003; 65-72. 18. Bakowska-Barczak AM, Marianchuk M, Kolodziejczyk P. Survey of bioactive components in Western Canadian berries. Canad J Physiol Pharmacol 2007; 85(11):1139-52. 19. Palíková I, Heinrich J, Bednář P i wsp. Constituents and antimicrobial properties of blue honeysuckle: A novel source for phenolic antioxidants. J Agric Food Chem 2008; 56(24):11883-9. 20. Lefèvre I, Ziebel J, Guignard C i wsp. Evaluation and comparison of nutritional quality and bioactive compounds of berry fruits from Lonicera caerulea, Ribes L. species and Rubus idaeus grown in Russia. J Berry Res 2011; 1(3):159-67. 21. Rop O, Řezníček V, Mlček J i wsp. Antioxidant and radical oxygen species scavenging activities of 12 cultivars of blue honeysuckle fruit. Horticult Sci 2011; 38(2):63-70. 22. Rupasinghe HPV, Yu LJ, Bhullar KS i wsp. Haskap (Lonicera caerulea): A new berry crop with high antioxidant capacity. Canad J Plant Sci 2012; 92(7):1311-7. 23. Vasco C, Ruales J, Kamal-Eldin A. Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Food Chem 2008; 111(4):816-23. 24. You Q, Wang B, Chen F i wsp. Comparison of anthocyanins and phenolics in organically and conventionally grown blueberries in selected cultivars. Food Chem 2011; 125(1):201-8. 25. Lee J, Durst RW, Wrolstad RE. Determination of total monomeric anthocyanin pigment content of fruit juices, beverages, natural colorants, and wines by the pH differential method: collaborative study. J AOAC Int 2005; 88(5):1269-78. 26. Chen L, Xin X, Zhang H i wsp. Phytochemical properties and antioxidant capacities of commercial raspberry varieties. J Functional Foods 2013; 5(1):508-15. 27. Pantelidis GE, Vasilakakis M, Manganaris GA i wsp. Antioxidant capacity, phenol, anthocyanin and ascorbic acid contents in raspberries, blackberries, red currants, gooseberries and Cornelian cherries. Food Chem 2007; 102(3):777-83. 28. Skrede G, Wrolstad RE, Durst RW. Changes in anthocyanins and polyphenolics during juice processing of highbush blueberries (Vaccinium corymbosum L.). J Food Sci 2000; 65(2):357-64. 29. Zadernowski R, Naczk M, Nesterowicz J. Phenolic acid profiles in some small berries. J Agric Food Chem 2005; 53(6):2118-24. 30. Kula M, Majdan M, Radwańska A i wsp. Chemical composition and biological activity of the fruits from Lonicera caerulea var edulis “Wojtek”. Acad J Med Plants 2013; 1(8):141-8. 31. Gao W, Yang H, Qi LW i wsp. Unbiased metabolite profiling by liquid chromatography-quadrupole time-of-flight mass spectrometry and multivariate data analysis for herbal authentication: Classification of seven Lonicera species flower buds. J Chromatogr A 2012; 1245:109-16. 32. Qi LW, Chen CY, Li P. Structural characterization and identification of iridoid glycosides, saponins, phenolic acids and flavonoids in Flos Lonicerae Japonicae by a fast liquid chromatography method with diode-array detection and time-of-flight mass spectrometry. Rapid Commu Mass Spectrom 2009; 23(19):3227-42. 33. Anikina EV, Syrchina AI, Vereshchagin AL i wsp. Bitter iridoid glucoside from the fruit of Lonicera caerulea. Chem Nat Comp 1988; 24(4):512-3. 34. Szeto YT, Tomlinson B, Benzie IFF. Total antioxidant and ascorbic acid content of fresh fruits and vegetables: Implications for dietary planning and food preservation. Brit J Nutr 2002; 87(1):55-9. 35. Nishiyama I, Yamashita Y, Yamanaka M i wsp. Varietal difference in vitamin C content in the fruit of kiwifruit and other Actinidia species. J Agric Food Chem 2004; 52(17):5472-5. 36. Gazdik Z, Krska B, Adam V i wsp. Electrochemical determination of the antioxidant potential of some less common fruit species. Sensors 2008; 8(12):7564-70. 37. Deineka VI, Sorokopudov VN, Deineka LA i wsp. Anthocyanins from fruit of some plants of the Caprifoliaceae family. Chem Nat Comp 2005; 41(2):162-4. 38. Chaovanalikit A, Thompson MM, Wrolstad RE. Characterization and quantification of anthocyanins and polyphenolics in blue honeysuckle (Lonicera caerulea L.). J Agric Food Chem 2004; 52(4):848-52. 39. Reuter S, Gupta SC, Chaturvedi MM i wsp. Oxidative stress, inflammation, and cancer: How are they linked? Free Radical Biol Med 2010; 49(11):1603-16. 40. Robards K, Prenzler PD, Tucker G i wsp. Phenolic compounds and their role in oxidative processes in fruits. Food Chem 1999; 66(4):401-36. 41. Cybul M, Nowak R. Przegląd metod stosowanych w analizie właściwości antyoksydacyjnych wyciągów roślinnych. Herba Pol 2008; 54(1):68-78. 42. Cao G, Alessio HM, Cutler RG. Oxygen-radical absorbance capacity assay for antioxidants. Free Radical Biol Med 1993; 14(3):303-11. 43. Raudsepp P, Anton D, Roasto M i wsp. The antioxidative and antimicrobial properties of the blue honeysuckle (Lonicera caerulea L.), Siberian rhubarb (Rheum rhaponticum L.) and some other plants, compared to ascorbic acid and sodium nitrite. Food Control 2013; 31(1):129-35. 44. Tural S, Koca I. Physico-chemical and antioxidant properties of cornelian cherry fruits (Cornus mas L.) grown in Turkey. Sci Horticult 2008; 116(4):362-6. 45. Fiorentino A, D’Abrosca B, Pacifico S i wsp. Identification and assessment of antioxidant capacity of phytochemicals from kiwi fruits. J Agric Food Chem 2009; 57(10):4148-55. 46. Barros L, Carvalho AM, Morais JS i wsp. Strawberry-tree, blackthorn and rose fruits: Detailed characterisation in nutrients and phytochemicals with antioxidant properties. Food Chem 2010; 120(1):247-54. 47. Rop O, Mlcek J, Jurikova T i wsp. Phenolic content, antioxidant capacity, radical oxygen species scavenging and lipid peroxidation inhibiting activities of extracts of five black chokeberry (Aronia melanocarpa (Michx.) Elliot) cultivars. J Med Plant Res 2010; 4(22):2431-7. 48. Zulueta A, Esteve MJ, Frígola A. ORAC and TEAC assays comparison to measure the antioxidant capacity of food products. Food Chem 2009; 114(1):310-6. 49. Huang D, Boxin OU, Prior RL. The chemistry behind antioxidant capacity assays. J Agric Food Chem 2005; 53(6):1841-56. 50. Palíková I, Valentová K, Oborná I i wsp. Protectivity of blue honeysuckle extract against oxidative human endothelial cells and rat hepatocyte damage. J Agric Food Chem 2009; 57(15):6584-9. 51. Zdařilová A, Svobodová AR, Chytilová K i wsp. Polyphenolic fraction of Lonicera caerulea L. fruits reduces oxidative stress and inflammatory markers induced by lipopolysaccharide in gingival fibroblasts. Food Chem Toxicol 2010; 48(6):1555-61. 52. Jin XH, Ohgami K, Shiratori K i wsp. Effects of blue honeysuckle (Lonicera caerulea L.) extract on lipopolysaccharide-induced inflammation in vitro and in vivo. Exper Eye Res 2006; 82(5):860-7. 53. Jurgoński A, Juśkiewicz J, Zduńczyk Z. An anthocyanin-rich extract from Kamchatka honeysuckle increases enzymatic activity within the gut and ameliorates abnormal lipid and glucose metabolism in rats. Nutrition 2013; 29(6):898-902. 54. Zhao H, Wang Z, Ma F i wsp. Protective effect of anthocyanin from Lonicera caerulea var. edulis on radiation-induced damage in mice. Inter J Molecular Sci 2012; 13(9):11773-82. 55. Svobodová A, Zdařilová A, Vostálová J. Lonicera caerulea and Vaccinium myrtillus fruit polyphenols protect HaCaT keratinocytes against UVB-induced phototoxic stress and DNA damage. J Dermatol Sci 2009; 56(3):196-204. 56. Svobodová A, Rambousková J, Walterová D i wsp. Protective effects of phenolic fraction of blue honeysuckle fruits against UVA-induced damage to human keratinocytes. Archiv Dermatol Res 2008; 300(5):225-33. 57. Rajnochová Svobodová A, Galandáková A i wsp. Effects of oral administration of Lonicera caerulea berries on UVB-induced damage in SKH-1 mice. A pilot study. Photochem Photobiol Sci 2013; 12(10):1830-40. 58. Lundquist S, Renftel M. The use of in vitro cell culture models for mechanistic studies and as permeability screens for the blood-brain barrier in the pharmaceutical industry – Background and current status in the drug discovery process. Vasc Pharmacol 2002; 38(6):355-64. 59. Williams RJ, Spencer JPE, Rice-Evans C. Flavonoids: Antioxidants or signalling molecules? Free Radical Biol Med 2004; 36(7):838-49. 60. Heinrich J, Valentová K, Vacek J i wsp. Metabolic profiling of phenolic acids and oxidative stress markers after consumption of Lonicera caerulea L. fruit. J Agric Food Chem 2013; 61(19):4526-32.


