© Borgis - Nowa Stomatologia 1/2006, s. 42-46
*Jan Kowalski, Magdalena Dragan
Wpływ czynników miejscowych i ogólnoustrojowych na stan kliniczny tkanek przyzębia. Opis dwóch przypadków
The influence of local and systemic factors on the clinical state of periodontal tissues. Report of two cases
z Zakładu Chorób Błony Śluzowej i Przyzębia Instytutu Stomatologii AM w Warszawie
Kierownik Zakładu: prof. dr. hab. Renata Górska

Wstęp
Choroba przyzębia jest wynikiem jakościowego i ilościowego zachwiania równowagi ekosystemu kieszonki przyzębnej. Wydolnie działający system immunologiczny gospodarza zapobiega przejściu stanu zapalnego dziąseł w zapalenie przyzębia. Istnieje szereg wyznaczników i czynników modyfikujących działanie układu odpornościowego, które wpływają na zapoczątkowanie choroby, a także warunkują jej leczenie. Efektywne leczenie periodontitis powinno uwzględniać także identyfikację czynników miejscowych i ogólnych oraz – w miarę możliwości – ich efektywną minimalizację lub eliminację. Nieustanne zakażanie kieszonki dziąsłowej przez bakterie kolonizujące czyni proces leczniczy całkowicie zależnym od współpracy pacjenta. Nie jest możliwe wyleczenie tkanek przyzębia bez wspomnianego powyżej leczenia przyczynowego, ale niezbędne są także silna motywacja (leczenie choroby przyzębia trwa czasem latami) i kontrola płytki bakteryjnej (domowe zabiegi higieniczne, stosowanie się do wskazań przez osobę chorą).
W zaawansowanych stanach chorobowych przyzębia interwencja lekarza periodontologa jest koniecznym, lecz niewystarczającym warunkiem skutecznego zahamowania postępu procesu chorobowego. Nieregularne usuwanie bakterii gromadzących się na powierzchni zębów prowadzi do stopniowego dojrzewania płytki bakteryjnej i – w konsekwencji – pojawiania się w niej Gram-ujemnych pałeczek beztlenowych. Bakterie te szczególnie silnie aktywują układ odpornościowy prowadząc do nieswoistej odpowiedzi immunologicznej, co skutkuje niszczeniem struktur przyzębia. Nasilenie tego procesu może być modyfikowane przez liczne czynniki ogólnoustrojowe, zwane czynnikami ryzyka. Należą do nich między innymi genotyp pacjenta, palenie i stres.
Celem obecnej pracy jest prezentacja retrospektywnej oceny dwóch przypadków pacjentów z chorobą przyzębia obarczonych czynnikami ryzyka.
Opis przypadków i metodyka
Pacjent nr 1, lat 40, zgłosił się do Zakładu Chorób Błony Śluzowej i Przyzębia w listopadzie 1998 roku. Powodem zgłoszenia się była świadomość stanu chorobowego w obrębie tkanek przyzębia. Według przeprowadzonego badania podmiotowego pacjent od kilku lat obserwował krwawienie z dziąseł i zwiększoną ruchomość zębów, zwłaszcza górnych siekaczy bocznych. Dolegliwości te nasiliły się w ostatnich tygodniach. Na podstawie przeprowadzonego badania przedmiotowego i podmiotowego stwierdzono ponadto utratę zębów 14, 36, 37 i 46 na skutek powikłań choroby próchnicowej, próchnicy korzeni i zgorzelinowego rozpadu miazgi. W badaniu przedmiotowym stwierdzono bardzo zły stan higieny jamy ustnej (PlI wg O´Leary = 76%), liczne głębokie kieszonki (odsetek kieszonek głębszych niż 4 mm = 33%), nasilony stan zapalny dziąseł (BI wg Ainamo&Bay = 53%). W obrębie zębów 26, 27, 28 i 38 stwierdzono obnażenie furkacji III stopnia, w obrębie zębów 17 i 47 stwierdzono II stopień obnażenia furkacji. Zęby 12, 22 i 27 wykazywały II stopień rozchwiania wg skali Entina (ryc. 1). Stwierdzono obecność zgryzu urazowego w obrębie zębów 12-22 i 32-42, zęby 16 i 26-28 uległy częściowemu wysunięciu z płaszczyzny zgryzu na skutek braku zębów antagonistycznych. Na podstawie przeprowadzonego badania, biorąc pod uwagę wiek pacjenta i zaawansowanie procesu chorobowego, ustalono wstępne rozpoznanie gwałtownie postępującego zapalenia przyzębia (wg ówcześnie obowiązującej klasyfikacji chorób przyzębia), do potwierdzenia po analizie zdjęć radiologicznych.
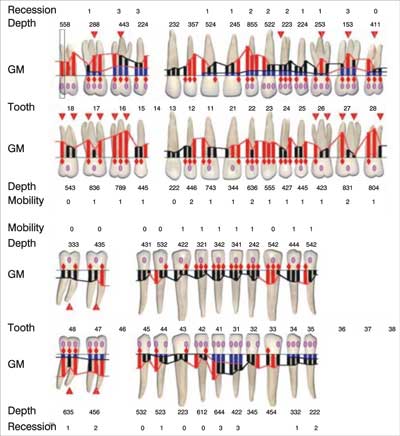
Ryc. 1. Pacjent nr 1 – wynik badania klinicznego.
Pacjent nr 2, mężczyzna urodzony w 1973 roku, zgłosił się do Zakładu Chorób Błony Śluzowej i Przyzębia w czerwcu 1999 roku, skierowany przez lekarza stomatologa w celu konsultacji i podjęcia leczenia. Pacjent zaobserwował krwawienie dziąseł występujące przy szczotkowaniu zębów oraz obnażenie korzenia zęba 33. Badanie kliniczne wykazało niezadowalający stan higieny jamy ustnej (PlI = 53%). W obrębie zębów 16, 14, 11, 21, 25, 26 i 33 stwierdzono recesje dziąsła brzeżnego. Wskaźnik krwawienia był stosunkowo niski (BI = 6%, odsetek kieszonek głębszych niż 4 mm= 2%). Zęby 15, 36 i 46 zostały usunięte z powodu powikłań choroby próchnicowej (ryc. 2). Na podstawie przeprowadzonego badania rozpoznano gwałtownie postępujące zapalenie przyzębia.

Ryc. 2. Pacjent nr 2 – wynik badania klinicznego.
W obu przypadkach ustalono wstępny plan leczenia obejmujący przeprowadzenie fazy wstępnej leczenia przyzębia. W obu przypadkach polecono wykonać zdjęcie pantomograficzne w celu ogólnej oceny stanu narządu żucia oraz potwierdzenia rozpoznania.
Na kolejnej wizycie u pacjenta nr 1 na podstawie zdjęcia RTG potwierdzono rozpoznanie wstępne. Wykonano skaling zębów szczeki i żuchwy, wstępną korektę zgryzu w obrębie zębów siecznych w pozycji zwarcia centralnego, przeprowadzono instruktaż higieny jamy ustnej. Na kolejne wizyty zaplanowano kontynuację korekty zgryzu. Poinformowano pacjenta o konieczności leczenia ubytków próchnicowych w zębach 16, 26, 27, 35 i 45. Po uzgodnieniu z pacjentem strategii postępowania polegającej na próbie utrzymania w jamie ustnej maksymalnej ilości zębów własnych zalecono leczenie endodontyczne zębów 16, 12 i 22, przed zabiegami chirurgicznymi na przyzębiu w obrębie tych zębów. Poinformowano o konieczności protetycznego uzupełnienia braków zębowych w celu zrównoważenia warunków zwarciowych. Pacjentowi polecono stawić się na kolejną wizytę po tygodniu, w celu kontynuacji leczenia i oceny higieny. Pacjent na kolejną wizytę nie stawił się.
U pacjenta nr 2 na II wizycie, na podstawie analizy zdjęcia pantomograficznego potwierdzono rozpoznanie wstępne. Wykonano skaling połączony z wygładzeniem korzeni, przeprowadzono instruktaż higieny jamy ustnej, zalecono protetyczne uzupełnienie braków zębowych 15, 36 i 46. Na kolejnych wizytach kontrolnych korygowano błędy w higienie jamy ustnej. Kolejne badanie kliniczne wykonano po 5 miesiącach, w listopadzie 1999 roku. Stwierdzono znaczną poprawę badanych parametrów klinicznych. Wskaźnik płytki zredukowano z 53 do 23%, wskaźnik krwawienia z 6 do 0%. Stwierdzono ponadto znaczną redukcję głębokości kieszonek przy zębach 26 i 33. Były one płytsze niż 4 mm, w porozumieniu z pacjentem zrezygnowano więc z przeprowadzania regeneracyjnych zabiegów chirurgicznych na przyzębiu w obrębie wymienionych zębów, mimo stwierdzonego pionowego ubytku tkanki kostnej. W trakcie 5-miesięcznego okresu kontrolnego pacjent nie uzupełnił braków zębowych, wg pacjenta ze względu na problemy finansowe (pacjent szukał pracy). Poinformowano pacjenta o skutkach pozostawienia nieuzupełnionych braków zębowych i polecono stawić się na wizytę kontrolną po 3 miesiącach. Pacjent na wizytę kontrolną nie stawił się.
Pacjenci zgłosili się ponownie do Zakładu we wrześniu 2005 roku.
Pacjent nr 1 swoją nieobecność usprawiedliwiał kłopotami rodzinnymi. Ponadto zaobserwował pogorszenie stanu miejscowego.
Pacjent nr 2 przyjechał do Polski po 4-letnim pobycie za granicą. W obecnym miejscu zamieszkania jest pod opieką lekarza stomatologa. W badaniu klinicznym stwierdzono u pacjenta złogi kamienia naddziąsłowego i ciemnobrązowy osad nazębny pokrywający dużą powierzchnię koron zębów, charakterystyczny dla palaczy. Pacjent przyznał, że rok temu zaczął palić około 5 papierosów dziennie. Zwrócono pacjentowi uwagę na znaczenie palenia w etiopatologii choroby przyzębia, udzielono wskazań higienicznych, zalecono rzucenie lub przynajmniej ograniczenie nałogu i częstsze zgłaszanie się w miejscu zamieszkania na wizyty kontrolne.
U obu pacjentów przeprowadzono badanie genetyczne i mikrobiologiczne. W badaniu genetycznym użyto gotowych zestawów Genotype PST firmy Hain Lifescience. Test ten pozwala na wykrycie polimorfizmu genów kodujących IL-1a i IL-1b (odpowiednio IL-1A i IL-1B). Polegał na pobraniu wymazu komórek nabłonkowych z błony śluzowej policzka. Komórki pobiera się pocierając przez około 10 sekund specjalną gąbką po uprzednio osuszonej strumieniem powietrza śluzówce policzka. Gąbkę umieszczano w specjalnym pojemniku i wysyłano do laboratorium, które identyfikowało genotyp osoby badanej.
Badanie flory bakteryjnej przeprowadzono przy użyciu testu Perio-Analyse firmy Pierre-Fabre Medicament. Test ten korzystając z techniki PCR (reakcja łańcuchowej polimerazy) identyfikuje DNA podstawowych patogenów bakteryjnych tkanek przyzębia: Actinobacillus actinomycetemcomitans, Tanerella forsythensis, Campylobacter rectus, Treponema denticola, Eikenella corrodens, Prevotella intermedia, Peptostreptococcus micros, Porphyromonas gingivalis i Fusobacterium nucleatum. Badanie polegało na umieszczeniu na 15 sekund w kieszonce dziąsłowej/przyzębnej sączka papierowego. Sączek po włożeniu do specjalnego pojemnika wysyłano do laboratorium. Pracownia po seryjnej amplifikacji DNA szacowała liczebność wymienionych powyżej bakterii w dostarczonej próbce. Liczebności w zakresie 105 określano jako „małe”, w zakresie 106 i 107 jako „średnie”, 108 i wyższe jako „duże”.
Omówienie wyników
Przeprowadzone badanie genetyczne wykazało genotyp sprzyjający chorobie przyzębia u Pacjenta nr 1. Oznacza to występowanie tzw. allelów 2 (rzadszych w populacji (zarówno w lokacji IL-1A, jak i IL-1B. Według licznych badań oznacza to zwiększenie podatności na chorobę przyzębia (1-7).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Mark L.L., et al.: Effect of the interleukin-1 genotype on monocyte IL-1beta expression in subjects with adult periodontitis. J. Periodontal. Res., 2000; 35: 172-177. 2. di Giovine FS, et al.: Novel genetic association of an IL-1B gene variation a +3953 with IL-1b? protein production and psoriasis [abstract]. Cytokine 1995; 7: 606. 3. Engebretson S.P., et al.: The influence of interleukin gene polymorphism on expression of interleukin-1beta and tumor necrosis factor-alpha in periodontal tissue and gingival crevicular fluid. J. Periodontol., 1999; 70: 567-573. 4.Shirodaria S., et al.: Polymorphisms in the IL-1A gene are correlated with levels of interleukin-1alpha protein in gingival crevicular fluid of teeth with severe periodontal disease. J. Dent. Res., 2000; 79: 1864-1869. 5.Lang N.P., et al.: Effect of interleukin-1 gene polymorphisms on gingival inflammation assessed by bleeding on probing in a periodontal maintenance population. J. Periodontal. Res., 2000; 35: 102-107. 6.Kornman K.S., et al.: The interleukin-1 genotype as a severity factor in adult periodontal disease. J. Clin. Periodontol., 1997; 24: 72-77. 7.McGuire M.K., Nunn M.E.: Prognosis versus actual outcome. IV: the effectiveness of clinical parameters and IL-1 genotype in accurately predicting prognoses and tooth survival J. Periodontol., 1999; 70: 49-56. 8.Dolic M., et al.: Psychosocial factors as risk indicators of periodontitis J. Clin. Periodontol., 2005; 32: 1134-1140. 9.Wimmer G., et al.: Coping with stress: its influence on periodontal therapy J. Periodontol., 2005;7 6: 90-98. 10. Genco R.J., et al.: Relationship of stress, distress and inadequate coping behaviors to periodontal disease J. Periodontol., 1999; 70: 711-723. 11. Genco R.J.: Current view of risk factors for periodontal diseases. J. Periodontol., 1996; 67, Suppl.:1041-1049. 12. Socransky S.S., et al.: Microbial complexes in subgingival plaque. J Clin Periodontol. 1998;25:134-144.


