© Borgis - Postępy Nauk Medycznych 8/2008, s. 541-546
*Urszula Podstawka, Joanna Kopeć-Szlęzak
Komórki dendrytyczne, ich właściwości i pozyskiwanie do zastosowania w immunoterapii nowotworów
Dendritic cells, their properties and generation for cancer immunotherapy
Pracownia Immunofenotypowania, Zakład Diagnostyki Hematologicznej i Transfuzjologicznej Instytutu Hematologii i Transfuzjologii w Warszawie
Kierownik Pracowni Immunofenotypowania: prof. dr hab. med. Joanna Kopeć-Szlęzak
Streszczenie
Komórki dendrytyczne (DC) są wyspecjalizowanymi komórkami prezentującymi antygen, biorącymi udział w odpowiedzi immunologicznej na infekcje oraz w odpowiedzi przeciwnowotworowej. W ostatnich latach w leczeniu nowotworów zaczęto wdrażać immunoterapię czynną z użyciem komórek dendrytycznych. W artykule przedstawiono różne sposoby pozyskiwania DC, metody wprowadzania antygenów nowotworowych do komórek dendrytycznych, a także sposoby podawania szczepionek. Omówiono też interakcje komórek NK-DC i kliniczne zastosowanie komórek DC1NK oraz efekty kliniczne zastosowania szczepionek z komórek dendrytycznych i przyczyny niepowodzeń leczniczych.
Summary
Dendritic cells (DCs) play a crucial role in linking innate and adaptive immunity and in the generation of a protective immune response against both infectious diseases and tumors. During last decade cancer treatment using dendritic cells was developed. This review presents methods for dendritic cells generation, antigen loading methods and route of vaccine administration. Positive NK-DC cell feedback clinical application of DC1NK was discuss. Clinical effectiveness of DCs-based vaccines and reasons of therapeutic failures were presented.

Wstęp
Komórki dendrytyczne (DCs, ang. Dendritic Cells) są wyspecjalizowanymi komórkami prezentującymi antygen (APCs, Antigen Presenting Cells). Odgrywają zasadniczą rolę w indukcji i regulacji odpowiedzi immunologicznej. Tworzą heterogenną populację komórek powstających w szpiku. Wyróżnia się cztery etapy różnicowania komórek dendrytycznych:
1. prekursorowe komórki dendrytyczne – obecne w szpiku,
2. niedojrzałe komórki dendrytyczne – obecne w narządach nielimfatycznych, gotowe do kontaktu z obcym antygenem i przeniesienia go do narządów limfatycznych,
3. migrujące komórki dendrytyczne – obecne w limfie i krwi,
4. dojrzałe komórki dendrytyczne – obecne w narządach limfatycznych, przygotowane do prezentacji antygenu związanego w trakcie pobytu w narządach nielimfatycznych.
W różnicowaniu i proliferacji DC biorą udział GM-CSF, Flt3 ligand i TNF-α oraz SCF i IL-4, natomiast hamuje ich aktywację IL-10.
Do kontaktu komórek dendrytycznych z antygenami dochodzi w nabłonkach i tkance łącznej większości narządów, skąd antygeny są transportowane naczyniami limfatycznymi doprowadzającymi do węzłów chłonnych, gdzie są prezentowane limfocytom T.
Ze względu na pełnione funkcje, miejsce występowania, zestaw antygenów i produkcję cytokin wyróżnia się następujące populacje komórek dendrytycznych:
1. mieloidalne komórki dendrytyczne (MDC), z ekspresją antygenów: CD11c+, CD123dim, CD1c+ (BDCA-1+), CD141+ (BDCA-3+), z silną ekspresją antygenów HLA-DR; zdolne do rozpoznawania, przetwarzania i prezentacji antygenów; znajdowane są w różnych tkankach organizmu (1);
2. plazmocytoidalne komórki dendrytyczne (PDC), z ekspresją antygenów: CD11c-, CD123bright, CD303+ (BDCA-2+), CD304+ (BDCA-4+); ze słabą zdolnością przetwarzania i prezentacji antygenu, będące głównym producentem interferonu α (IFNα) w organizmie; mogą aktywować odpowiedź antywirusową i antynowotworową (2, 3);
3. grudkowe komórki dendrytyczne (FDC), znajdowane w grudkach chłonnych węzłów limfatycznych i śledziony, niemające zdolności do migracji i przetwarzania antygenów, zapobiegające apoptozie limfocytów B, pobudzające interakcjach między komórkami i ich proliferację (4).
Zasady stosowania komórek dendrytycznych w immunoterapii nowotworów
Przez wiele dziesięcioleci leczenie nowotworów obejmowało radio- i/lub chemioterapię, a w przypadku guzów litych wspomagane było interwencją chirurgiczną. Tradycyjna wielokierunkowa terapia jest na ogół mało swoista i oddziałuje nie tylko na komórki nowotworowe, ale także na zdrowe komórki organizmu wywołując często efekty uboczne.
W ostatnich latach zaczęto wdrażać w leczeniu nowotworów immunoterapię: tzw. bierną z zastosowaniem przeciwciał monoklonalnych (np. anty-CD20, anty-CD52, anty-CD33 w leczeniu rozrostów hematologicznych) oraz czynną z użyciem komórek dendrytycznych. Celem czynnej immunoterapii przeciwnowotworowej jest wywołanie odpowiedzi immunologicznej przeciwko antygenom konkretnego nowotworu w celu eradykacji komórek rozrostowych, a tym samym zwiększenia przeżywalności chorych i poprawy jakości ich życia. Jest to terapia z definicji zindywidualizowana. Szczepionki przeciwnowotworowe powstają poprzez immunizację pacjenta komórkami nowotworowymi albo komponentami antygenów nowotworowych. Powinny to być antygeny istotne dla wzrostu i przeżycia nowotworu. Efektem spodziewanym immunoterapii powinna być specyficzna odpowiedź limfocytów T przeciw określonym antygenom nowotworowym (5).
Schemat postępowania w przygotowaniu szczepionki z komórek dendrytycznych w immunoterapii pacjentów z nowotworami przedstawia rycina 1.
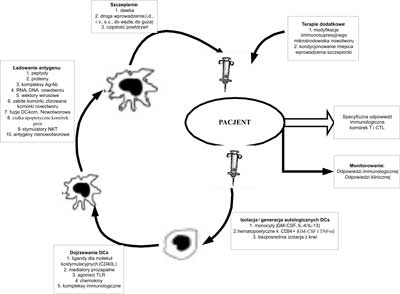
Ryc. 1. Schemat postępowania w przygotowaniu szczepionki z komórek dendrytycznych (DCs) dla chorych z nowotworami. W opracowaniu jest kilka metod pozyskiwania i przygotowania ex vivo autologicznych DCs. Dojrzewanie i obładowywanie DCs antygenami może być przeprowadzane różnymi technikami. Opracowywane są metody podawania szczepionki (i.d. – śródskórnie; i.v. – dożylnie, s.c. – podskórnie, do węzła limfatycznego, bezpośrednio do guza nowotworowego), dawkowania oraz częstości szczepień. Wskazuje się na konieczność standaryzacji metod monitorowania odpowiedzi immunologicznej i klinicznej.
Komórki nowotworowe, przeciwko którym przygotowywana jest szczepionka, powinny prezentować określone antygeny (6):
1. specyficzny antygen nowotworowy TSA (Tumor Specific Antigen), np. białko chimeryczne bcr-abl występujące w przewlekłej białaczce szpikowej, PSA (prostate specific antigen) w raku stercza;
2. antygen związany z nowotworem TAA (Tumor Associated Antigen), np. związane z różnymi nowotworami geny Ras, p53 występujący w guzach litych (np. raku piersi), gen MAGE-1 związany z czerniakiem.
Komórki DC jako szczepionka powinny zawierać antygen TSA lub TAA konkretnego pacjenta (7).
Metody uzyskania komórek dendrytycznych jako „szczepionek” dla celów immunoterapii
Komórki dendrytyczne dla celów terapeutycznych mogą być pozyskiwane i przygotowywane różnymi metodami. Trzy podstawowe źródła pozyskiwania DC stosowane obecnie to (8):
1. monocyty uzyskane drogą leukaferezy (separacji komórek jednojądrzastych z krwi obwodowej), różnicowane do mieloidalnych komórek dendrytycznych (MDC) przy pomocy GM-CSF i IL-4 (lub IL-13) (9, 10, 11);
2. hematopoetyczne komórki progenitorowe CD34+ uzyskane drogą leukaferezy, różnicowane do komórek dendrytycznych in vitro przy pomocy GM-CSF I TNF-α (12) – w efekcie uzyskuje się mieszaninę śródmiąższowych komórek dendrytycznych i komórek Langerhansa;
3. bezpośrednia izolacja komórek dendrytycznych z produktu leukaferezy przez wirowanie w gradiencie gęstości (13) lub izolację na kulkach immunomagnetycznych (14) – w efekcie uzyskuje się mieszaninę plazmocytoidalnych i mieloidalnych komórek dendrytycznych (PDC + MDC).
Komórki dendrytyczne uzyskane każdą z wymienionych metod mogą stymulować antygenowo specyficzną odpowiedź komórek T, chociaż mechanizm tej indukcji nie jest do końca poznany.
Dojrzewanie DC, czyli uzyskanie komórek zdolnych do prezentacji antygenu, przebiega w hodowlach (15, 16, 17) z dodatkiem:
1. agonistów molekuł kostymulacyjnych: CD40L, CD154, OX40L, 4-1IBBL;
2. mediatorów prozapalnych: interleukin (IL-1β, IL-6), interferonów (IFNα/β, IFNγ), MCM (Monocyte Conditioned Medium), TNFα, PGE2 (Prostaglandin E2);
3. agonistów TLR (toll-like receptor): błonowych i wewnątrzkomórkowych;
4. chemokin (np. CCL16);
5. kompleksów immunologicznych.
Komórka dendrytyczna staje się efektywną komórką prezentująca antygen po ekspozycji cząsteczek MHC na antygen i wprowadzeniu go do wnętrza komórki (tzw. pulsowanie DC). Ważnym etapem jest wybór antygenu nowotworowego, przy czym powinien to być antygen krytyczny dla wzrostu i przeżycia nowotworu. W preparatyce szczepionki z komórek dendrytycznych wykorzystywane są zarówno zdefiniowane epitopy, antygeny TAA jak i całe komórki nowotworowe. Źródłem antygenu, wprowadzanego do komórki dendrytycznej różnymi technikami, mogą być (8, 18):
1. peptydy objęte restrykcją MHC I i MHC II;
2. proteiny/rekombinowane białka;
3. zabite komórki nowotworowe, lizaty komórek nowotworowych;
4. kompleksy antygen-przeciwciało;
5. RNA, DNA (pozyskane z nowotworu – pojedynczy gen lub cały genom guza);
6. białka idiotypowe (monoklonalne immunoglobuliny zawierające specyficzne sekwencje białkowe w regionach zmiennych, w miejscach wiążących antygen, produkowane przez komórki nowotworowe);
7. fuzje DC-komórka nowotworowa;
8. ciałka apoptotyczne komórek guza;
9. wektory wirusowe;
10. stymulatory komórek NKT (np. związek ceramidowy αGal-Cer);
11. antygeny nienowotworowe (VEGF, VEGFR).
Immunogenność komórek dendrytycznych po wprowadzeniu antygenu (antygenów) może być wzmocniona przez dodanie molekuł o silniejszym działaniu immunogennym: obcych protein (np. hemocyjaniny, KLH, keyhole limpet hemocyanin), cytokin (IL-12, IL-15), cząsteczek kostymulacyjnych (B7-2, CD40L), chemokin (CCL21) [8].
Należy podkreślić, że tylko dojrzałe komórki dendrytyczne mogą indukować antygenowo-specyficzną odpowiedź cytotoksycznych limfocytów T (CTL) w organizmie ludzkim. Podanie zdrowym ochotnikom niedojrzałych komórek dendrytycznych obładowanych antygenem prowadziło do wywołania tolerancji immunologicznej [19 ]. Bezpośrednie porównanie podania obładowanych peptydem niedojrzałych i dojrzałych DC u pacjentów z czerniakiem wykazało, że tylko dojrzałe DC indukowały odpowiedź CTL (20)].
Drogi wprowadzania komórek dendrytycznych do organizmu chorego
Szczepionki z komórek dendrytycznych mogą być wprowadzane śródskórnie, podskórnie, dożylnie lub bezpośrednio do węzłów chłonnych objętych procesem chorobowym lub do guza nowotworowego (21, 22, 23). Sposób wprowadzenia takiej szczepionki i częstotliwość jej podawania może wpływać na odpowiedź komórek T. Podskórne wprowadzenie wydaje się bardziej efektywne przy nowotworach skóry (24), ale niektóre badania wskazują, że w przypadku czerniaka złośliwego szczepienie do węzła chłonnego jest bardziej skuteczne (25). Rozbieżności w tych doniesieniach mogą wynikać z różnego przygotowania szczepionki, różnych metod obładowywania DC antygenem i różnego stanu klinicznego pacjentów. W grupie pacjentów z rakiem prostaty porównanie różnych dróg wprowadzania szczepionki z DC (izolowanych z krwi, obładowanych proteiną) wykazało, że wszyscy chorzy rozwinęli antygenowo-specyficzną odpowiedź w postaci proliferacji komórek T. Jednak wydzielanie TNFα odnotowano tylko w grupie po szczepieniu dożylnym, a IFNγ był wykrywany po podaniu śródskórnym i do węzłów chłonnych. Przeciwciała antygenowo-specyficzne były wykrywane głównie u pacjentów szczepionych dożylnie (26). Podanie dożylne w mniejszym stopniu indukuje komórki T, ale daje lepszą odpowiedź humoralną (27).
Współdziałanie komórek dendrytycznych z komórkami NK
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Dacki A, Wu L: Hemopoietic precursor and development of dendritic cell populations. Leuk Lymphoma 2003, 44: 1469-1475.
2. Fonteneau JF, et al.: Activation of influenza virus-specific VD4+ and CD8+ T cells: a new role for plasmocytoid dendritic cells in adaptive immunity. Blood 2003, 101: 3520-3526.
3. Salio M., et al.: Plasmocytoid dendritic cells prime IFN-gamma-secreting melanoma-specific CD8 lymphocytes and are found in primary melanoma lesion. Eur J Immunol 2003, 33: 1052-1062.
4. Park CS, Choi YS: How do follicular dendritic cells interact intimately with B cells in germinal centre? Immunology 2005, 114: 2-10.
5. Waller EK: Cellular immunotherapy and cancer. Semin Oncol 2004, 31 (Suppl 4): 87-90.
6. Turtle CJ, Hart DN: Dendritic cells in tumor immunology and immunotherapy. Curr Drug Targets 2004, 5: 17-39.
7. Novellino L, Castelli C, Parmiani G: A listing of human tumor antigens recognized by T cells: March 2004 update. Cancer Immunol Immunother 2005, 54: 187-207.
8. O´Neill D, Adams S, Bhardwaj N: Manipulating dendritic cell biology for the active immunotherapy of cancer. Blood 2004, 104: 2235-2246.
9. Thumer B, et al.: Generation of large numbers of fully mature and stable dendritic cells from leukapheresis products for clinical application. Immunol Methods 1999, 223: 1-15.
10. Alejandro López J, et al.: Monitoring and isolation of blood dendritic cells from aphaeresis products in healthy individuals: a platform for cancer immunotherapy. J Immunol Methods 2002, 267: 199-212.
11. Bender A, et al.: Improved methods for the generation of dendritic cells from nonproliferating progenitors in human blood. J Immunol Methods 1996, 196: 121-135.
12. Banchereau J, et al.: Immune and clinical responses in patients with metastatic melanoma to CD34(+) progenitor-derived dendritic cell vaccine. Cancer Res 2001, 61: 6451-6458.
13. Hsu FJ, et al.: Vaccination of patients with B-cell lymphoma using autologous antigen-pulsed dendritic cells. Nat Med 1996, 2: 52-58.
14. Campbell JD, et al.: Isolation and generation of clinic-grade dendritic cells using the ClinMACS system. Methods Mol Med 2005, 109: 55-70.
15. Jonuleit H, et al.: Pro-inflammatory cytokines and prostaglandins induce maturation of potent immunostimulatory dendritic cells under fetal calf serum-free conditions. Eur J Immunol 1997, 27: 3135-3141.
16. Kalinski P, et al.: Prostaglandin E(2) is a selective inducer of interleukin-12p40 (IL-12p40) production and an inhibitor of bioactive IL-12p70 heterodimer. Blood 2001. 97: 3466-3469.
17. Lee AW, et al.: A clinical grade cocktail of cytokines and PGE(2) results in uniform maturation of human monocyte-derived dendritic cells: implications for immunotherapy. Vaccine 2002, 20 (Suppl 4): A8-A22.
18. Tuyaerts S, et al.: Current approaches in dendritic cell generation and future implication for cancer immunotherapy. Cancer Immunol Immunother 2007, 56: 1513-1537.
19. Dhodapkar MV, et al.: Antigen-specific inhibition of effector T cell function in humans after injection of immature dendritic cells. J.Exp Med 2001, 193: 233-238.
20. Jonuleit H, et al.: A comparison of two types of dendritic cells as adjuvants for the induction of melanoma-specific T-cell responses in humans following intranodal injection. Int J Cancer 2001, 93: 243-251.
21. Kawakami Y, et al.: Dendritic cell based personalized immunotherapy based on cancer antigen research. Front Biosci. 2008;13:1952-19528.
22. Onaitis M, et al.: Dendritic cell gene therapy. Surg Oncol Clin N Am. 2002;11:645-660.
23. Poczesny S, et al.: Dendritic cells as vectors for immunotherapy of cancer. Semin Cancer Biol 2003, 13: 439-447.
24. Kyte JA, et al.: Phase I/II trial of melanoma therapy with dendritic cells transfected with autologous tumor m-RNA. Cancer Gene Ther 2006, 13: 905-918.
25. Bedrosian I, et al.: Intranodal administration of prptide-pulsed mature dendritic cells vaccine results in superior CD8+ T-cell function in melanoma patients. J.Clin Oncol 2003, 21: 3826-3835.
26. Fong L, et al.: Dendritic cells injected via different routs induced immunity in cancer patients. J Immunol 2001 166: 4254-4259.
27. Mullins DW, et al.: Route of immunization with peptide-pulsed dendritic cells controls the distribution of memory and effector T cells in lymphoid tissues and determines the pattern of regional tumor control. J Exp Med 2003, 198: 1023-1034.
28. Fernandez NC, et al.: Dendritic cells directly trigger NK cell function: cross-talk relevant in innate anti-tumor immune responses in vivo. Nat Med 1999, 5: 405-411.
29. Kalinski P, et al.: Natural killer- dendritic cell cross-talk in cancer immunotherapy. Expert Opin Biol Ther 2005, 5: 1303-1315.
30. Ferlazzo G, et al.: Human dendritic cells activate resting natural killer (NK) cells and are recognized via the NKp30 receptor by activated NK cells. J Exp Med 2002, 195: 343-351.
31. Gerosa F, et al.: Reciprocal activating interaction between natural killer cells and dendritic cells. J Exp Med 2002, 195:327-333.
32. Mailliard RB, et al.: Dendritic cells mediate NK cell help for TH1 and CTL response: two-signal requirement for the induction of NK cell helper function. J Immunol 2003, 171: 2366-2373.
33. Kelly JM, et al.: Induction of tumor-specific T cell memory by NK cell-mediated tumor rejection. Nat Immunol 2002, 3: 83-90.
34. Stojadinovic A, et al.: Quantification and phenotypic characterization of circulating tumor cells for monitoring response to a preventive HER2/neu vaccine-based immunotherapy for breast cancer: a pilot study. Ann Surg Oncol. 2007,14:3359-68.
35. Oosterwijk-Wakka JC, et al.: Vaccination of patients with metastatic renal cell carcinoma with autologous dendritic cells pulsed with autologous tumor antigens in combination with interleukin-2: a phase 1 study. J Immunother. 2002, 25: 500-508.
36. Bellone S, et al.: Advances in dendritic-cell-based therapeutic vaccines for cervical cancer. Expert Rev Anticancer Ther. 2007, 7: 1473-1486.
37. Pinzon-Charry A, et al.: Numerical and functional defects of blood dendritic cells in early- and late-stage breast cancer. Br J Cancer. 2007; 97: 1251-1259.
38. Reichardt VL, Brossart P: Dendritic cells in clinical trials for multiple myeloma. Methods Mol Med. 2005; 109: 127-136.
39. Reichardt VL, Brossart P: DC-based immunotherapy of B-cell malignancies. Cytotherapy. 2004, 6: 62-67.
40. Maggio R, et al.: Generation of functional dendritic cells (DC) in adult acute lymphoblastic leukemia: rationale for a DC-based vaccination program for patients in complete hematological remission. Leuk Lymphoma. 2007, 48:302-310.
41. Tuettenberg A, et al.: Induction of strong and persistent MelanA/MART-1-specific immune responses by adjuvant dendritic cell-based vaccination of stage II melanoma patients. Int J Cancer. 2006;118: 2617-2627.
42. Wang S, et al: Optimizing immunotherapy in multiple myeloma: restoring the function of patients´ monocyte-derived dendritic cells by inhibiting p38 or activating MEK/ERK MAPK and neutralizing interleukin-6 in progenitor cells. Blood, 2006, 108: 4071-4077.
43. Yang L, Carbone DP: Tumor-host immune interactions and Dendritic cell dysfunction. Adv Cancer Res 2004, 92: 13-27.

