© Borgis - Postępy Fitoterapii 4/2012, s. 244-249
Paweł Kunstman, *Małgorzata Wojcińska, Paulina Popławska
Podagrycznik pospolity (Aegopodium podagraria L.)
Goutweed (Aegopodium podagraria L.)
Katedra i Zakład Farmakognozji, Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
Kierownik Katedry i Zakładu: prof. dr hab. Irena Matławska
Summary
Goutweed (Aegopodium podagraria L., Apiaceae), also known as ground elder, is a perennial native to Eurasia, which has been introduced around the world. The plant has been used in traditional medicine since ancient time, first of all to treat rheumatic disorders, gout and sciatic pain, while the young, fresh leaves have been employed as a culinary vegetable. The popularity and medical importance of this plant appear to wane, despite of the presence of scientific data confirming anit-inflammatory, antimicrobial and potential anti-cancerogenic activity of its extracts or their chief components. So far, polyacetylenes (falcarinol and falcarindiol, in particular) and essential oil have seemed to be the most important fractions, which strongly influence on the observed biological effect of this plant. Goutweed is worthy of notice, especially, that it grows and propagates quite easily. Moreover a clear range between the therapeutic and toxic dosages of its key component, falcarinol, as well as no health hazards or side effects in conjunction with proper administration of the herb, both guarantee safeness of its consumption. Here we present an updated review on ground elder, including its chemical composition as well as proven pharmacological activity.

Wstęp
Podagrycznik pospolity (Aegopodium podagraria L.) (ryc. 1), z rodziny selerowatych (Apiaceae), jest pospolitą rośliną, którą można spotkać prawie w całej Europie (poza krańcami północnymi i południowymi) i Azji (Kaukaz, Syberia oraz Azja Mniejsza), a także w Ameryce Północnej, dokąd został zawleczony (1, 2). To jedyny przedstawiciel rodzaju Aegopodium występujący na obszarze Polski. Rośnie w cienistych, wilgotnych lasach, w niższych partiach gór, a także w zaroślach, na rowach i wysypiskach śmieci, od najdawniejszych czasów jest również znany ogrodnikom jako trudny do wyplenienia chwast. Nazwy ludowe dla tego gatunku to, m.in. śnitka, kurza stopka, gier, barszcnica (3-6).
 Ryc. 1.
Ryc. 1. Podagrycznik pospolity (
Aegopodium podagraria L.).
Do rodzaju Aegopodium można zaliczyć także inne gatunki: Aegopodium alpestre Ledeb., Aegopodium burttii Nasir, Aegopodium kashmiricum (R.R. Stewart ex Dunn) Pimenov, Aegopodium latifolium Turcz., Aegopodium tadshikorum Schischk, Aegopodium handelii H. Wolff oraz Aegopodium henryi Diels, wśród których dwa ostatnie są uznawane za endemiczne dla flory chińskiej (7, 8).
Nazwy Aegopodium użył po raz pierwszy szesnastowieczny, niemiecki botanik, aptekarz i lekarz Tabernemontanus. Nawiązuje ona do kształtu odcinków liści, przypominających kozie kopyta lub ich odcisk (z greckiego aix (D. aigos) – koza, a podiom – nóżka) (9); podobnie – nazwa ludowa: kozia stopka. Natomiast nazwa botaniczna wywodzi się od podagry, czyli bólów reumatycznych, obejmujących stawy palców stopy i związana jest z zastosowaniem leczniczym tego gatunku. Niektóre źródła podają, że prawdopodobnie już neandertalczycy używali ziele podagrycznika do uśmierzania bólu (1).
Historia podagrycznika pospolitego w Polsce sięga czasów Średniowiecza, kiedy ze względu na wartości odżywcze, był sprzedawany jako warzywo na targach w Krakowie. To jedna z roślin, której spożycie wzrastało w okresach głodu. Udokumentowano stosowanie nadziemnych organów A. podagraria do przygotowywania zup (stąd nazwa ludowa – barszcnica), szczególnie na Kresach Wschodnich. Jednak spożycie tej rośliny w Polsce zmniejszyło się na przestrzeni wieków, w przeciwieństwie do krajów Europy Zachodniej, w których nadal ma ona znaczenie kulinarne. W północno-zachodnich Niemczech podagrycznik jest zbierany na „zieloną zupę”, przy czym preferowane są młode liście oraz łodygi wraz z ogonkami liściowymi. Młode liście podagrycznika stanowią namiastkę szpinaku, często przygotowuje się z nich wiosenne sałatki (4, 10-14).
Charakterystyka botaniczna
A. podagraria to bylina okrywowa, osiągająca wysokość od 60 do 90 cm. Ma rozgałęzione, pełzające kłącze wraz z aromatycznymi korzeniami. Łodyga jest naga, pusta, bruzdowana, prosto wzniesiona, rozgałęziona w części szczytowej. Liście dolne podwójnie trójlistkowe; nierówne u nasady (sercowate, jajowate lub jajowatopodłużne), na szczycie zaostrzone, nierówno piłkowane i ciemnozielone; liście górne – trójlistkowe. Baldachy 12-20 – promieniowe, jednakowej długości, złożone z małych białych kwiatów; pokrywy oraz pokrywek najczęściej brak. Kwiaty są obupłciowe i męskie, koloru białego lub różowego, do 3 mm średnicy; kielich bez ząbków. Kwiat złożony jest z 5 płatków korony, odwrotnie sercowatych, pręcików 5 i słupka 1. Okres kwitnienia, w zależności od położenia geograficznego, przypada na maj-wrzesień. Owocem jest rozłupnia, rozpadająca się na 2 rozłupki (10, 12, 15).
Podagrycznik pospolity jest typowym przedstawicielem rodzaju Aegopodium. Może występować w odmianie Variegatum – o liściach biało-pstrych. Nadzwyczajna żywotność tej rośliny wynika ze zdolności do odrastania nawet z najmniejszego fragmentu kłącza. Dlatego podagrycznik nie nadaje się do kompostowania, gdyż sprzyja ono rozprzestrzenianiu się tej byliny i utrudnia jej usuwanie. Gatunek preferuje miejsca zacienione, wilgotne, gliniaste, zasobne w azot; rozrastając się hamuje wzrost innych chwastów (16, 17).
Skład chemiczny
Skład chemiczny A. podagraria jest stosunkowo słabo poznany. W świetle dotychczasowych badań najważniejszą grupą związków chemicznych wydają się być poliacetyleyny (poliiny): falkarinol (panaksynol, cis-heptadeka-1,9-dieno-4,6-diino-3-ol), falkarindiol (cis-heptadeka-1,8-dieno-4,6-diino-3,10-diol) (ryc. 2), falkarinon (cis-heptadeka-1,9-dieno-4,6-diino-3-on) oraz falkarinolon (cis-heptadeka-1,9-dieno-4,6- -diino-9-ol-3-on) (1, 18). Obecność alifatycznych C17- -poliacetylenów typu falkarinolu jest cechą charakterystyczną dla roślin z rodziny Apiaceae. Biogenetycznie poliacetyleny wywodzą się z nienasyconych kwasów tłuszczowych; falkarinol i jego pochodne – z kwasu oleinowego. Najpierw w wyniku dehydrogenacji oraz β-oksydacji powstają C17-acetyleny, dalsze procesy utleniania i dehydrogenacji prowadzą do utworzenia falkarinolu i jego pochodnych.
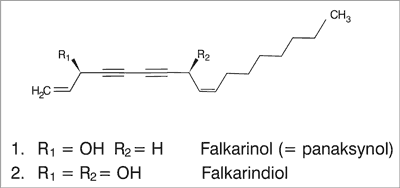 Ryc. 2.
Ryc. 2. Wzory chemiczne falkarinolu i falkarindiolu.
Poliacetyleny są składnikami pierwotnymi podagrycznika – występują we wszystkich organach tej rośliny: kłączach, liściach, łodygach i kwiatach, jednak ich biosynteza zwiększa się w odpowiedzi na zakażenia bakteryjne, grzybicze oraz wirusowe (19). W tej grupie dominują falkarinol i falkarindiol, przy czym zawartość pierwszego z nich w olejku eterycznym wynosi 0,2% (łodygi) i 0,6% (liście) (20). Stężenie falkarindiolu podlega wahaniom w trakcie sezonu wegetacyjnego. Przeważnie jest go najwięcej w liściach, kwiaty są najbogatsze w ten związek jedynie w początkowym okresie kwitnienia; zawartość falkarindiolu jest wówczas kilka razy większa od ilości oznaczanej w pozostałych organach. Autorzy prowadzący badania przypuszczają, że wiąże się to z funkcjami ochronnymi, jakie pełni ten poliacetylen (21).
Drugą istotną frakcją związków chemicznych obecnych w podagryczniku jest olejek eteryczny, zawierający głównie mono- i seskwiterpeny, a skład jakościowy i ilościowy zależy od pochodzenia surowca, z którego został wyodrębniony. Paramonov i wsp. badali olejek z podagrycznika rosnącego w regionie iglińskim (Republika Baszkirii, Rosja). Dominował w nim sabinen (ok. 63%), w znaczenie mniejszych ilościach obecne były: α- i β-pinen (odpowiednio 3,60% i 3,79%), myrcen (2,17%), octan etylu (4,82%), α-tujon (0,63%), dehydro-p-cymen (3,39%) oraz β-felandren (0,65%) (22). Natomiast w surowcu pochodzącym z Serbii, głównymi składnikami olejku były: (+)α-pinen (13,3%), (+)limonen (9,4%), p-cymen (8,8%), (Z)-β-ocymen (5,2%), (+)β-pinen (5,0%), germakren D (4,7%), (+)spatulenol (4,4%), α-tujon (4,2%), perialdehyd (4,1%), (+)(E)-β-kariofylen (3,9%), (-)-(E)-tlenek kariofylenu (3,4%), myrcen (3,4%). Natomiast zawartość (+)sabinenu wynosiła zaledwie 1,8% (23).
Estońscy badacze porównali zawartość i skład olejku eterycznego, wyodrębnionego z łodyg oraz liści roślin zebranych na terenie Estonii. Łodygi były bogatsze w olejek (3,8 mg/g) niż liście (1,7 mg/g), a główną frakcję (92,5%) stanowiły monoterpeny: β-pinen (29,4%), α-pinen (15,7%), limonen (18.4%), γ-terpinen (15,5%). Zawartość pozostałych składników nie przekraczała 4%. Olejek z liści także składał się z frakcji monoterpenów (43,8%) i seskwiterpenów (29,8%). W pierwszej grupie dominowały: α-pinen (6,6%), β-pinen (11,1%), limonen (8,2%) i γ-terpinen (8,2%), natomiast wśród seskwiterpenów: germakren D (15,6%) i (E)-α-bergamoten (4,8%) (20).
W zielu podagrycznika występują również związki fenolowe z grupy kumaryn, kwasów fenolowych i flawonoidów. Potwierdzono obecność angularnych furanokumaryn, mających cząsteczkę kumaryny skondensowaną w pozycji C-7 i C-8 z pięciowęglowym pierścieniem furanu. W liściach, owocach i korzeniach podagrycznika pospolitego znaleziono angelicynę, w korzeniach dodatkowo apterynę. Zawartość obu związków w analizowanym surowcu jest stosunkowo mała (24).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Cisowski W. Związki flawonoidowe w zielu Aegopodium podagraria L., Herba Pol 1985; 31(3-4):137-40. 2. Nowak B. Leksykon roślin ozdobnych i użytkowych. WP, Warszawa 2000; 192. 3. Broda B, Mowszowicz J. Przewodnik do oznaczania roślin leczniczych, trujących i użytkowych. Wyd. V, PZWL, Warszawa 1996; 482-3. 4. Łuczaj Ł. Changes in the utilization of wild green vegetables in Poland since the 19th century: a comparison of four ethnobotanical surveys. J Ethnopharmacol 2010; 128:395-404. 5. Rostafiński J, Seidl O. Przewodnik do oznaczania roślin. PWRiL, Warszawa 1973; 75. 6. Rutkowski L. Klucz do oznaczania roślin naczyniowych Polski niżowej. Wyd Nauk PWN. Warszawa 2006; 338. 7. Flora of China 2005; 14:110-2. 8. http://www.theplantlist.org/browse/A/Apiaceae/Aegopodium/, 25.12.11. 9. Rejewski M. Pochodzenie łacińskich nazw roślin polskich. Wyd Książka i Wiedza, Warszawa 1996; 18. 10. Grau J, Jung R, Munker B. Zioła i owoce leśne. Wyd GeoCenter, Warszawa 1996; 114. 11. Lamer-Zarawska E. Zioła w geriatrii. Wyd Astrum, Wrocław 1997; 202. 12. Podbielkowski Z, Sudnik-Wójcikowska B. Słownik roślin użytkowych. PWRiL, Warszawa 2003; 369. 13. Strzelecka H, Kowalski J. Encyklopedia zielarstwa i ziołolecznictwa. PWN, Warszawa 438. 14. Sarwa A. Wielki leksykon roślin leczniczych. Wyd Książka i Wiedza, Warszawa 2001; 51. 15. Műnker B. Kwiaty polne i leśne. Wyd GeoCenter, Warszawa 1998; 104. 16. Brickell Ch. Wielka encyklopedia roślin ogrodowych od A do Z. Muza SA, Warszawa 1999; 82. 17. Aichele D. Jaki to kwiat? Oficyna Wyd Multico, Warszawa 1997; 84. 18. Kemp MS. Falcarindiol: an antifungal polyacetylene from Aegopodium podagraria. Phytochem 1978; 17:1002. 19. Christensen LP, Brandt K. Bioactive polyacetylenes in food plants of the Apiaceae family: Occurrence, bioactivity and analysis. J Pharm Biomed Anal 2006; 41:683-93. 20. Orav A, Viitak A, Vaher M. Identification of bioactive compounds in the leaves and stems of Aegopodium podagraria by various analytical techniques. Procedia Chem 2010; 2:152-60. 21. Priori NM, Lundgaard NH, Light ME i wsp. The polyacetylene falcarindiol with COX-1 activity isolated from Aegopodium podagraria L. J Ethnopharmacol 2007; 113:176-8. 22. Paramonov EA, Khalilova AZ, Odinokov VN i wsp. Identification and biological activity of volatile organic compounds isolated from plants and insects. III. Chromatography-mass spectrometry of volatile compounds of Aegopodium podagraria. Chem Nat Comp 2000; 36(6):584-6. 23. Kapetanos C, Karioti A, Bojović MP i wsp. Chemical and principal-component analyses of the essential oils of Apioideae Taxa (Apiaceae) from Central Balkan. Chem Biodiver 2008; 5(1):101-19. 24. Ojala T. Biological screening of plant coumarins. Academic dissertation, Helsinki 2001. 25. Hänsel R, Keller K, Rimpler H i wsp. Drogen A-D. Springer-Verlag, Berlin, Heidelberg, New York 1992; 99-100. 26. Hopf H, Kandler O. Biosynthesis of umbelliferose in Aegopodium podagraria. Plant Physiol 1974; 54:13-4. 27. Battelli MG i wsp. Ribosome-inactivating lectins with polynucleotide: adenosine glycosidase activity. FEBS Lett 1997; 408:350-9. 28. Janhar B. Sezonsko spremljanje nekaterih bioaktivnih snovi v izbranih užitnih samoniklih rastlinah. Diplomsko delo. Univerza v Ljubljani, 2007. 29. Storl W-D. Zioła lecznicze i magiczne. Studio Astropsychologii, Białystok 2009; 101-2. 30. Grieve M. A modern herbal. Dover Publications, New York 1998; 1369. 31. Adams M, Berset C, Kessler M i wsp. Medicinal herbs for the treatment of rheumatic disorders – A survey of European herbals from the 16th and 17th century. J Ethnopharmacol 2009; 121:343-59. 32. Stefanovic O, Comic L, Stanojevic D i wsp. Antibacterial activity of Aegopodium podagraria L. Extracts and interaction between extracts and antibiotics. Turk J Biol 2009; 33:145-50. 33. EFSA. Scientific opinion on the substation of health related to Agopodium podagraria L. and maintenance or achievement of normal body weight (ID 2384) pursuant to Article 13(1) of Regulation (EC) No 1924/20061. EFSA Journal 2009; 7(9):1278. 34. Kobaisy M, Abramowski Z, Lermer L i wsp. Antimycobacterial polyynes of devil’s club (Oplopanax horridus), a North American native medicinal plant. J Nat Prod 1997; 60:1210-3. 35. Duško BL, Čomić L, Solujić-Sukdolak S. Antibacterial activity of some plants from family Apiaceae in relation to selected phytopathogenic bacteria. Kragujevac J Sci 2006; 28:65-72. 36. PDR for herbal medicines. Third Edition. Thomson PDR at Montvale 2004; 399-400.

 Ryc. 1. Podagrycznik pospolity (Aegopodium podagraria L.).
Ryc. 1. Podagrycznik pospolity (Aegopodium podagraria L.). Ryc. 2. Wzory chemiczne falkarinolu i falkarindiolu.
Ryc. 2. Wzory chemiczne falkarinolu i falkarindiolu.