© Borgis - Nowa Medycyna 4/2013, s. 168-173
Marcin Gradowski1, Urszula Jankiewicz1, *Paweł Kowalczyk2
Choroby człowieka wywołane mutacjami genów kodujących koneksyny
Human diseases caused by mutations in genes encoding connexin
1Katedra Biochemii, Wydział Rolnictwa i Biologii, Szkoła Główna Gospodarstwa Wiejskiego, Warszawa
2Samodzielny Zakład Biologii Mikroorganizmów, Wydział Rolnictwa i Biologii, Szkoła Główna Gospodarstwa Wiejskiego, Warszawa
Summary
Intercellular communication plays an important role in maintaining the normal function of tissues and the regulation of proliferation, differentiation, and cell death. This is extremely important connexin transmembrane proteins forming structures called konecsons. These structures are part of the water channels called gap-type connections. There are four types of these connections, depending on the isoforms constituent connexins. So far, humans understood 21 isoforms of connexins in mice 19th A connexin protein with a short half-life, the life cycle of these proteins is regulated by phosphorylation mechanism/dephosphorylation. Genes encoding these proteins are localized in humans on a number of chromosomes, may form clusters. Mutations in genes encoding connexin cause severe inherited disorders in humans, such as deafness, associated or not with a skin disease, or ODD syndrome, which is a condition plejotropicznym. Because of the important role they play in the connexin intercellular communication, and indirectly in the maintenance of homeostasis of the whole organism, it is important to further study the properties and functions of these proteins.

Wstęp
Koneksyny (Cx) należą do rodziny integralnych białek międzybłonowych, które razem tworzą heksagonalne struktury – kanały nazywane koneksonami. Sparowane koneksony tworzą razem międzykomórkowe połączenia ścisłe, inaczej nazywane synapsami typu neksus; niezbędne są one do szybkiej międzykomórkowej komunikacji elektrycznej i wolniejszej w postacji przepływu nieorganicznych jonów, wtórnych przekaźników oraz innych molekuł o wielkości około 1-2 kDa, które rozpuszczają się w wodzie. U człowieka występuje 21 izoform białek z rodziny koneksyn. Izoformy te można spotkać w całym organizmie człowieka, w tych samych komórkach może występować kilka różnych koneksyn. Cx są białkami występującymi wyłącznie w organizmie kręgowców. U bezkręgowców występują homologiczne do koneksyn białka – ineksyny (Inx), które posiadają podobne funkcje i też budują połączenia ścisłe. Oprócz koneksyn w organizmie kręgowców znaleziono białka, które są podobne pod względem strukturalnym do koneksyn i ineksyn, nazwane paneksynami (1-3). Koneksyny mają podobną przestrzenną budowę cząsteczek, składającą się z N-terminalnego ogona, czterech domen transmembranowych, dwóch pętli zewnątrzkomórkowych, jednej pętli cytoplazmatycznej oraz ogona C-terminalnego. Różnice w obrębie tych struktur mają wpływ na właściwości każdej izoformy tego białka. Właściwości te decydują, o jakim składzie koneksynowym powstaną koneksony i w kolejności połączenia ścisłe oraz jakie będą właściwości tych kanałów. Pojedyncze koneksony, jak i sparowane odpowiadają za homeostazę tkankową, procesy związane z gospodarką jonową komórki oraz regulacje różnych procesów komórkowych, takich jak cykl komórkowy, rozwój, różnicowanie i migracja, a także za aktywacje procesów związanych z apoptozą lub jej zahamowaniem (3, 4). Mutacje genów kodujących te białka prowadzą do chorób dziedzicznych organizmu człowieka. Tak więc koneksyny odpowadają pośrednio za prawidłowe funkcjonowanie komórek, tkanek i kolejno całego organizmu. Dlatego dalsze badania nad tymi białkami pozwolą nam na dokładniejsze ich poznanie i w konsekwencji leczenie chorób związanych z mutacją genów kodujących te białka (5).
Domeny funcjonalne koneksyn i ich funkcje
Wszystkie dotychczas poznane koneksyny mają zbliżoną budowę. Cząsteczka każdej koneksyny zbudowana jest z czterech transmembranowych domen (TM1-4) o charakterze hydrofobowym, jednej pętli wewnątrzkomórkowej (CL) oraz dwóch pętli pozakomórkowych (E1-2). Prócz tego w cytoplazmie zanurzone są końce – aminowy (NT) pochodzący od pierwszej domeny transmembranowej oraz koniec karboksylowy (CT) pochodzący od czwartej domeny transmembranowej. Ta klasyczna topologia została potwierdzona przez wiele badań nad Cx26, Cx32 i Cx43 (5, 6) (ryc. 1, 2).
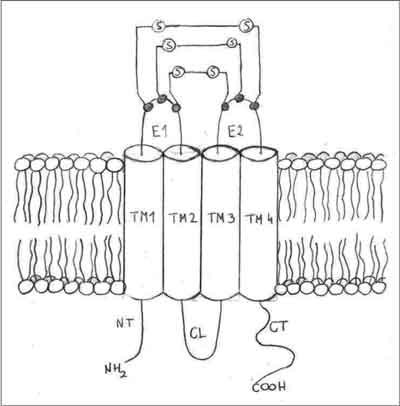
Ryc. 1. Model budowy koneksyny (1-5).
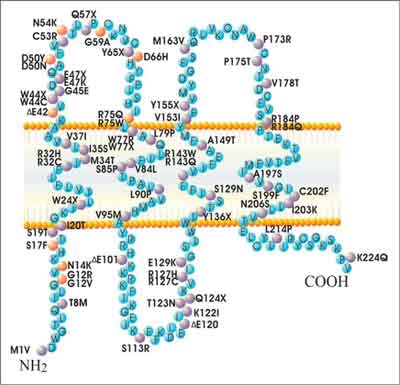
Ryc. 2. Miejsca mutacji Cx26. Kolorem szarym zaznaczono zarówno mutacje związane z głuchotą i chorobami skóry (5).
Lokalizacja tkankowa koneksyn
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Laird DW: The gap junction proteome and its relationship to disease. Trend in Cell Biology 2009; 20(2): 92-101. 2. Derangeon M, Spray DC, Bourmeyster N et al.: Reciprocal influence of connexins and apical junction proteins on their expressions and functions. Biochimica et Biophysica Acta 2009; 1788: 768-778. 3. Maeda S, Tsukihara T: Structure of the gap junction channel and its implications for is biological functions. Cell Mol Life Sci 2011; 68: 1115-1129. 4. Płotek W: Budowa i funkcja synaps elektrycznych (gap junctions) w ośrodkowym układzie nerwowym. Anestezjologia i Ratownictwo 2008; 2: 274-282. 5. Laird DW: Life cycle of connexins in health and disease. Biochem J 2006; 394: 527-543. 6. Peracchia C, Wang XG: Connexin domains relevant to chemical gating of gap junctions channels. Brazilian Journal of Medical and Biological Research 1997; 30: 577-690. 7. Rutkowski R, Kosztyła-Hojna B, Kańczuga-Koda L et al.: Struktura i fizjologiczna funkcja białek koneksynowych. Postępy Hig Med Dośw 2008 (online); 62: 632-641. 8. Krzymowski T, Przała J, Dusza L et al.: Fizjologia zwierząt. Wyd. VII, PWRiL, Warszawa 2005: 17-33. 9. Krechowiecki A, Czerwiński F: Zarys anatomii człowieka. Wyd. VII, Wydawnictwo Lekarskie PZWL, Warszawa 2006: 224-225. 10. Hanner F, Soresen CM, Holstein-Rathlou NH, Peti-Peterdi J: Connexins and the kidney. Am J Physiol Regul Itegr Comp Physiol 2010; 298: R1143-R1155. 11. Ahmad S, Martin PEM, Evans WH: Assembly of gap junction channels. Eur J Biochem 2001; 268: 4544-4552. 12. Lin X, Gemel J, Glass A et al.: Journal of Molecular and Cellular Cardiology 2010; 48: 238-245. 13. Söhl G, Willecke K: Gap junctions and the connexin protein family. Cardiovascular Research 2004; 62: 228-232. 14. Burra S, Jiang JX: Regulation of cellular function by connexin hemichannels. Int J Biochem Mol Biol 2011; 2: 119-128. 15. Peracchia C, Sotkis A, Wang XG et al.: Calmodulin directly gates junction channels. The Journal of Biological Chemistry 2000; 275(34): 26220-26224. 16. Török K, Stauffer K, Evans WH: Connexin 32 of gap junctions two cytoplasmic calmodulin – binding domains. Biochem J 1997; 326:479-483. 17. Solan JL, Lampe PD: Connexin 43 Phosphorylation – Structural Changes and Biological Effects. Biochem J 2009; 419(2): 261-272. 18. Haelfiger JA, Bruzzone R, Jenkins NA et al.: Four novel members of connexin family of gap junction proteins. The Journal of Biological Chemistry 1992; 267(3): 2057-2064. 19. Grümmer R, Winterhager E: Blastocyst – Mediatel induction of endometria connexins: an inflammatory response. Journal of Reproductive Immunology 2011; 90: 9-13. 20. Eyra TA, Ducleazau, Sneddon TP et al.: The Hugo Gene Nomenclature Database, 2006 updates. Nucleic Acids Research 2006; 34: D319-D321. 21. Maeda S, Nakagawa S, Suga M et al.: Structure of connexin 26 gap junction channel at 3,5Å resolution. Nature 2009; 458: 597-604. 22. Sawicki W: Histologia. Wyd. V, Wydawnictwo Lekarskie PZWL, Warszawa 2008: 262-277, 348. 23. Bruzzone R, White TW, Paul DL: Connections with connexins: the molecular basis of direct intercellular signaling. Eur J Biochem 1996; 238: 1-27. 24. Shibiyama J, Gutierrez C, Gonzales D et al.: Effect of Charge Substitutions at Residue His 142 on Voltage Gating of Connexin 43 Channels. Biophysical, Journal 2006; 91: 4054-4063.



