© Borgis - Postępy Nauk Medycznych 4/2015, s. 282-288
*Agnieszka Iwańska1, Joanna Nowak1, Wojciech Skorupa2, Ewa Augustynowicz-Kopeć1
Mikrobiologiczna analiza drobnoustrojów izolowanych z dróg oddechowych dorosłych chorych na mukowiscydozę leczonych w Instytucie Gruźlicy i Chorób Płuc
Microbiological analysis microorganisms isolated from the airways of adult CF patients treated in the National Tuberculosis and Lung Disease Research Institute
1Zakład Mikrobiologii, Instytut Gruźlicy i Chorób Płuc, Warszawa
Kierownik Zakładu: prof. dr hab. n. med. Ewa Augustynowicz-Kopeć
2I Klinika Chorób Płuc, Instytut Gruźlicy i Chorób Płuc, Warszawa
Kierownik Kliniki: prof. dr hab. med. Jan Kuś
Streszczenie
Wstęp. Mukowiscydoza (CF) jest najczęściej występującą w populacji kaukaskiej chorobą genetyczną o autosomalnym typie dziedziczenia. Najpoważniejsze objawy obserwuje się w płucach. Nawracające infekcje układu oddechowego są główną przyczyną chorobowości i śmiertelności chorych na mukowiscydozę. Patogenami najczęściej zakażającymi drogi oddechowe dorosłych chorych na mukowiscydozę są Staphylococcus aureus i Pseudomonas aeruginosa.
Cel pracy. Celem badania była analiza gatunków bakterii patogennych izolowanych z dróg oddechowych dorosłych chorych na mukowiscydozę i określenie ich lekooporności.
Materiał i metody. Materiał do badań stanowiło 621 szczepów bakterii patogennych wyizolowanych od 92 chorych w okresie od stycznia do listopada 2014 roku. Do hodowli szczepów i ich identyfikacji stosowano standardowe procedury bakteriologiczne. Oznaczenie lekooporności szczepów przeprowadzono z wykorzystaniem metody dyfuzji z paska (MIC), dyfuzyjno-krążkowej wg Kirby-Bauera oraz automatycznej Vitek 2 Compact (bioMèrieux).
Wyniki. W przeprowadzonej analizie stwierdzono, że najczęściej izolowanymi patogenami były Pseudomonas aeruginosa (53,9%) i Staphylococcus aureus (34,6%). 166 (47,3%) z 351 szczepów P. aeruginosa zidentyfikowano jako fenotyp śluzowy. W badaniu wykazano, że szczepy P. aeruginosa o fenotypie śluzowym były bardziej wrażliwe na leki niż szczepy nieśluzowe.
Wnioski. Wynik badania mikrobiologicznego chorych na mukowiscydozę umożliwia zastosowanie intensywnej, właściwej dla danego zakażenia antybiotykoterapii, przez co zmniejsza częstość zaostrzeń, spowalnia postęp choroby i wydłuża życie.
Summary
Introduction. Cystic fibrosis (CF) is the most autosomal recessive genetic disease. The most serious symptoms are observed in the lungs. Recurrent respiratory infections are the main causes of the morbidity and mortality of cystic fibrosis patients. Pathogens that commonly infect the airways of adult CF patients include Staphylococcus aureus and Pseudomonas aeruginosa.
Aim. The aim of this study was to analysis of microorganisms cultured from airways adult CF patients and antimicrobial resistance tests of the most frequently isolated bacteria.
Material and methods. In this study, 420 sputum samples of 92 CF patients were collected during between January and November 2014. The microorganisms were cultured and identification according to standard microbiological procedures. Drug resistance were performed in automatic system Vitek 2 Compact (bioMèrieux), MIC and disk-diffusion method by Kirby-Bauer.
Results. In our study, among the isolates the most frequent pathogens were Pseudomonas aeruginosa (53.9%) and Staphylococcus aureus (34.6%). 166 (47.3%) strains of 351 isolates P. aeruginosa, were identified as P. aeruginosa mucoid phenotype. This study demonstrated that the isolates with mucoid phenotypes were more susceptible than non-mucoid isolates.
Conclusions. Although the epidemiology of bacterial infections in CF patients has become more complex, the life expectancy of these patients continues to increase. The prevalence of different pathogens in materials from CF patients should by closely monitored, especially mucoid strains P. aeruginosa are associated with persisting and recurring infections.

Wstęp
Mukowiscydoza (ang. cystic fibrosis – CF) jest jedną z najczęstszych chorób dziedzicznych rasy białej. Spowodowana jest defektem genu CFTR, kodującego białko przezbłonowe CFTR (ang. cystic fibrosis transmembrane conductance regulator), będące kanałem chlorkowym odpowiedzialnym za transport chloru i sodu przez błony komórek nabłonkowych. Nieprawidłowe funkcjonowanie białka wynikające z braku lub niskiego poziomu ekspresji genu prowadzi do zaburzeń równowagi elektrolitowej, zmniejszenia zolowej warstwy płynu okołorzęskowego i upośledzenia klirensu śluzowo-rzęskowego. Efektem tych zaburzeń jest produkcja nadmiernie lepkiego i gęstego śluzu, którego zaleganie sprzyja kolonizacji bakterii i tworzeniu biofilmu utrudniającego dostęp komórek fagocytujących i leków do miejsca zakażenia (1-4). Chorzy na mukowiscydozę już od wczesnego dzieciństwa narażeni są na nawracające i przewlekłe infekcje bakteryjne w układzie oddechowym o różnej etiologii bakteryjnej, w wyniku których dochodzi do powolnego, ale stałego odoskrzelowego niszczenia tkanki płucnej (5-7). Przed erą antybiotykową dzieci chore na mukowiscydozę umierały w pierwszym roku życia. Postęp, jaki dokonał się w medycynie, znacznie poprawił jakość i długość życia chorych. W 1986 roku tylko 29,2% stanowili chorzy ≥ 18. roku życia, natomiast w 2012 roku dorośli chorzy stanowili 49,1%. Według danych Cystic Fibrosis Fundation w Stanach Zjednoczonych w ciągu dwóch ostatnich dekad średnia prognozowana długość życia chorych wzrosła o prawie 10 lat, od wieku 31,3 roku w 2002 roku do 41,1 w 2012 roku (8-10).
W wielu badaniach stwierdzono, że etiologia zakażeń bakteryjnych zależna jest od wieku chorego (5-7). W pierwszej dekadzie życia u chorych ma mukowiscydozę infekcje wywołują przede wszystkim Staphylococcus aureus i Haemophilus influenzae, które uszkadzając nabłonek, ułatwiają kolonizację innym drobnoustrojom. Wraz z rozwojem choroby, od dorosłych chorych z dróg oddechowych izolowane są głównie pałeczki Pseudomonas aeruginosa, rzadziej Burkholderia cepacia complex (Bcc), Stenotrophomonas maltophilia, Achromobacter xylosoxidans, Burkholderia gladioli, Ralstonia spp., Cupriavidus spp., Inguilinus spp., Herbaspiryllum spp. i Pandoraea spp. (5, 11-13). W grupie chorych na mukowiscydozę pomimo intensywnej antybiotykoterapii, niektórych drobnoustrojów takich jak P. aeruginosa, Bcc i A. xylosoxidans nie udaje się całkowicie eradykować, ich obecność prowadzi do zaostrzeń płucnych i częstszych hospitalizacji (14-18).
Wśród potencjalnych patogenów u chorych na mukowiscydozę wymienia się również prątki niegruźlicze (ang. mycobacterium other than tuberculosis – MOTT), zwane także atypowymi. W tej grupie chorych MOTT izoluje się z częstością 4-28%. Zróżnicowanie gatunkowe prątków wydaje się zmieniać w zależności od rozmieszczenia geograficznego. W Stanach Zjednoczonych dominują gatunki Mycobacterium avium complex, Mycobacterium kansasii oraz Mycobacterium abscessus, w Europie zaś M. abscessus (19-22).
Drobnoustroje związane z zakażeniami układu oddechowego uznawane są za genetycznie i fenotypowo różnorodne. Analiza mikrobiomu dróg oddechowych osób palących, niepalących, chorych na ciężką postać POChP oraz chorych na mukowiscydozę dowodzi, że liczebność bakterii jest największa w mukowiscydozie, przy jednoczesnej najmniejszej różnorodności flory bakteryjnej. Z badań tych wynika, że z powodu długotrwałej koegzystencji dwóch lub więcej gatunków zasiedlających drogi oddechowe chorych dochodzi do ich zmienności fenotypowej. Interakcje międzybakteryjne, w tym również wymiana informacji genetycznej, mogą mieć wpływ na różnice fenotypowe drobnoustrojów i ich wrażliwość na leki (21-23).
Szczególne znaczenie kliniczne w tej grupie chorych przypisuje się zakażeniom wywoływanym przez P. aeruginosa. Zakażenia pałeczką stwierdza się u większości dorosłych chorych (80%). Zmiany fenotypowe P. aeruginosa podczas przewlekłego zakażenia, jakie towarzyszy mukowiscydozie, zostały dobrze poznane i udokumentowane (9, 10, 24, 25). W początkowej fazie choroby następuje kolonizacja dróg oddechowych szczepami bez otoczki śluzowej, a wraz z postępem choroby obserwuje się konwersję do szczepów śluzowych. Fenotyp śluzowy związany jest ze wzmożonym wydzielaniem egzokomórkowego polisacharydu i jest czynnikiem pogłębiającym uszkodzenia oskrzeli i płuc.
Mimo stosowanej profilaktyki i leczenia antybiotykami prawie nigdy nie udaję się eradykować z dróg oddechowych chorych na mukowiscydozę szczepów z gatunku Staphylococcus aureus. Obecność gronkowca złocistego w drogach oddechowych chorych oceniana jest na 30-50%. Chorzy mogą ulegać kolonizacji lub zakażeniu zarówno metycylinowrażliwymi (MSSA), jak i metycylinoopornymi (MRSA) szczepami S. aureus (3, 6-9).
Wśród ważnych czynników etiologicznych zakażeń w mukowiscydozie wymienia się liczne gatunki pałeczek z rodzaju Burkholderia (dawniej Pseudomonas), w tym B. gladioli oraz Burkholderia cepacia complex. Badania molekularne wykazały, że Burkholderia cepacia complex jest kompleksem kilku gatunków, niewykazujących żadnych różnic fenotypowych. Obecnie zidentyfikowano 17 ściśle powiązanych odmian genomowych występujących w materiałach od chorych na mukowiscydozę. Najczęściej stwierdzano szczepy z gatunku B. cenocepacia (50%), kolejno B. multivorans (35%), B. cepacia, B. stabilis i B. vietnamiensis. B. gladioli jest trzecim co do częstości gatunkiem Burkholderia wywołującym zakażenia w grupie chorych na mukowiscydozę w Stanach Zjednoczonych (15%). Chociaż częstość zakażeń Burkholderia w mukowiscydozie jest niewielka, to ich obecność w materiale od chorego uważa się za niekorzystny czynnik rokowniczy, związany z pogorszeniem funkcji płuc, wzrostem częstości hospitalizacji; jest również powodem dyskwalifikacji chorych do przeszczepienia płuc. Ponadto problem terapeutyczny stanowi naturalna i nabyta oporność pałeczek Burkholderia na wiele grup antybiotyków i chemioterapeutyków (penicyliny, imipenem, kolistyna, aminoglikozydy) (26, 27). Eradykacja pałeczek jest praktycznie niemożliwa ze względu na wysoką zdolność do przetrwania w komórkach nabłonkowych i makrofagach (26-28).
Diagnostyka mikrobiologiczna zakażeń dróg oddechowych chorych na mukowiscydozę jest trudna i stanowi wyzwanie dla laboratorium mikrobiologicznego (2, 3, 5). Leczenie zakażenia może być efektywne, jeżeli wybór antybiotyku jest skorelowany z wynikiem antybiogramu. Ocena lekooporności szczepów P. aeruginosa jest stale przedmiotem wielu kontrowersji. Wynika to z obecności różnych morfotypów kolonii i zróżnicowanej wrażliwości na antybiotyki w obrębie jednego genotypu szczepu wyizolowanego z materiału diagnostycznego (5, 25).
Duża złożoność i zmienność mikrobiomu dróg oddechowych u chorych na mukowiscydozę narzuca konieczność wykonywania badań mikrobiologicznych stanowiących podstawę rozpoznania i leczenia zakażeń chorych na mukowiscydozę. Stale wzrastający odsetek dorosłych chorych niesie ze sobą konieczność zapewnienia specjalistycznej opieki medycznej. Instytut Gruźlicy i Chorób Płuc jest jedną z nielicznych jednostek w Polsce zajmujących się leczeniem dorosłych chorych na mukowiscydozę.
Cel pracy
Celem pracy była analiza mikrobiologiczna patogenów izolowanych z materiałów od chorych na mukowiscydozę leczonych w Przychodni Przyklinicznej i I Klinice Instytutu Gruźlicy i Chorób Płuc w okresie od stycznia do listopada 2014 roku.
Materiał i metody
Analizie poddano materiały od 92 chorych na mukowiscydozę, w wieku od 18 do 51 lat (57 kobiet i 39 mężczyzn), hospitalizowanych w I Klinice Chorób Płuc IGiChP i leczonych ambulatoryjnie w Przychodni Przyklinicznej IGiChP w okresie 1.01.2014-30.11.2014 roku. W analizowanym okresie od chorych pobrano 420 plwocin, z których wyizolowano 651 szczepów bakterii patogennych.
Szczepy identyfikowano rutynowymi metodami diagnostycznymi. Analizowano właściwości fenotypowe, cechy biochemiczne oraz oporność na leki badanych szczepów. Diagnostykę mikrobiologiczną przeprowadzono w oparciu o posiewy wykonane na podłożach stałych: Columbia blood agar, MacConkey agar, Mannitol-salt agar, Chocolate agar, CHROMagar MRSA i Burkholderia Cepacia Selective Agar. Przynależność gatunkową szczepów określano z wykorzystaniem systemu automatycznego Vitek 2 Compact oraz testów komercyjnych. Rozróżnienie typu śluzowego i nieśluzowego wykonywano na podstawie obserwacji makroskopowych kolonii P. aeruginosa na płytce z pożywką MacConkey agar. Lekooporność szczepów określano przy użyciu pasków z gradientem stężeń (MIC), metodą dyfuzyjno-krążkową wg Kirby-Bauera i z zastosowaniem systemu Vitek 2 Compact. Wyniki lekooporność interpretowano w oparciu o wytyczne EUCAST (European Comittee on Antimicrobial Susceptibility Testing) i rekomendacje Krajowego Ośrodka Referencyjnego ds. Lekowrażliwości Drobnoustrojów.
Wyniki
Od 28 (30,5%) chorych z materiału izolowano tylko jeden drobnoustrój, od 50 (54,3%) dwa, od 14 (15,2%) trzy i więcej drobnoustrojów (ryc. 1).
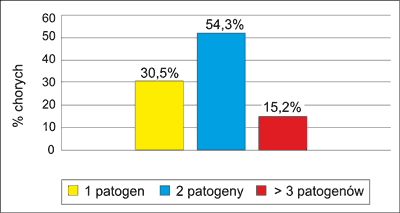
Ryc. 1. Rozkład grupy chorych w zależności od ilości wyhodowanych drobnoustrojów.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Zhao J, Schloss PD, Kalikin LM et al.: Decade-long bacterial community dynamics in cystic fibrosis airways. Proc Natl Acad Sci U S A 2012; 109: 5809-5814.
2. Bittar F, Rolain JM: Detection and accurate identification of new or emerging bacteria in cystic fibrosis patients. Clin Microbiol Infect 2010; 16: 809-820.
3. Burns JL, Rolain JM: Culture-based diagnostic microbiology in cystic fibrosis: can we simplify the complexity? J Cyst Fibros 2014; 13: 1-9.
4. Clunes MT, Boucher RC: Cystic Fibrosis: The mechanism of pathogenesis of an inherited lung disorder. Drug Discov Today Dis Mech 2007; 4: 63-72.
5. Kiska DL, Riddell SW: Practical Laboratory Aspects of Cystic Fibrosis Microbiology: an Update. Part I. Clinical Microbiology Newsletter 2012; 34: 27-31.
6. Hauser AR, Jain M, Bar-Meir M, McColley SA: Clinical significance of microbial infection and adaptation in cystic fibrosis. Clin Microbiol Rev 2011; 24: 29-70.
7. Renders N, Verbrugh H, Van Belkum A: Dynamics of bacterial colonisation in the respiratory tract of patients with cystic fibrosis. Infect Genet Evol 2001; 1: 29-39.
8. http://www.cff.org/UploadedFiles/research/ClinicalResearch/PatientRegistryReport/2012-CFF-Patient-Registry.pdf
9. LiPuma JJ: The changing microbial epidemiology in cystic fibrosis. Clin Microbiol Rev 2010; 23: 299-323.
10. Gilligan PH: Infections in patients with cystic fibrosis: diagnostic microbiology update. Clin Lab Med 2014; 34: 197-217.
11. Harrison F: Microbial ecology of the cystic fibrosis lung. Microbiology 2007; 153: 917-923.
12. Kiska DL, Riddell SW: Practical Laboratory Aspects of Cystic Fibrosis Microbiology: an Update. Part II. Clinical Microbiology Newsletter 2012; 34: 35-41.
13. Foweraker J: Recent advances in the microbiology of respiratory tract infection in cystic fibrosis. Br Med Bull 2009; 89: 93-110.
14. LiPuma JJ: The changing microbial epidemiology in cystic fibrosis. Clin Microbiol Rev 2010; 23: 299-323.
15. Hansena CR, Pressler T, Nielsen KG et al.: Inflammation in Achromobacter xylosoxidans infected cystic fibrosis patients. J Cyst Fibros 2010; 9: 51-58.
16. LiPuma JJ: Burkholderia and emerging pathogens in cystic fibrosis. Semin Respir Crit Care Med 2003; 24: 681-692.
17. De Baets F, Schelstraete P, Van Daele S et al.: Achromobacter xylosoxidans in cystic fibrosis: prevalence and clinical relevance. J Cyst Fibros 2007; 6: 75-78.
18. Hansen CR, Pressler T, Ridderberg W et al.: Achromobacter species in cystic fibrosis: cross-infection caused by indirect patient-to-patient contact. J Cyst Fibros 2013; 12: 609-615.
19. Bar-On O, Mussaffi H, Mei-Zahav M et al.: Increasing nontuberculous mycobacteria infection in cystic fibrosis. J Cyst Fibros 2015; 14: 53-62.
20. Esther CR Jr, Esserman DA, Gilligan P et al.: Chronic Mycobacterium abscessus infection and lung function decline in cystic fibrosis. J Cyst Fibros 2010; 9: 117-123.
21. Callaghan M, McClean S: Bacterial host interactions in cystic fibrosis. Curr Opin Microbiol 2012; 15: 71-77.
22. Tang AC, Turvey SE, Alves MP et al.: Current concepts: host-pathogen interactions in cystic fibrosis airways disease. Eur Respir Rev 2014; 23: 320-332.
23. Górecka D, Nowiński A, Augustynowicz-Kopeć E: Mikrobiom układu oddechowego. Pneumonol Alergol Pol 2014; 82: 481-485.
24. Mayer-Hamblett N, Rosenfeld M, Gibson RL et al.: Pseudomonas aeruginosa in vitro phenotypes distinguish cystic fibrosis infection stages and outcomes. Am J Respir Crit Care 2014; 190: 289-297.
25. Davies JC: Pseudomonas aeruginosa in cystic fibrosis: pathogenesis and persistence. Paediatr Respir Rev 2002; 3: 128-134.
26. Courtney JM, Dunbar KE, McDowell A et al.: Clinical outcome of Burkholderia cepacia complex infection in cystic fibrosis adults. J Cyst Fibros 2004; 3: 93-98.
27. France MW, Dodd ME, Govan JR et al.: The changing epidemiology of Burkholderia species infection at an adult cystic fibrosis centre. J Cyst Fibros 2008; 7: 368-372.
28. Zlosnik JE, Costa PS, Brant R et al.: Mucoid and nonmucoid Burkholderia cepacia complex bacteria in cystic fibrosis infections. Am J Respir Crit Care Med 2011; 183: 67-72.
29. Moore JE, Shaw A, Millar BC et al.: Microbial ecology of the cystic fibrosis lung: does microflora type influence microbial loading? Br J Biomed Sci 2005; 62(4): 175-178.
30. Hubert D, Règlier-Poupet H, Sermet-Gaudelus I et al.: Association between Staphylococcus aureus alone or combined with Pseudomonas aeruginosa and the clinical condition of patients with cystic fibrosis. J Cyst Fibros 2013; 12: 497-503.
31. Valenza G, Tappe D, Turnwald D et al.: Prevalence and antimicrobial susceeptibility of microorganism isolated from sputa of patients with cystic fibrosis. J Cyst Fibros 2008; 7: 123-127.
32. Mayer-Hamblett N, Rosenfeld M, Gibson RL et al.: Pseudomonas aeruginosa in vitro phenotypes distinguish cystic fibrosis infection stages and outcomes. Am J Respir Crit Care Med 2014; 190: 289-297.
33. Manno G, Cruciani M, Romano L et al.: Antimicrobial use and Pseudomonas aeruginosa susceptibility profile in a cystic fibrosis centre. Int J Antimicrob Agents 2005; 25: 193-197.
34. Owlia P, Nosrati R, Alaghehbandan R, Lari AR: Antimicrobial susceptibility differences among mucoid and non-mucoid Pseudomonas aeruginosa isolates. Hyg Infect Control 2014; 19: Doc13.
35. Iwanska A, Nowak J, Skorupa W, Augustynowicz-Kopeć E: Mikrobiologiczna analiza i ocena lekowrażliwości drobnoustrojów izolowanych z dróg oddechowych dorosłych chorych na mukowiscydozę leczonych w Instytucie Gruźlicy i Chorób Płuc w latach 2008-2010. Pneumonol Alergol Pol 2013; 81: 105-113.
36. Goodrich JS, Sutton-Shields TN, Kerr A et al.: Prevalence of community-associated methicillin-resistant. J Clin Microbiol 2009; 47: 1231-1233.
37. Burns JL, Emerson J, Stapp JR et al.: Microbiology of sputum from patients at cystic fibrosis centers in the United States. Clin Infect Dis 1998; 27: 158-163.
38. García AD, Ibarra A, Rodríguez FC, Casal M: Antimicrobial susceptibility of bacterial isolates from patients with cystic fibrosis. Rev Esp Quimioter 2004; 17: 332-335.
39. Campana S, Cocchi P, Döring G et al.: Emergence of an epidemic clone of community-associated methicillin-resistant panton-valentine leucocidin-negative Staphylococcus aureus in cystic fibrosis patient populations. J Clin Microbiol 2007; 45: 3146-3147.
40. Paixão VA, Barros TF, Mota CM et al.: Prevalence and antimicrobial susceptibility of respiratory pathogens in patients with cystic fibrosis. Braz J Infect Dis 2010; 14: 406-409.
41. Paschoal IA, de Oliveira Villalba W, Bertuzzo CS et al.: Cystic fibrosis in adults. Lung 2007; 185: 81-87.
42. Steinkamp G, Wiedemann B, Rietschel E et al.: Emerging Bacteria Study Group. Prospective evaluation of emerging bacteria in cystic fibrosis. J Cyst Fibros 2005; 4: 41-48.

