© Borgis - Medycyna Rodzinna 5/2004, s. 219-226
Izabela Sokoluk
Rola statyn w zapobieganiu i leczeniu chorób układu krążenia
The statins in the treatment and prevention of cardiac diseases
z Oddziału Internistyczno-Kardiologicznego Szpitala Powiatowego, Opole Lubelskie
Ordynator Oddziału: dr n. med. Izabela Sokoluk
Summary
The crucial role in the development of atheromatosis of arteries plays cholesterolemia of LDL fraction. Statines, a group of medicines that has been used for last 17 years, made revolution in treatment and prophylaxis of diseases of circulatory system and contributed to decrease of general mortality and mortality by cardial causes and limited number of serious coronary incidents and necessity of operative intervention. Statines are efficient hipolemisa medicines that have also pleiotrop features. Special benefits achieve patients with diabetes. Statines are easy and safe in usage. Their role and application was confirmed by many scientific researches, including such crucial researches as 4S, HPS, LIPS, CARE, LIPID, WOSCOPS, AFCAPS/TexCAPS. Current indications and targets of hipolemic therapy are determined by ATP III. Statines are called a contemporary aspirin.

Miażdżyca tętnic polega na tworzeniu się ogniskowych zmian zapalno-zwyrodnieniowych (blaszek miaż-dżycowych) w ścianie średnich i dużych tętniczych naczyń krwionośnych. Blaszki miażdżycowe zmieniają strukturę i czynność ściany naczyniowej oraz prowadzą do redukcji światła tętnic.
Brunner i von Haller jako pierwsi opisali w XVIII wieku zmiany miażdżycowe. W 1843 r. Vogel stwierdził, że głównym składnikiem blaszek miażdżycowych jest cholesterol. Rolę lipidów w rozwoju miażdżycy podkreślili Rokitansky w teorii inkrustacyjnej (1852) i Virchow w teorii infiltracyjnej (1856) rozwoju miażdżycy. W początkach XX wieku Aniczkow udowodnił, że dieta bogatocholesterolowa wywołuje miażdżycę tętnic. Ross uznający miażdżycę za przewlekły proces zapalny w błonie wewnętrznej tętnic zakłada, że cholesterol jest determinantą tego procesu.
Proces miażdżycowy inicjowany jest przez zaburzenie funkcji śródbłonka, największego „organu” wewnątrzwydzielniczego u człowieka. Aterogenne są lipoproteiny LDL, szczególnie modyfikowane, tzn. oksydowane i glikowane oraz małe gęste LDL, zawierające dużo lipoproteiny B, a także lipoproteiny IDL, lipoproteiny VLDL i lipoproteina (a) (-Lp) (a). Czynnikiem zmniejszającym ryzyko miażdżycy jest wysoki poziom lipoprotein HDL (frakcji HDL2).
Skutki hipercholesterolemii:
– zaburzenie autoregulacji receptorowej wnikania cholesterolu do komórki przez receptory LDL,
– spadek produkcji tlenku azotu NO, tożsamego z EDRF (śródbłonkowym czynnikiem naczyniorozszerzającym),
– wzrost produkcji wolnych rodników tlenowych,
– wzrost ekspresji białek adhezyjnych na powierzchni komórek śródbłonka (selektyny P i E, ICAM-1, VCAM-1),
– aktywacja białka chemotaksji monocytów (MCP 1),
– wzrost aktywności czynnika aktywacji makrofagów (MCSF),
– zwiększenie aktywności układu renina-angiotensyna w ścianie naczyniowej,
– wzrost syntezy endoteliny 1,
– wzrost wrażliwości skurczowej ściany naczyniowej na endotelinę 1,
– zwiększenie adhezji i agregacji płytek krwi,
– zwiększenie syntezy tromboksanu,
– spadek produkcji prostacykliny,
– zwiększenie liczby receptorów adrenergicznych alfa 2 na płytkach krwi,
– indukcja produkcji czynnika tkankowego przez komórki śródbłonka i makrofagi (czynnik tkankowy aktywuje zewnątrzpochodny układ krzepnięcia),
– zwiększenie stężenia czynnika VII,
– zwiększenie poziomu fibrynogenu,
– hamowanie syntezy tkankowego aktywatora plazminogenu tPA1 w śródbłonku,
– wzrost stężenia inhibitora aktywności plazminogenu PAI1,
– nasilenie procesu krzepnięcia w mechanizmie wiązania się lipoprotein z receptorem płytkowym IIb/IIIa.
Lipoproteina (a) zwiększa aktywność PAI1 i łączy się z fibryną. Hipertrójglicerydemia nasila trombogenezę i obniża fibrynolizę. W hipertrójglicerydemii z reguły wysoki jest poziom małych gęstych LDL i stężenie IDL, a niski poziom HDL. Hipertrójglicerydemii towarzyszy podwyższony poziom fibrynogenu.
Sekwencja zjawisk w miażdżycy przedstawia się następująco;
Pod wpływem molekuł adhezyjnych monocyty w większej liczbie przylegają, a następnie wnikają do błony wewnętrznej tętnic, gdzie przekształcają się w makrofagi. Na makrofagach powstają receptory wymiatające scavanger, poprzez które komórka pobiera bez autoregulacji zmodyfikowane (oksydowane i glikowane) LDL. Makrofagi przekształcają się w komórki piankowate. Komórki piankowate mogą tworzyć się też z komórek mięśni gładkich i fibroblastów.
Makrofagi aktywują limfocyty T, co skutkuje zahamowaniem syntezy kolagenu i indukcją apoptozy komórek mięśni gładkich. Makrofagi są źródłem czynnika tkankowego. Aktywują płytkopochodny (PDGF) i insulinopodobny (ILGF 1) czynnik wzrostu. Pod wpływem PDGF i ILGF 1 komórki mięśni gładkich proliferują i wędrują z błony środkowej do błony wewnętrznej, gdzie mogą również produkować kolagen. Makrofagi są źródłem metaloproteinaz, enzymów proteolitycznych trawiących blaszkę miażdżycową (ryc. 1).

Ryc. 1. Makrofagi w miażdżycy.
Zjawiskom powyższym towarzyszy związane głównie ze spadkiem produkcji NO uszkodzenie śródbłonka, prowadzące do zachwiania równowagi skurczowo-rozkurczowej ściany naczyniowej i zaburzenia równowagi zakrzepowo-fibrynolitycznej. W rezultacie w błonie wewnętrznej tętnic powstają nacieczenia tłuszczowe i pojawiają się komórki mięśni gładkich. Przeładowane cholesterolem komórki piankowate pękają uwalniając do przestrzeni pozakomórkowej złogi cholesterolu krystalicznego i zestryfikowanego. Tworzy się rdzeń lipidowy blaszki miażdżycowej, zawierający dużo czynnika tkankowego. W blaszce obecne są włókna kolagenowe. Powstają zwapnienia. W początkowej fazie blaszka miażdżycowa może nie ograniczać światła naczynia, gdyż rośnie ekstraluminarnie.
Blaszki z dużą zawartością lipidów pękają. Do pęknięć dochodzi najczęściej na obrzeżach blaszki, w tzw. punktach zawiasowych. Powstający zakrzep może zamknąć światło naczynia. Mniejsze zakrzepy ulegają organizacji zwiększając objętość blaszki.
Blaszka miażdżycowa z małą zawartością lipidów, z małym rdzeniem lub bez rdzenia lipidowego, z grubą otoczką i dużą zawartością włókien kolagenowych jest blaszką stabilną, rzadko pękającą.
Lipoproteiny HDL umożliwiają zwrotny transport cholesterolu krystalicznego i jego estrów z komórek do wątroby, która wydala go z żółcią. HDL stabilizują ponadto prostacyklinę, korzystnie wpływają na funkcję śródbłonka i na przebudowę ściany naczyniowej. Zmniejszają ekspresję białek adhezyjnych oraz hamują oksydację cząstek LDL (zawierają m.in. enzymy przeciwutleniające). Na drodze opisanych mechanizmów pełnią ochronną rolę w patogenezie miażdżycy tętnic.
Pierwszoplanowe znaczenie lipidów, w szczególności cholesterolu frakcji LDL w rozwoju miażdżycy zostało udowodnione w licznych badaniach naukowych. Najwięcej wniosków wyciągnięto z Framingham Study. Konsekwencją było poszukiwanie metod i leków poprawiających profil lipidowy krwi, tzn. obniżających poziom cholesterolu całkowitego, cholesterolu LDL, trójglicerydów, lipoproteiny (a) i podwyższających poziom cholesterolu HDL.
W hipercholesterolemii korzyści przynosi dieta hipolipemiczna i ubogocholesterolowa, w której:
– tłuszcze nasycone stanowią poniżej 7% zapotrzebowania kalorycznego,
– tłuszcze wielonienasycone do 10% zapotrzebowanie kalorycznego,
– tłuszcze jednonienasycone do 20% zapotrzebowania kalorycznego,
– cholesterol do 200 mg dziennie.
W hipertrójglicerydemii i hiperlipidemii mieszanej konieczna jest ponadto:
– normalizacja podwyższonej masy ciała,
– zwiększenie aktywności fizycznej,
– ograniczenie spożycia węglowodanów,
– restrykcyjne zaprzestanie picia alkoholu,
– zaprzestanie palenia tytoniu.
Polacy mają osiągnięcia na polu prekursorów leków hipolipemicznych. W latach sześćdziesiątych XX wieku profesor Janusz Supniewski odkrył, że kwas 2-metylo-2-buteno-karboksylowy (MBCA) hamuje syntezę cholesterolu i ma silne działanie przeciwmiażdżycowe. Zaplanowane dalsze prace badawcze przerwała śmierć profesora w 1964 r.
Obecnie są znane i używane następujące grupy leków hipolipemicznych:
1. statyny,
2. fibraty,
3. żywice jonowymienne (leki wiążące kwasy żółciowe),
4. kwas nikotynowy i jego pochodne,
5. probukol,
6. ezetimib.
Pracuje się nad inhibitorami ACAT i CETP.
Statyny są inhibitorami reduktazy 3-hydroksy-3-metyloglutarylo-koenzymu A. Hamują syntezę cholesterolu na wczesnym etapie nie powodując powstawania toksycznych produktów (ryc. 2).
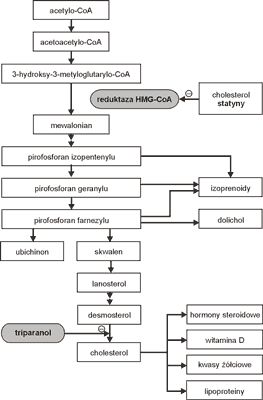
Ryc. 2. Mechanizm działania statyn.
W 1976 r. Endo i Kuroda wyizolowali pierwszą statynę – mewastatynę, która nie znalazła jednak zastosowania klinicznego. Kolejno odkryto lub zsyntetyzowano następujące statyny:
– lowastatynę w 1987 r.,
– simwastatynę i prawastatynę w 1991 r.,
– fluwastatynę w 1993 r.,
– ceriwastatynę i atorwastatynę w 1997 r.,
– rosuwastatynę w 2001 r.
Obecnie w Polsce zarejestrowane są następujące statyny (stan na 31.10.2004 r.):
– Lowastatyna (Mevacor, Anlostin, Liprox, Lovastatinum, Lovasterol, Lovastin, Lowastatyna; w dawkach 10, 20 i 40 mg),
– Simwastatyna (Zocor, Cardin, Simgal, Simredin, Simvachol, Simvacor, Simvahexal, Simvasterol, Vasilip; w dawkach 10, 20, 40 i 80 mg),
– Prawastatyna (Lipostat w dawkach 10 i 20 mg),
– Fluwastatyna (Lescol w dawkach 20, 40, 80 i 160 mg),
– Atorwastatyna (Sortis, Atoris, Tulip; w dawkach 10, 20 i 40 mg),
– Ceriwastatynę (Lipobay) wycofano z rynku w 2001 r. po przypadkach rabdomiolizy.
Lowastatyna, simwastatyna i prawastatyna są statynami naturalnymi (simwastatyna w zasadzie półsyntetyczna), atorwastatyna i fluwastatyna – syntetycznymi.
Lowastatyna i simwastatyna to proleki metabolizowane w wątrobie do czynnych postaci. Pozostałe statyny mają postać aktywną.
Prawastatyna i fluwastatyna są hydrofilne, inne statyny – lipofilne.
Wszystkie statyny poza prawastatyną silnie wiążą się z białkami osocza (do 95%).
Lowastatyna, simwastatyna i atorwastatyna metabolizowane są przez podjednostkę 3A4 cytochromu P 450, fluwastatyna przez podjednostkę 2C9 cytochromu P 450, a prawastatyna na innej drodze. Ma to znaczenie w odniesieniu do interakcji z lekami, ponieważ bardzo dużo leków jest metabolizowanych przy współudziale podjednostki 3A4 cytochtomu P 450.
Działanie lipidowe statyn:
– obniżają stężenie cholesterolu LDL,
– obniżają stężenie cholesterolu całkowitego,
– obniżają stężenie małych gęstych LDL,
– obniżają stężenie trójglicerydów,
– obniżają stężenie lipoproteiny (a),
– podwyższają stężenie cholesterolu HDL,
– zmniejszają oksydację i glikację LDL.
Działania pozalipidowe statyn:
– wzrost syntezy tlenku azotu NO,
– działanie antyproliferacyjne (mają wszystkie statyny poza prawastatyną),
– zmniejszenie produkcji endoteliny 1,
– zmniejszenie gęstości receptorów angiotensyny II,
– zmniejszenie adhezji monocytów i leukocytów,
– zmniejszenie aktywności metaloproteinaz w blaszce miażdżycowej,
– osłabienie reakcji zapalnej,
– obniżenie poziomu białka C-reaktywnego (CRP),
– zmniejszenie syntezy tromboksanu,
– wzrost produkcji prostacykliny,
– korzystny wpływ na receptor płytkowy II b/III a,
– wzrost zawartości kolagenu w blaszce miażdżycowej,
– wzrost syntezy tkankowego aktywatora plazminogenu tPA1,
– spadek produkcji inhibitora aktywacji plazminogenu PAI1,
– indukcja apoptozy komórek.
Wymienione działania prowadzą do:
– stabilizacji blaszki miażdżycowej,
– nasilenia fibrynolizy,
– osłabienia krzepnięcia,
– zahamowania przebudowy ściany tętnic,
– zmniejszenia masy lewej komory serca,
– korzystnego wpływu na remodeling naczyń i mięśnia serca,
– korekcji niewydolności śródbłonka w cukrzycy i nadciśnieniu tętniczym,
– poprawy podatności naczyń,
– zahamowania szkliwienia kłębuszków nerkowych w cukrzycy.
Inne plejotropowe działania statyn:
– działanie antyarytmiczne,
– zmniejszenie ryzyka udarów mózgu,
– hamowanie progresji cukrzycy,
– działanie immunomodulujące (wydłużenie przeżywalności po przeszczepach),
– pobudzenie osteoblastów i hamowanie osteoklastów (zapobieganie osteoporozie),
– zmniejszenie progresji choroby Alzheimera,
– poprawa nastroju,
– zapobieganie zwapnieniu zastawki aortalnej.
Statyny różnią się pomiędzy sobą siłą i kierunkami działania hipolipemizującego, a także działaniami plejotropowymi. Lowastatyna i fluwastatyna na przykład w największym stopniu wpływają na małe gęste LDL. Atorwastatyna jest wybitnie korzystna w hiperlipidemii mieszanej, gdyż silnie obniża poziom trójglicerydów. Simwastatyna istotnie podwyższa poziom cholesterolu HDL.
Skuteczność statyn w profilaktyce wtórnej i pierwotnej chorób układu krążenia potwierdziły dziesiątki badań naukowych. Przełomowym badaniem było badanie 4S z simwastatyną, w którym po raz pierwszy wykazano 30% redukcję śmiertelności ogólnej, a ponadto stwierdzono 42% redukcję ryzyka zgonu z przyczyn sercowo-naczyniowych, 34% redukcję poważnych incydentów wieńcowych i 37% redukcję zabiegów rewaskularyzacyjnych.
Rolę statyn w zapobieganiu ponownym incydentom wieńcowym potwierdziły, m.in. badania CARE i LIPID, w których prawastatyna zmniejszała liczbę zgonów i poważnych incydentów wieńcowych w profilaktyce wtórnej u osób ze średnimi stężeniami cholesterolu całkowitego.
Najnowsze badania, jak HPS z simwastatyną u chorych wysokiego ryzyka wieńcowego i LIPS z fluwastatyną u pacjentów po przebytej angioplastyce naczyń wieńcowych dowiodły, że korzyści z leczenia statyną odnoszą wszyscy, niezależnie od wyjściowego poziomu cholesterolu całkowitego (w badaniach LIPS i HPS poziom ten przekraczał zaledwie 135 mg/dl). Jeszcze lepsze rezultaty uzyskano dla podgrup chorych z cukrzycą. Cukrzycę traktuje się od niedawna jako równoważnik choroby wieńcowej.
Badania AFCAPS/TexCAPS z lowastatyną i WOSCOPS z prawastatyną wykazały celowość używania statyn w profilaktyce pierwotnej.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Air Force/Texas Coronary Atherosclerosis Prevention Study. Am. J. Cardiol., 1997, 80, 287-293. 2.Assman G. et al.: Hypertriglyceridemia and elevated lipoprotein (a) are risk factors for major coronary events in middle-aged men. Am. J. Cardiol., 1996, 77/14, 1179-1184. 3.Bainton D. et al.: Plasma triglyceride and HDL cholesterol as predictors of ischaemic heart disease in British men - the Caerphilly and Speedwell collaborative heart disease studies. Brit. Heart. Jnl., 1992, 68(1), 60-66. 4.Bednarska-Makaruk M., Pasierski T.: Statyny. Wydawnictwo Medycyna Praktyczna, 2000. Wydanie I. 5.Cholesterol and Recurrent Events. N. Engl. J. Med., 1996, 335, 1001-1009. 6.Cholesterol and Recurrent Events substudy. Circulation 1998, 98, 839-844. 7.Crouse J.R., 3rd et al.: Effects of High Doses of Simvastatin and Atorvastatin on High Density Lipoprotein Cholesterol and Apolipoprotein A - I. Am. J. Cardiol., 1999, 83, 1476-1477. 8.Enas E.A. et al.: Prevalence of coronary artery disease in Asian Indians. Am. J. Cardiol., 1992, 70(9), 945-949. 9.Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment. JAMA 2001, 285, 2486-2497. 10.Filipiak J., Opolski G. (red.): Statyny. Zarys Farmakologii klinicznej. Ośrodek Informacji Naukowej "Polfa" Sp. z o.o., 2001. Wydanie I. 11.Gaziano J.M. et al.: Fasting triglycerides, high density lipoprotein and risk of myocardial infarction. Circulation 1997, 96, 2520-2525. 12.Gotto A.M.: Triglyceride The Forgotten Risk Factor. Circulation 1998, 97, 1027-1028. 13.Haim M. et al.: Elevated serum triglycerides levels and long-term mortality in patients with coronary heart disease. Circulation 1999, 100, 475-482. 14.Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20 536 high-risk individuals: a randomised placebo-controlled trial. Lancet 1994, 344, 1383-1389. 15. Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 5963 people with diabetes: a randomized placebo-controlled trial. Lancet 2003, 361, 2005-2016. 16.Kaplinsky E.: The BIP Study Hot Line 1. XX th ESC Congress, Vienna, August 23 rd 1998. 17.Long-term Intervention with Pravastatin in Ischemic Disease. N. Engl. J. Med., 1998, 339, 1349-1357. 18.Manson J.E. et al.: The primary prevention of myocardial infarction. N. Engl. J. Med., 1992, 326, 1406-1416. 19.Orłowski W. (red.): Nauka o chorobach wewnętrznych. Tom II, rozdział 10: Jasiński K., Choroba niedokrwienna serca. PZWL, 1988. 20.Scandinavian Simvastatin Survival Study. N. Engl. J. Med., 1997, 336, 332-336, Circulation 1998, 97, 1453-1466. 21.Scandinavian Simvastatin Survival Study. Substudy Ann. Intern. Med., 1999, 59, 2661-2667. 22.Serruys P.W.J.C. et al.: Fluvastatin for prevention of cardiac events following successful first percutaneus coronary intervention. A randomized controlled trial. JAMA 2002, 287, 3215-3222. 23.Szostak W.B. (red.): Hiperlipidemia a choroby układu krążenia. Instytut Żywności i Żywienia 1995, Wydanie II. 24.West of Scotland Coronary Prevention Study. N. Engl. J. Med., 1995, 333, 1301-1307.


