© Borgis - Medycyna Rodzinna 4/2008, s. 88-95
*Julita Kulbacka, Jolanta Saczko, Agnieszka Chwiłkowska, Mateusz Ługowski, Teresa Banaś
Fototerapia jako alternatywna metoda leczenia nowotworów
Phototherapy – an alternative anticancer treatment
Katedra i Zakład Biochemii Lekarskiej, Uniwersytet Medyczny we Wrocławiu
Kierownik Katedry i Zakładu: prof. dr hab. Andrzej Gamian
Summary
The light is applied in the treatment since thousands years, but photodynamic therapy (PDT) is a relatively new method of anticancer therapy in which a tumor-selective photosensitizer is administered and then activated by exposure to light of the proper wavelength. PDT is applied to selective diagnosis and treatment of various malignances. Currently PDT is practical in oncology, dermatology, urology, ophthalmology and gynecology. Phototherapy is also an alternative method for cosmetology and esthetic surgery. This combined treatment leads to the generation of reactive oxygen species (ROS), such as singlet molecular oxygen, hydroxyl radicals, and/or superoxide anions. Oxidative stress causes damage to cellular macromolecules such as nucleic acids, proteins and lipids. PDT damages the tumor cells in very selective way, without impairing normal cells. There are main ways, that PDT affects malignant cells. The first is by the ROS, which are generated during photodynamic reaction. ROS can directly damage tumor cells with the angiogenesis arrest. Finally, PDT can activate the immunological response. These mechanisms can be involved together and be applied to controlled cancer treatment. The effects of PDT are detectable on the molecular, subcellular, cellular and tissue level. Many studies confirm that photodynamic therapy causes inactivation of mitochondrial membrane enzymes and Na/K pump. PDT induces damage of lysosomes with the simultaneously release of hydrolytic enzymes. On the tissue level we can observe the damage of tumor vessels and ischemia. Processes after PDT are very complicated and depend on many factors. The present studies point towards explanation of these mechanisms to optimize therapy conditions and to achieve the best therapeutic effect.

Rozwój badań nad fototerapią
Światło wykorzystuje się w terapii od kilku tysięcy lat do leczenia łuszczycy, krzywicy, bielactwa i raka skóry (1, 2). Fototerapia została rozpowszechniona pod koniec dziewiętnastego wieku przez Niels´a Fiensen´a. Odkrył on, że światło o barwie czerwonej może być wykorzystywane do leczenia ospy, ponieważ chroni przed tworzeniem wysypki oraz wysiękiem z pęcherzyków. Wykorzystywał również światło ultrafioletowe z widma słonecznego do leczenia gruźlicy skóry. Niels Fiensen zapoczątkował nowoczesną terapię „świetlną” a w 1903 roku za swoje odkrycia otrzymał nagrodę Nobla (2, 3, 4).
W 1900 roku Oscar Raab odkrył, że fale o określonej długości w obecności akrydyny są śmiercionośne dla organizmów z gatunku Paramecium. W tym samym roku, J. Prime zauważył, że u pacjentów z epilepsją, którzy byli leczeni eozyną, powstawała dermatoza w miejscach wystawianych na słońce (odczyn fototoksyczny). Odkrycie to skłoniło von Tappeiner´a i Jesioneka do rozpoczęcia terapii nowotworów skóry, za pomocą eozyny i białego światła. Zjawisko to zostało opisane jako „działanie fotodynamiczne” i było początkiem współczesnej i nowoczesnej terapii fotodynamicznej (PDT) (2, 3, 5). W połowie XIX wieku odkryto hematoporfiryny, które są obecnie najczęściej stosowanymi fotouczulaczami. Otrzymuje się je w wyniku chemicznego rozkładu hemoglobiny prowadzącego do wydzielania i demetalizacji czerwonego barwnika krwi – hemu. Ma to istotne znaczenie w ich stosowaniu, gdyż są łatwo metabolizowane przez organizm i nie daje toksycznych skutków ubocznych (6). W. Hausmann przeprowadził pierwsze badania z tymi związkami. Odnotował, że działanie hematoporfiryn i światła na pantofelki i erytrocyty, powodowało ich śmierć. Przeprowadził również reakcje na skórze myszy: naświetlał ją po wcześniejszym podaniu czynnika fotouczulającego. W 1913 roku Friedrich Meyer-Betz jako pierwszy rozpoczął terapię na ludziach. Zastosował u siebie dożylnie 200 mg hematoporfiryny, następnie w miejscach poddanych działaniu światła pojawiła się opuchlizna (2, 5). W 1924 roku Policard stwierdził zwiększoną, czerwoną fluorescencję guzów nowotworowych u myszy, podczas naświetlania ich światłem ultrafioletowym. Fluorescencja pojawiła się w miejscach zwiększonej kumulacji endogennych porfiryn. W latach czterdziestych Auler i Banzer odkryli, że hematoporfiryna i jej pochodne ulegają selektywnej koncentracji oraz są zatrzymywane w tkankach nowotworowych. W 1957 roku Schwartz odkrył, że nieoczyszczona hematoporfiryna jest mieszaniną wielu porfiryn i w tej formie jest lepszym fotouczulaczem. W latach sześćdziesiątych kontynuowano badania nad zastosowaniem pochodnych hematoporfiryny HpD (ang. hematoporphyrin derivative) do wykrywania zmian nowotworowych u ludzi (5). W tym samym czasie, Richard Lipson i współpracownicy w klinice Mayo w USA zapoczątkowali erę nowoczesnej PDT (7). Lipson i Baldes zastosowali HpD w diagnostyce nowotworów, ponieważ wykorzystuje się jej właściwości fluorescencyjne i wybiórczą lokalizację w guzach (3, 7, 8). Jest to związane z wysoką przenikalnością HpD przez naczynia krwionośne, jej powinowactwem do proliferującego endotelium oraz brakiem naczyń limfatycznych w guzach (1, 3, 7, 8).
W 1972 roku I. Diamond i wsp. postulowali, że połączenie własności lokalizacji tkanki nowotworowej i własności fototoksycznych porfiryn można wykorzystywać do niszczenia komórek nowotworowych. Badania in vivo na szczurach dowiodły, że PDT opóźnia wzrost guzów. Przełomu w terapii fotodynamicznej dokonał w 1975 roku Thomas Dougherty i wsp., którzy odkryli, że zastosowanie HpD i czerwonego światła całkowicie blokuje wzrost guza sutka u myszy i powoduje jego częściową martwicę (2, 9, 10, 11). W 1976 roku Kelly i wsp. zapoczątkowali pierwsze próby HpD na ludziach – zastosowali PDT u pacjentów z rakiem pęcherza moczowego. HpD spowolniło wzrost guza, natomiast w miejscach stosowania terapii obserwowano zmiany nekrotyczne tkanki nowotworu. Dougherty przeprowadził badania na 113 pacjentach z pierwotnymi i wtórnymi guzami skóry. Całkowitą odpowiedź zaobserwował u 98 pacjentów, u 13 częściową a dwóch było całkowicie opornych na terapię (2, 12, 13). PDT jest często polecana pacjentom we wczesnym stadium choroby, szczególnie w przypadku nowotworów nieoperacyjnych, aby uniknąć dalszych komplikacji. Obecnie stosuje się tę terapię u pacjentów z rakiem piersi, guzami ginekologicznymi, wewnątrzgałkowymi, śródotrzewnowymi, mózgu, głowy, szyi, raka jelita i odbytnicy, nowotworami powierzchniowymi, międzybłoniakami, rakiem dróg żółciowych i trzustki (14, 15, 16).
Mechanizm działania PDT
PDT wykorzystuje działanie trzech czynników, które oddziaływują na tkanki i komórki. Pierwszym jest fotouczulacz – wrażliwy na światło związek, który lokalizuje się w tkance i uczula ją na działanie światła. Drugim czynnikiem jest światło o odpowiedniej długości fali, wzbudzające zakumulowany w tkance nowotworowej fotouczulacz. Trzecim czynnikiem jest tlen rozpuszczony w tkance. Wzbudzony związek przenosi energię z fali świetlnej na tlen cząsteczkowy a następnie generuje jego reaktywne formy (RFT). RFT pojawiają się natychmiast w miejscu ulokowania fotouczulacza. Długość fali wzbudzenia musi być właściwie dobrana do zastosowanego fotosensybilizatora. Warunkiem zainicjowania reakcji fotochemicznej jest korelacja pasma emisji źródła światła z pasmem absorpcji barwnika (2, 15, 17). Biologiczne odpowiedzi na terapię fotodynamiczną są uruchamiane tylko w tych miejscach tkanki, która została poddana PDT (2, 3).
Fotouczulacze mogą być dostarczane do organizmu poprzez iniekcję lub zastosowanie bezpośrednio na skórę (18). Sposób podania wpływa na biodystrybucję tego związku. Po absorpcji światła (fotonu), fotouczulacz ze swojego stanu podstawowego (stan singletowy) jest przekształcany do stanu wzbudzenia relatywnie długiego życia (stan trypletowy) przez singletowy stan wzbudzenia krótkiego życia. W stanie trypletowym może ulegać dwóm typom reakcji (ryc. 1). Reaktywny fotouczulacz w pierwszej kolejności niszczy błony komórek i organelli subkomórkowych. Pierwszy typ reakcji zachodzi poprzez wolne rodniki, które oddziałują z tlenem i produkują utlenione produkty. Fotouczulacz w stanie trypletowym może przenosić swoją energię bezpośrednio na tlen i tworzyć tlen singletowy – bardzo reaktywną formę tlenu (RFT) (II typ reakcji) (14, 15, 19, 20, 21). Ponieważ działanie prawie wszystkich fotouczulaczy jest zależne od tlenu, więc fotouczulanie nie zachodzi w niedotlenionych komórkach. Badania in vivo pokazały, że wywołanie niedotlenienia tkanki poprzez ucisk naczyń krwionośnych, znosi efekt PDT (2). Oba typy reakcji (I i II) zachodzą równocześnie a stosunek pomiędzy tymi procesami zależy od rodzaju zastosowanego fotouczulacza, stężenia substratu i tlenu oraz zdolności wiązania fotouczulacza do substratu. RFT są wysoko reaktywne i mają krótki czas połowicznej przemiany (22, 23). Tylko te komórki ulegają terapii fotodynamicznej, które są najbliżej obszaru wytwarzania RFT (najczęściej jest to obszar akumulacji fotouczulacza) (16, 21, 25). Czas połowicznej przemiany tlenu singletowego w układzie biologicznym jest <0,04 μs, zatem promień jego działania jest <0,02 μm (24). Tlen singletowy żyje dostatecznie długo, aby utleniać różne struktury komórkowe w dalszych partiach komórki. Zasięg działania terapii oraz jej cytotoksyczności jest wieloczynnikowy i zależy od typu fotouczulacza, jego wewnątrz i zewnątrzkomórkowej lokalizacji, dostarczonej dawki fotouczulacza i światła, dostępności tlenu i czasu pomiędzy dostarczeniem fotouczulacza a ekspozycją na światło (19, 22, 25, 26). Trzeci mechanizm, w przeciwieństwie do dwóch pierwszych mechanizmów, jest niezależny od obecności tlenu rozpuszczonego w tkance. Fotouczulacz będący w singletowym stanie wzbudzonym reaguje bezpośrednio z biomolekułami, co prowadzi do powstawania różnych fotoadduktów (27). Jednak transfer elektronów pomiędzy biomolekułą a fotouczulaczem oraz powstanie wolnych rodników są bardzo nieefektywne (termodynamicznie jest faworyzowana reakcja powrotu reagentów do ich stanu podstawowego), dlatego ten mechanizm reakcji PDT jest często pomijany (28).
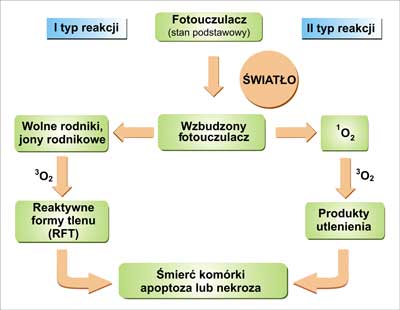
Ryc. 1. Dwa typy reakcji w terapii fotodynamicznej (Graczyk 2001, Dolmans 2003, Capella 2003).
Właściwości fotosensybilizatorów
Fotosensybilizatory odgrywają istotną rolę w terapii fotodynamicznej. Są to związki ulegające aktywacji pod wpływem światła o odpowiedniej długości fali. Aby fotouczulacz mógł być wykorzystany w diagnostyce i leczeniu metodą fotodynamiczną powinien spełniać określone warunki. Właściwości dobrych fotouczulaczy (19, 29, 30, 31):
– możliwość selektywnego gromadzenia się w tkance nowotworowej, przez co najmniej kilkadziesiąt godzin (70-150 h);
– nie wywoływanie efektów fototoksycznych (cytotoksyczność i mutagenność) w zdrowych tkankach; wykazywanie maksymalnie intensywnych pasm absorpcji w „oknach transmisyjnych” tkanki, tzn. ważne jest, aby promieniowanie wnikało możliwie najgłębiej w tkanki i docierało do obszarów terapeutycznych. Aby ten warunek mógł być spełniony, promieniowanie musi trafiać w tzw. okno optyczne skutecznej transmisji w wodzie (ryc. 2), rozciągające się od 400-1500 nm i nie może pokrywać się z pasmami absorpcji w obszarze widzialnym barwników endogennych, takich jak melanina, hemoglobina, oksyhemoglobina. Promieniowanie, które może wywołać ewentualne efekty terapeutyczne powinno przypadać na zakres długości fali od 600 nm do 1100 nm (32);
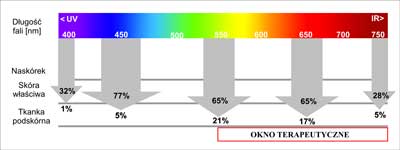
Ryc. 2. Absorcja światła przez poszczególne warstwy ludzkiej skóry (wg Karu 1989).
– wykazywanie w reakcji ze światłem wysokiej wydajności tlenu singletowego lub rodnikowych form utleniających, co gwarantuje wysoką cytotoksyczność komórek nowotworowych;
– powodowanie jak najmniejszych efektów ubocznych.
Kryteria stawiane fotouczulaczom do zastosowań terapii fotodynamicznej są bardzo wysokie. Trudno znaleźć takie, które spełniałyby wszystkie wymagania. Dotychczas przebadano setki znanych i nowosyntezowanych związków oraz leków wykazujących własności fotouczulające (29, 33). Właściwości fotouczulające i cytotoksyczne fotosensybilizatorów zależą od ich struktury chemicznej, własności fizykochemicznych, zdolności wnikania oraz retencji w tkance nowotworowej. Ze względu na różną strukturę monoferyczną tkanek w różnych nowotworach oraz wysoką heterogeniczność nowotworów (zawartość endogennej martwicy i unaczynienie guza), jeden fotouczulacz nie będzie skuteczny we wszystkich typach nowotworów. Fotosensytyzery można podzielić w zależności od wiodących parametrów, związanych z rozpuszczalnością w wodzie bądź w tłuszczach:
– fotouczulacze hydrofobowe wykazują preferencję do oddziaływania z lipidami, czyli są lipofilowe i gromadzą się w lipidowych częściach komórki;
– fotouczulacze hydrofilowe są rozpuszczalne w wodzie i trudno przechodzą przez domeny lipidowe w komórce, kumulują się w wodnej części komórki. Dodatkowo można je podzielić na: kationowe, które po rozpuszczeniu w wodzie tworzą czynnik fotouczulający będący jonem dodatnim; anionowe, tworzą w roztworze wodnym jon obdarzony jednym lub wieloma ładunkami ujemnymi;
– fotouczulacze amfifilowe, zawierają w swej strukturze jednocześnie fragment hydrofobowy i hydrofilowy, mogą oddziaływać z domenami lipidowymi oraz uwodnionymi fragmentami komórki. Do tych barwników należą pochodne porfirynowe, które mają różne łańcuchy boczne rozłożone niesymetrycznie wokół pierścienia makrocyklicznego. Fragment cząsteczki porfiryny najbardziej oddalony od podstawników bocznych, czyli makropierścień porfirynowy wykazuje własności hydrofobowe, natomiast podstawniki, posiadające grupy polarne wykazują własności hydrofilowe (15, 29, 31). Właśnie tego typu fotosensybilizatory mają największe znaczenie kliniczne, ze względu na możliwość łączenia się ze sferą lipidową jak i wodną komórki (29). Obecnie wynajduje się bardziej selektywne i silniejsze fotouczulacze, które są w fazie prób klinicznych (tab. 1) (2, 3). Nowa generacja fotouczulaczy poprawi metody diagnostyczne, udoskonali wydajność oraz skuteczność samej PDT (15, 29, 34, 35).
Tabela 1. Fotouczulacze stosowane w chorobach nowotworowych (wg Moan 2003 i Dolmans 2003).
| Fotouczulacz | Nazwa firmowa | Zastosowanie | Fala wzbudzenia |
HPD (częściowo oczyszczona)
Porfimer sodu | Photofrin | Rak szyjki macicy*, pęcherza moczowego*, przełyku, węwnątrzoskrzelowy, żołądka i guzy mózgu | 630 nm |
| BPD-MA (benzo-porfiryna) | Verteporfin | Rak podstawnokomórkowy | 689 nm |
| m-THPC (meta-tetrahydroksyfenylochloryn) | Foscan | Guzy głowy*, szyi*, prostaty i trzustki | 652 nm |
| 5-ALA (kwas 5-aminolewulinowy) | Levulan | Rak podstawnokomórkowy, rak głowy i karku oraz guzy ginekologiczne
Diagnostyka guzów mózgu, głowy, szyi pęcherza moczowego | 635 nm
375-400 nm |
| pochodna metylowa 5-ALA | Metvix | Rak podstawnokomórkowy (1) | 635 nm |
| pochodna benzylowa 5-ALA | Benzvix | Nowotwory żołądkowo-jelitowe | 635 nm |
| pochodna heksylowa 5-ALA | Hexvix | Diagnostyka guzów pęcherza moczowego | 375-400 nm |
| SnET2 (etiopurpuryna cyny) | Purlytin | Powierzchniowe przerzuty raka piersi, rak podstawnokomórkowy, mięsak Kaposi´ego, rak prostaty | 664 nm |
| Protoporfiryna borowa | BOPP | Guzy mózgu | 630 nm |
| PPH (2-(1-heksyloksetyl)-2-dewinylo alfa-pirofeoforbidu) | Photochlor | Rak podstawnokomórkowy | 665 nm |
| Teksafiryna lutetu | Lutex | Rak szyjki macicy, prostaty i guzy mózgu | 732 nm |
| Ftalocyjanina 4 | Pc 4 | Powierzchniowe i podskórne zmiany patologiczne pochodzenia nowotworowego | 670 nm |
| Taporfina sodowa | Talaporfin | Jednolite guzy różnego pochodzenia | 664 nm |
* Wskazania zarejestrowane w jednym i więcej krajów (pozostałe wskazania są w fazie rozwoju) (Dolmans 2003).
Fotouczulacze porfirynowe
Fotouczulacze porfirynowe, pochodne czerwonego barwnika krwi – hemu, są najlepiej przebadaną grupą związków. W zależności od zmodyfikowania pierścienia porfirynowego przez podstawniki boczne, pochodne pofrirynowe występują we wszystkich trzech klasach fotouczulaczy: hydrofobowych, hydrofilowych i amfifilowych. Pochodne porfirynowe są wykorzystywane jako fotosensybilizatory w procesie niszczenia komórek nowotworowych, płytek miażdżycowych i terapii przeciwwirusowej (1, 29, 31). Większość pochodnych porfirynowych zarówno w badaniach in vitro jak i in vivo działa po połączeniu się ze strukturami błon, cytoplazmy, mitochondriów, siateczki śródplazmatycznej oraz jąder komórkowych. Wielkość uszkodzeń, powodowanych na poziomie komórkowym przez wzbudzone światłem porfiryny zależy od struktury i własności tych związków (25, 33, 34).
Wszystkie barwniki porfirynowe mają większą lub mniejszą tendencję do agregacji, co wpływa na ich własności cytostatyczne. W licznych badaniach wykazano, że zdolność do produkcji wysokoutleniających mediów cytotoksycznych (tlen singletowy, wolne rodniki) maleje ze wzrostem stopnia agregacji, bowiem tylko monomery mogą wydajnie produkować tlen singletowy (35, 36, 37). Wydajność terapii fotodynamicznej zależy od lokalizacji stosowanej porfiryny w organellach komórkowych. Najefektywniej działa taki fotosensybilizator, który jest przyłączany bezpośrednio do błony komórkowej lub organellum komórki nowotworowej. Związane jest to z krótką drogą dyfuzji tlenu singletowego w materiale biologicznym (0,1 ?m). Z kolei lokalizacja barwnika dostarczonego do tkanki nowotworowej zależy głównie od:
– fizykochemicznych własności fotouczulacza;
– warunków środowiska w tkance nowotworowej (pH wewnątrz komórki);
– natury nośnika (jeżeli barwnik jest hydrofobowy to nośnikiem jest emulsja tłuszczowa, sztuczne liposomy lub kompleksy z LDL);
– czasu inkubacji (29, 31).
Działanie PDT na tkankę nowotworową
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Daniell MD, Hill JS: A history of photodynamic therapy. Aust N Z J Surg 1991; 61(5): 340-348. 2. Dolmans DE, Fukumura D, Jain RK: Photodynamic therapy for cancer. Nature 2003; 5(3): 380-387. 3. Moan J, Peng Q: An outline of the hundred-year history of PDT. Anticancer Res 2003; 23(5A): 3591-600. 4. Kato H: History of photodynamic therapy–past, present and future. Gan To Kagaku Ryoho 1996; 23(1): 8-15. 5. Ackroyd R et al.: The history of photodetection and photodynamic therapy. Photochemistry and Photobiology 2001; 74(5): 656-669. 6. Berns MW: Hematoporfirin derivative photoirradiation therapy. Las Surg Medic 1984; 2: 1-4. 7. Lipson RL, Blades EJ, Olsen AM: The use of an derivative of hematoporphyrin in tumor detection. J Natl Cancer Inst 1961; 26:1-11. 8. Lipson RL, Blades EJ: The photodynamic properties of a particular hematoporphyrin derivative. Arch Dermatol 1960; 82: 508-516. 9. Dougherty TJ: Activated dyes as antitumor agents. J Natl Cancer Inst 1974; 52: 1333-1336. 10. Dougherty TJ et al.: Photoradiation therapy. II. Cure of animal tumors with hematoporphyrin and light. J Natl Cancer Inst 1975; 55: 115-121. 11. Dougherty TJ: Photosensitizers: therapy and detection of malignant tumors. Photochem Photobiol 1987; 45: 879-889. 12. Dougherty TJ et al.: Photoradiation therapy for the treatment of malignant tumors. Cancer Res 1978; 38: 2628-2635. 13. Dougherty TJ: Photoradiation therapy. Urology 1984; 23(3 Suppl): 61-64. 14. Pass HI: Photodynamic therapy in oncology: mechanisms and clinical use. J Natl Cancer Inst 1993; 85: 443-456s. 15. Graczyk A: Biochemiczne i biofizyczne podstawy fotodynamicznej metody wykrywania i leczenia nowotworów, Fotodynamiczna metoda rozpoznawania i leczenia nowotworów. Dom Wydawniczy Bellona, Warszawa 1999: 21-73. 16. Marcus SL, McIntire WR: Photodynamic therapy systems and applications. Expert Opin Emerging Drugs 2002; 7: 319-331. 17. Dougherty TJ et al.: Photodynamic therapy. J Nat Cancer Inst 1998; 90(12): 889-905. 18. Kessel D: Photodynamic therapy: from the beginning. Photodiag Photodyn Ther, 2004; 1, 3-7. 19. Ricchelli F: Photophysical properties of porphyrins in biological membranes. J Photochem Photobiol B: Biol 1995; 29:109-118. 20. Lukšienë Ž: Photodynamic therapy: mechanism of action and ways to improve the efficiency of treatment. Medicina 2003; 39(12): 1137-1150. 21. Vrouenraets MB et al.: Basic principles, applications in oncology and improved selectivity of photodynamic therapy. Anticancer Res 2003; 23: 505-522. 22. Scheffer GL et al.: Specific detection of multidrug resistance proteins MRP1, MRP2, MRP3, MRP5 and MDR3 P-glycoprotein with panel of monoclonal antibodies. Cancer Res 2000; 60: 5269-5277. 23. Valko M et al.: Free radicals, metals and antioxidants in oxidative stress-induced cancer. Chem-Biol Interact 2006; 160: 1-40. 24. Moan J, Berg K: The photodegradation of porphyrins in cells can be used to estimate the lifetime of singlet oxygen. Photochem. Photobiol 1991; 53: 549-553. 25. Castano AP, Demidova TN, Hamblin MR: Mechanisms in photodynamic therapy: part one – photosensitizers, photochemistry and cellular localization. Photodiag Photodyn Ther 2004; 1: 279-293. 26. Castano AP, Demidova TN, Hamblin MR: Mechanisms in photodynamic therapy: part three – photosensitizer pharmacokinetics, biodistribution, tumor localization and modes of tumor destruction. Photodiag Photodyn Ther 2005b; 2: 91-106. 27. Capella MAM, Capella LS: A Light in Multidrug Resistance: Photodynamic Treatment of Multidrug-Resistant Tumors. J Biomed Sci 2003; 10: 361-366. 28. Ochsner M: Photophysical and photobiological processes in the photodynamic therapy of tumours. J Photochem Photobiol B, 1997; 39: 1-18. 29. Graczyk A: Fotosensybilizatory używane do diagnostyki i terapii nowotworów metodą fotodynamiczną. Terapia, 2001; 8, z. 2: 110. 30. Bonnett R, Martinez G: Photobleaching of sensitisers used in photodynamic therapy. Tetrahedron 2001; 57: 9513-9547. 31. Juzeniene A, Nielsen KP, Moan J: Biophysical aspects of photodynamic therapy. J Environ Pathol Toxicol Oncol 2006; 25(1-2): 7-28. 32. Boulnois JL: Photophysical processes in recent medical laser developments: a review. Lasers in Med Sci 1986; 1, 47. 33. Honigsmann H: Photodynamic therapy–moving under the right light. J Dtsch Dermatol Ges 2004; 2(12): 981-982. 34. Kessel D, Luo Y: Delayed oxidative photodamage induced by photodynamic therapy. Photochem Photobiol 1996; 64: 601-604. 35. Tudaj A et al.: Światło leczy-wprowadzenie do terapii i diagnostyki fotodynamicznej, Diagnostyka i Terapia Fotodynamiczna. Urban & Partner, Wrocław 2004; 10-13. 36. Kessel D et al.: The role of subcellular localization in initiation of apoptosis by photodynamic therapy. Photochem Photobiol 1997; 65: 422-426. 37. Golab J et al.: Antitumor effects of photodynamic therapy are potentiated by 2-methoxyestradiol. A superoxide dismutase inhibitor. J Biol Chem, 2003; 278: 407-414. 38. Korbelik M, Sun J: Photodynamic therapy-generated vaccine for cancer therapy. Cancer Immunology Immunotherapy 2006; 55(8): 900-909. 39. Almeida RD et al.: Intracellular signaling mechanisms in photodynamic therapy. Biochim Biophys Acta 2004; 1704: 59-86. 40. Castano AP, Demidova TN, Hamblin MR: Mechanisms in photodynamic therapy: part two – cellular, cell metabolism and modes of cell death. Photodiag Photodyn Ther 2005a; 2: 1-23. 41. Henderson BW et al.: Tumor destruction and kinetics of tumor cell death in two experimental mouse tumors following photodynamic therapy. Cancer Res 1985; 45: 572-576. 42. Gollnick SO et al.: Altered expression of interleukin 6 and 10 as a result of photodynamic therapy in vivo. Cancer Res 1997; 57: 3904-3909. 43. Gollnick SO et al.: Stimulation of the host immune response by photodynamic therapy (PDT). Proceedings of SPIE 2004, Laser Interaction with Tissue and Cells XV, 2004; 5319: 60-70. 44. Gollnick SO et al.: IL-10 does not play a role in cutaneous Photofrin photodynamic therapy-induced suppression of the contact hypersensitivity response. Photochem Photobiol 2001; 74(6): 811-816. 45. van Duijnhoven FH et al.: The immunological consequences of photodynamic treatment of cancer, a literature review. Immunobiology 2003; 207(2): 105-113. 46. Jalili A et al.: Effective photoimmunotherapy of murine colon carcinoma induced by the combinationn of photodynamic therapy and dendritic cells. Clin Cancer Res 2004; 1; 10(13): 4498-4508. 47. Plaetzer K et al.: The modes of cell death induced by PDT: an overview. Med Laser Appl 2003; 18:7-19. 48. Liczmański AE: Toksyczność tlenu. I. Uszkodzenia żywych komórek. Post. Biochemii 1988a; 34: 273-292. 49. Liczmański AE: Toksyczność tlenu. II. Mechanizmy obronne. Post. Biochemii 1988b; 34: 293-310. 50. Sheu S-S, Nauduri D, Anders MW: Targeting antioxidants to mitochondria: A new therapeutic direction. Biochim Biophys Acta 2006; 1762: 256-265. 51. Kelley EE, Buettner GR, Burns CP: Production of lipid-derived free radicals in L1210 murine leukemia cells is and early event in the photodynamic action of Photofrin. Photochem Photobiol 1997; 64: 576-580. 52. Bailey MS, Landar A, Darley-Usmar V: Mitochondrial proteomics in free radical research. Free Rad Biol Med 2005; 38: 175-188. 53. Tajiri H et al.: Changes in intracellular Ca2+ concentrations related to PDT-induced apoptosis in photosensitized human caner cells. Cancer Lett 1998; 128: 205-210. 54. Ponczek MB, Wachowicz B: Oddziaływanie reaktywnych form tlenu i azotu z białkami. Postępy Biochemii 2005; 51(2): 140-145. 55. Berg K et al.: Photochemical internalization: a novel technology for delivery of macromolecules into cytosol. Cancer Res 1999; 59: 1180-1183. 56. Zychowicz J et al.: Zastosowanie metody fotodynamicznej do zwalczania grzybów chorobotwórczych, Diagnostyka i Terapia Fotodynamiczna, Urban & Partner. Wrocław 2004: 315-317. 57. Hongcharu W et al.: Topical ALA-photodynamic therapy for the treatment of acne vulgaris. J Invest Dermatol 2000; 115: 183-192. 58. Gawlik J et al.: Terapia fotodynamiczna alternatywą w leczeniu wybranych nienowotworowych chorób skóry. Terapia 2005; 3(163). 59. Paulino TP et al.: Use of Visible Light-based Photodynamic Therapy to Bacterial Photoinactivation. Biochemistry and Molecular Biology Education 2005; 33(1): 46-49.


