Katarzyna Osiak
Przerostowe blizny, bliznowce i przykurcze bliznowate
Keloids, contractures and hypertrophic scars
z Kliniki Chirurgii Plastycznej Centrum Medycznego Kształcenia Podyplomowego w Warszawie
Kierownik Kliniki: prof. dr hab. med. Józef Jethon
Streszczenie
Każdy organizm, u którego doszło do uszkodzenia tkanek w wyniku urazu, dąży do jak najszybszego odtworzenia ciągłości powłok. W miejscu urazu powstaje tkanka zastępcza – blizna. U niektórych predysponowanych osobników wszelkie procesy naprawcze wykazują zbyt dużą intensywność, co prowadzi do powstawania blizn przerostowych lub bliznowców. Dotychczasowe leczenie nie daje satysfakcjonujących wyników. Przegląd piśmiennictwa daje wgląd w aktualny stan wiedzy na temat procesów gojenia w ranie, tworzenia blizny i metod leczenia. Pozwala to zrozumieć, jakie warunki predysponują do wytwarzania nadmiernej tkanki bliznowatej, oraz w którym etapie gojenia należy wdrożyć leczenie.
Summary
Any life-form will protect itself as soon as possible against microorganisms and water loss when trauma violates its cutaneous integrity. These processes leads to scar formation. In predisposed individuals, however, these wound healing processes show a kind of over-healing and produce an overabundant wound matrix responsible for raised, red hypertrophic scar. Several tratment modalities are used at present, with unsatisfactory results, most probably because the exact mechanism of the derailment is unknown. A review of the recent literature gave insight into the present knowledge of wound healing deraiment, scar tissue formation and treatment modalities. An attempt was made to gain insight into which individual is predisposed and at what point during the wound – healing processes the derailment starts to find a point of application for treatment.

Po urazie z uszkodzeniem powłok organizm dąży do jak najszybszego odtworzenia ciągłości tkanek, zamknięcia skóry, aby zapobiec inwazji mikroorganizmów oraz utracie wody. Bezpośrednio po urazie, aby zapobiec nadmiernej utracie krwi uruchamiane są mechanizmy hemostazy prowadzące do powstania skrzepu, który tymczasowo wypełnia ubytek powłok. Faza skrzepu trwa do 6-7 doby.
Rana zostaje oczyszczona przez komórki zapalenia migrujące wzdłuż macierzy skrzepu, a następnie pojawiają się proliferujące komórki śródbłonka, fibroblasty oraz komórki naskórka. Powstają nowe naczynia krwionośne oraz nowa zewnątrzkomórkowa macierz, która łączy brzegi uszkodzonej skóry i staje się początkiem tkanki zastępczej, która zamyka otwartą ranę. Faza migracyjna nazywana również fazą zapalenia trwa do 12 doby. Trzecią fazę gojenia zwaną proliferacyjną charakteryzuje powstawanie włókien kolagenowych i elastynowych, które budują mocny i elastyczny szkielet wypełniany następnie przez cząsteczki proteoglikanów i glikoprotein scalający macierz i komórki gojenia w ranie. Faza ta trwa do 3-4 tygodni. Ostatecznie krzyżujące się włókna kolagenowe nadają siłę powstałej tkance, jaką jest blizna. W ostatnim etapie dochodzi do modelowania blizny, a procesy te trwają do ok. 2 lat (ryc. 1).
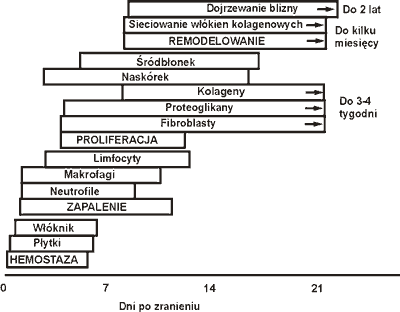
Ryc. 1. Orientacyjny czas trwania poszczególnych czterech faz gojenia rany chirurgicznej (rycina adaptowana z pracy Tibbsa, 1997; okresy przebiegu faz zostały zmienione, po uwzględnieniu danych innych autorów).
Czasem istnieją osobnicze skłonności do nadmiernej reakcji gojenia i do powstawania przerosłej, czerwonej i twardej tkanki bliznowatej, czasem swędzącej i bolesnej, stwarzającej pacjentowi problemy estetyczne i funkcjonalne. Mechanizm powstawania przerostowej blizny pozostaje ciągle nieznany, co nie pozwala na wdrożenie odpowiedniego leczenia.
Wstęp
Pierwsze wzmianki o przerostowej bliźnie pochodzą z papirusa Smitha ok. 1700 r. p.n.e., ale dopiero w 1806 roku Albert opisał tę tkankę jako rakopodobny guz nazwany cancroidem a później keloidem. W 1962 r. Mancini, a w 1970 Peacoc podali definicję blizny przerostowej oraz keloidu. Za bliznę przerostową uważa się nadmierną tkankę bliznowatą, która wznosi się ponad poziom skóry pozostając w granicach rany, ulega częściowemu samoistnemu zanikowi, może powodować przykurcz w gojącej się tkance, po wycięciu nie ma tendencji do nawrotów.
Keloidem nazwano guz bliznowaty, swoimi rozmiarami przekraczający granice rany, o dużych skłonnościach do nawracania. W 1990 roku Muir wyróżnił trzecią, pośrednią grupę blizn, które pozostając w granicach pierwotnej rany mają skłonności do przerastania.
Blizny przerostowe pojawiają się ok. 4 tygodnie po urazie, podczas gdy keloid pojawia się ok. 3 miesiące do kilku lat po urazie. Towarzyszy mu często świąd i miejscowa bolesność. Guzowaty wygląd może stanowić problem estetyczny u rasy białej, natomiast niektóre plemiona afrykańskie wykorzystują tę naturalną skłonność do dekorowania swojego ciała w rytualne wzory.
Nie stwierdzono przerastania blizn u zwierząt. Blizny przerosłe i bliznowce występują jedynie u ludzi z podobną częstością u obu płci, najczęściej w drugiej dekadzie życia, w następstwie głębokich oparzeń, urazów oraz po zabiegach operacyjnych.
Pojawiają się na powierzchniach przeciwstawnych do napięcia – zazwyczaj po stronie zginaczy i nigdy po stronie prostowników.
Blizny zlokalizowane wzdłuż naturalnych napięć skóry zazwyczaj nie przerastają.
Keloidy występują ok. 15- krotnie częściej u rasy czarnej, nie obserwowano ich u osobników albinotycznych. Za okolice ciała szczególnie predysponowane do powstawania przerostowych blizn uważa się okolicę mostka, barków i górnej części ramion, płatków usznych.
Nie obserwowano ich natomiast w obrębie powiek, genitaliów, dłoni, rogówki i błon śluzowych.
Przyczyny powstawania przerosłych blizn pozostają ciągle niejasne. Podkreśla się rodzinne występowanie skłonności do przerastania blizn oraz grupę krwi A.Obserwuje się pewien związek pomiędzy powstawaniem keloidów a aktywnością układu odpornościowego. Istnieje ścisła korelacja pomiędzy rasą, płcią, wiekiem oraz poziomem osoczowej immunoglobuliny E.
U pacjentów ze skłonnością do tworzenia keloidów stwierdzono częstsze występowanie chorób alergicznych, badaniem laboratoryjnym stwierdzono podwyższony poziom osoczowej immunoglobuliny M, podwyższony lub ten sam poziom immunoglobuliny G, a obniżony poziom immunoglobuliny A, w porównaniu do pacjentów bez skłonności do tworzenia przerostowych blizn.
Wskazuje się również na rolę czynnika hormonalnego, gdyż keloidy częściej występują w okresie dojrzewania, zanikają w okresie menopauzy a powiększają swoje rozmiary w ciąży.
U pacjentów z keloidalnymi zmianami trądzikowymi stwierdzono wybitnie podwyższony poziom testosteronu w osoczu, co może mieć związek z samą istotą choroby, lub tylko skłonnością do powstawania keloidów.
Skłonność do tworzenia keloidów stwierdzono również w chorobach tkanki łącznej, w zespołach: Ehlersa-Danlosa, Rubinstein-Taybi, sklerodermie.
Patogeneza
Blizny przerostowe i keloidy powstają w wyniku nieprawidłowo przebiegających procesów gojenia rany i pomimo, iż uważano, że różnią się ekspresją tej samej nieprawidłowo przebiegającej reakcji w procesie gojenia rany, leczenie przerostowych blizn jest znacznie łatwiejsze niż keloidów. Dla potwierdzenia teorii o innych mechanizmach odpowiedzialnych za rozwój blizn przerosłych i keloidów odkryto kilka różnic morfologicznych i immunohistochemicznych, o czym będzie mowa poniżej.
Dla lepszego zrozumienia patogenezy przerastania blizn, oraz zastosowania najwłaściwszego leczenia, istotne jest różnicowanie pomiędzy poszczególnymi rodzajami blizn. W literaturze obserwuje się pewne zamieszanie w nazewnictwie, gdyż często zamiennie stosowane są terminy keloid czy blizna przerostowa (tab. 1).
Tabela 1. Ogólna charakterystyka trzech faz gojenia rany: zapalenia, fazy proliferacyjnej i fazy dojrzewania (modyfikowana wg Rudolpha i Shannon, 1990).
| Faza | Ogólna charakterystyka |
| Zapalenia | - Zagregowane wokół uszkodzonego naczynia płytki krwi wydzielają czynniki obkurczające naczynia; wydzielają czynniki chemotaktyczne i wzrostowe dla komórek zapalenia oraz inicjują tworzenie skrzepu.
- Lokalne zakończenia nerwów czuciowych stymulują efekt rozkurczu naczyń.
- Dochodzi do chemoatrakcji i migracji do rany białych krwinek, powodowanych przez kininy i fagocytowania drobnoustrojów oraz tkanek nekrotycznych.
- Monocyty obecne w ranie przekształcają się w makrofagi, inicjując procesy naprawcze przez wydzielanie cytokin. |
| Proliferacyjna | - Wydzielone przez makrofagi chemoatraktyny i czynniki wzrostu są mediatorami ziarninowania i epitelializacji.
- Niezróżnicowane komórki mezenchymatyczne i fibrocyty przekształcają się w fibroblasty.
- Fibroblasty wytwarzają macierz pozakomórkową - kolageny i proteoglikany.
- Zakończenia włośniczek "kiełkują", inicjując proces angiogenezy.
- Keratynocyty rozpoczynają proliferację i migrację, doprowadzając do epitelializacji rany.
- Fibroblasty transformują do miofibroblastów, migrują w obrębie rany i doprowadzają do jej kontrakcji. |
| Dojrzewania | - Dochodzi do masowej apoptozy fibroblastów i komórek mikronaczyń oraz do regresji procesów wytwórczych - syntezy macierzy pozakomórkowej; fibronektyna jest usuwana z rany; wzrasta wytrzymałość mechaniczna blizny.
- Następuje remodelowanie macierzy pozakomórkowej. |
Gojenie ran
Hemostaza
Natychmiast po urazie w ranie dochodzi do agregacji płytek, aktywacji układu krzepnięcia i powstania bogatego w fibrynę skrzepu. Następnie w procesie proteolizy usuwany jest skrzep fibrynowy i zastępowany jest przez macierz bogatą w fibronektyny i kwas hialuronowy.
Pojawienie się w ranie fibroblastów inicjuje procesy fibrynolizy na drodze zwiększenia aktywności aktywatora plazminogenu i obniżenia aktywności inhibitora aktywacji fibrynogenu. Fibroblasty pobrane z keloidów wykazują zaburzenia inicjacji fibrynolizy, ponieważ obniżają poziom aktywatora plazminogenu i zwiększają poziom inhibitora plazminogenu, co powoduje niskie stężenie plazminy. Zahamowanie fibrynolizy może wystąpić również w wyniku zmiany aktywności czynnika wzrostowego-B. Obniża to poziom aktywatora plazminogenu i podwyższa poziom inhibitora aktywacji fibrynogenu w normalnych fibroblastach.
Płytki krwi
Po zakończeniu procesu agregacji, płytki krwi ulegają rozpadowi. W procesie degranulacji płytek dochodzi do uwolnienia czynników wzrostu: naskórkowego, insulinopodobnego, płytkowego i transformującego czynnika wzrostu B, które mają działanie chemotaktyczne dla komórek zapalenia, takich jak granulocyty obojętnochłonne, makrofagi, komórki tuczne, komórki nabłonka, śródbłonka i fibroblasty. Płytki produkują również fibronektyny, które w macierzy rany wskazują miejsca migracji dla komórek zapalenia. Zaburzenia funkcji płytek teoretycznie mogą inicjować następowe nadmierne gojenie w ranie, zwiększając ilość fibronektyn i tkanki ziarninowej, tak jak jest to obserwowane w tkance przerosłej blizny.
Procesy zapalne
Aktywacja kaskady czynników krzepnięcia, kinin, komplementu po urazie prowadzi do uwolnienia licznych mediatorów wasoaktywnych i czynników chemotaktycznych, które łącznie stymulują migrację komórek zapalenia. Granulocyty obojętnochłonne i makrofagi oczyszczają ranę i uwalniają czynniki wzrostu odpowiedzialne za wytworzenie macierzy. Duże rany, takie jak rany oparzeniowe i rany zainfekowane cechują się wybitnie wzmożoną fazą zapalenia, co zwiększa stężenie cytokin i prowadzi do produkcji przerosłej blizny lub keloidu.
Makrofagi
Makrofagi pełnią rolę zwrotną pomiędzy przejściem rany z fazy zapalnej w ziarninę. Mogą inicjować powstawanie przerostowej blizny lub bliznowca na drodze uwalniania cytokin aktywujących fibroblasty.
Makrofagi produkują również interleukinę 1A i 1B odpowiedzialną nie tylko za indukowanie migracji komórek zapalenia, ale również za degradację macierzy zewnątrzkomórkowej. Interleukina 1 stymuluje uwalnianie metaloproteinaz macierzy, które indukują aktywność kolagenazy w połączeniu z interferonem i czynnikiem martwicy guza uwalnianymi z komórek zapalenia. Na drodze redukcji poziomu interleukiny 1 w ranie może dochodzić do nagromadzenia macierzy zewnątrzkomórkowej i powstawania blizny w miejscu urazu. Taki obniżony poziom interleukiny 1, korelujący z rozległością blizn obserwowano u pacjentów z przerostowymi bliznami. Działanie interleukiny 1 wydaje się bardziej złożone, badania ujawniły jej stymulującą rolę w produkcji kolagenu.
Inne komórki
W części epidermalnej i dermalnej przerostowej blizny znaleziono komórki Langerhansa i limfocyty T. Obecne są one w całej masie blizny gromadząc się w pobliżu naczyń krwionośnych.
Mogą one być przyciągane przez interleukinę 1 i 6 oraz czynnik martwicy guza A uwalniany z makrofagów. U pacjentów oparzonych stwierdzono podwyższony poziom interleukiny 6 w porównaniu z grupą kontrolną.
Pacjenci z keloidami również wykazują obecność przeciwciał przeciwjądrowych różnych klas immunoglobulin przeciwko fibroblastom, komórkom środbłonka i nabłonka, co potwierdza immunologiczne tło powstawania bliznowców. Przeciwciał tych nie wykryto u pacjentów z bliznami przerostowymi.
Komórki tuczne
Zależność przerosłych blizn od rasy, płci i wieku koreluje z poziomem osoczowym immunoglobuliny E, a pacjenci z keloidami mają większą skłonność do chorób alergicznych niż osobnicy z przerosłymi bliznami.
Komórki tuczne są rozsiane pomiędzy włóknami kolagenu i występują w znacznie większej liczbie w przerosłych bliznach w stosunku do prawidłowych blizn. Komórki te mogą być stymulowane przez immunoglobuliny E do wydzielania ziarnistości cytoplazmatycznych zawierających histaminę, heparynę, serotoninę, kwaśną hydrolazę i kilka czynników wzrostu, w większości biorących udział w produkcji macierzy. W keloidach stwierdza się podwyższony poziom histaminy, oraz interleukiny 4, stymulujących syntezę fibronektyny i kolagenu w fibroblastach i ułatwiających syntezę siarczanu chondroityny, który występuje w podwyższonym stężeniu w przerostowej tkance bliznowatej.
Naskórkowanie
Przerostowe blizny powstają zazwyczaj, gdy gojenie rany było przedłużone ponad 3 tygodnie.Pogrubiała jest warstwa skory właściwej i warstwy naskórkowej i brak w niej siatki naczyniowej charakterystycznej dla zdrowej skóry. Keratynocyty wykazują obecność antygenów powierzchniowych HLA klasy 2 oraz cząsteczek przylegania międzykomórkowego, co jest dowodem na immmunologiczny charakter, podczas gdy keratynocyty prawidłowych blizn takich antygenów nie wykazują. Koreluje to z intensywnością nacieków monocytarnych w skórze właściwej i zwiększa powinowactwo keratynocytów do limfocytów. Keratynocyty wytwarzają znaczące ilości czynnika wzrostowego zaangażowanego w procesach zapalenia w obszarze rany, w wytwarzaniu tkanki ziarninowej oraz w procesach przebudowy blizny, a więc udowodniono ich rolę w procesie tworzenia przerostowej blizny. Wykazują również obniżoną aktywność interleukiny 1, która pełni znaczącą rolę w degradacji macierzy zewnątrzkomórkowej w ranie oraz zwiększoną aktywność płytkowego czynnika wzrostowego biorącego udział we włóknieniu tkanek.
Powstawanie ziarniny
Po zakończeniu fazy skrzepu i oczyszczania rany przez komórki zapalenia w uszkodzonej skórze właściwej rozpoczynają się procesy naprawcze z wytworzeniem tkanki ziarninowej.
Stymulowane czynnikami wzrostowymi uwalnianymi przez płytki krwi, a następnie przez makrofagi, fibroblasty i komórki śródbłonka migrują poprzez macierz rany do przestrzeni rany tworząc bogatą w naczynia krwionośne tkankę łączną, zwaną ze względu na swój wygląd ziarniną. Jednocześnie keratynocyty, rosnąc od brzegów rany, pokrywają ziarninę warstwą naskórkową.
Nowotworzenie naczyń
W porównaniu do prawidłowej blizny, w tkance blizn przerostowych i keloidów znajduje się nadmiar drobnych naczyń wrastających w kierunku powierzchni rany o zamkniętym przez nadmiar komórek środbłonka świetle naczyniowym. Ilość depozytów kolagenowych wzrasta od dna w kierunku powierzchni rany i gromadzi się głównie wzdłuż bocznych gałęzi drobnych naczyń. W przerostowych bliznach obserwuje się guzki kolagenowe różnorakiego kształtu i rozmiarów. Zamykanie naczyń pojawia się w fazie późnej ziarniny i prawdopodobnie jest odpowiedzialne za obniżone stężenie tlenu w przerostowej bliźnie, ale może być wynikiem wzmożonego metabolizmu lub utrudnionej dyfuzji tlenu do rany. Niedotlenienie tkanek stymuluje angiogenezę, poprzez uwalnianie czynników z makrofagów i pobudza fibroblasty do produkcji kolagenu i wytwarzania nadmiernej przerostowej blizny. Podczas dojrzewania blizny mikronaczynia stopniowo degenerują i ulegają wchłonięciu, co koreluje z uwidacznianiem się węzłów kolagenowych.
Produkcja macierzy
Aby skrzep w ranie przekształcony został w tkankę ziarninową konieczne jest zachowanie właściwych proporcji pomiędzy procesami rozpadu a biosyntezy w macierzy rany. Powstaje ona dzięki syntezie kolagenu, fibronektyn oraz proteoglikanów wytwarzanych przez fibroblasty.
Niedostateczna degradacja i nadmierna produkcja macierzy może prowadzić do wytworzenia przerostowej blizny lub bliznowca czyli keloidu.
Wiodącą rolę w tworzeniu ziarniny odgrywają fibroblasty. Ich gęstość i aktywność w tkance bliznowatej jest zwiększona, ale ich proliferacja wydaje się utrzymywać w normie. Fibroblasty cechują normalne parametry wzrostu, ale produkują nadmierną ilość macierzy zewnątrzkomórkowej. Fibroblasty otrzymywane z keloidów wykazują się dużą produkcją kolagenu, fibronektyn, elastyny, proteoglikanów i charakteryzują się nieprawidłową odpowiedzią wobec stymulatorów metabolizmu, w porównaniu z fibroblastami prawidłowych blizn.
Przebudowa blizny
Celem przebudowy blizny jest uzyskanie odpowiednio mocnej tkanki zastępczej wytrzymałej na bodźce mechaniczne.
W macierzy zewnątrzkomórkowej dochodzi do obumierania komórek i na tej drodze do przebudowy rusztowania kolagenowego i substancji wypełniającej.
Kwas hialuronowy
Kwas hialuronowy jest głównym komponentem młodej tkanki ziarninowej. W procesie gojenia poziom kwasu hialuronowego w ranie rośnie wkrótce po zranieniu, obniża się pomiędzy 5 a 10 dniem, a następnie pozostaje na stałym poziomie, podczas gdy poziom siarczanu chondroityny, siarczanu glikozaminy, i siarczanu dermatanu w tym czasie wzrasta. W sytuacji nadmiernego włóknienia tkanki stwierdza się podwyższony poziom kwasu hialuronowego i proteoglikanów. W przerostowych bliznach kwas hialuronowy obecny jest jako cienka warstwa w skórze właściwej, podczas gdy w keloidach nie stwierdza się kwasu hialuronowego w warstwie brodawkowatej skóry za to stwierdza się go głównie w warstwie ziarnistej i kolczystej naskórka. Kwas hialuronowy tworzy okołokomórkowy płaszcz na powierzchni komórek i istnieje w postaci stabilnego kompleksu odpornego na degradację enzymatyczną, co skutkuje powstawaniem nadmiernej tkanki bliznowatej.
Proteoglikany
W procesie remodelowania blizny kwas hialuronowy jest zastępowany przez biglikan (siarczan proteoglikanu) oraz versican zawierający boczne łańcuchy cząsteczek siarczanu dermatanu i siarczanu chondroityny. Są to produkty fibroblastów dojrzałej blizny. Największe ich nagromadzenie obserwuje się w węzłach przerosłej blizny, co koreluje z nadmierną proliferacją kolagenu oraz obecnością okołonaczyniowych nacieków z limfocytów T.
Podczas dojrzewania blizny utrzymuje się wysoki poziom biglikanu, podczas gdy poziom dekorinu w porównaniu do skóry właściwej i normalnej blizny pozostaje obniżony. Niewielka ilość dekorinu znajduje się głównie w głębokiej warstwie skóry właściwej oraz pod warstwą naskórka i jest znacznie zredukowana lub nieobecna w obszarze węzłów blizny.
W nieuszkodzonej skórze znajduje się ją ogniskowo w naskórku oraz w postaci cienkiej warstwy pod błoną podstawną naskórka.
Dla procesów naprawczych w ranie ważne jest rozmieszczenie proteoglikanów oraz środowisko rany.
Kolagen
Włókna kolagenowe stanowią ramę, która nadaje skórze i tkance blizny odpowiednią siłę. Najważniejszym aspektem w remodelowaniu blizny jest wzrost wytrzymałości mechanicznej blizny. Wytrzymałość młodej rany jest zależna od interakcji pomiędzy fibryną, fibronektyną, kolagenem, glikozaminoglikanami i fibroblastami, podczas gdy stopniowe wzmacnianie się blizny zależy od gromadzenia depozytów nowego kolagenu, jego remodelowania, pękania wiązań miedzycząsteczkowych i tworzenia większych skręconych pasm kolagenowych. Jako pierwszy, około 2-3 dnia pojawia się w ranie kolagen typu 3, a następnie około 6-7 dnia pojawia się kolagen typu 1. Kolagen typu 5 pojawia się w ranie wraz z nowotworzeniem naczyń krwionośnych. Z czasem wzrasta ilość kolagenu typu 1 i 3, podczas gdy zmieniają się proporcje poszczególnych typów kolagenu.
W ciągu pierwszego tygodnia ilość kolagenu typu 3 obniża się do około 60%, a w dojrzałej bliźnie wynosi około 28% pierwotnej ilości.
W bliznach przerostowych i keloidach poziom kolagenu typu 3 pozostaje relatywnie zwiększony w stosunku do blizn prawidłowych i skóry nieuszkodzonej, co można wykazać stosunkiem kolagenu 3 do kolagenu 1. W tkance ziarninowej w ranie oparzeniowej stosunek ten wynosi 0,37 do 0,72, w keloidach około 0,61, podczas gdy w skórze zdrowej około 0,17. Stosunek ten stopniowo obniża się wraz z upływem czasu do około 2 lat.
Synteza kolagenu osiąga swój szczyt ok. 6 miesięcy po urazie, a następnie zmniejsza się osiągając wartości prawidłowe ok. 2-3 lata po urazie. W keloidach synteza kolagenu może utrzymywać się przez wiele lat.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Niessen F.B.: On the nature oh Hypertrophic Scars and Keloids: A Review Plast Reconstr Surg 1998, 104(5):1435-1458.
2. Grzybowski J.: Biologia rany oparzeniowej. A medica press 2001.
3. Hunt T.K.: Basic principles of wound healing. J Trauma 30, 1990, (12 Suppl)122.
4. Muir I.F.: On the nature of keloid and hypertrophic scars. Br J Plast Surg 1990, 43:61.
5. Murray J.C.: Keloids and hypertrophic scars. Clin. Dermatol 1994, 12:27.
6. Kirscher C.W.: The microvessels in hypertrophic scars, keloids and related lesions: a reviev. J Submicrosc Cytol Pathol 1992, 24:281.
7. Lewis W.H.: Hypertrophic scar: A genetic hypothesis. Burn 1990, 16:176.
8. Niessen F.B.: The use of silicone occlusive sheeting and silicone occlusive gel in the prevention of hypertrophic scar formation. Plast Reconstr Surg 1998, 02:1962.
9. Su C.W.: The problem scar. Clin Plast Surg 1998, 25:451.
10. Buchwald C.: Keloids of the external ear. ORL J 1992, 54:108.
11. Tredget E.E.: Hypertrophic scars, keloids and contractures. The cellular and molecular basis for therapy. Surg Clin North Am 1997, 77:701.
12. Murray J.C.: Scars and keloids. Dermatol Clin 1993, 11:697.
13. Clark R.A.: Basics of cutaneous wound repair. J Dermatol Surg Oncol 1993, 19: 693.
14. Tuan T.L.: Elevated levels of plasminogen activator inhibitor-1 may account for altered fibrinolysis by keloid fibroblasts. J Invest Dermatol 1996, 106:1007.
15. Steenfos G.F.: Growth factors and wound healing. Scand J Plast Reconstr Hand Surg 1994, 28:95.
16. Castagnoli C.: Characterisation of T-cell subsets infiltrating post burn hypertrophic scar tissues. Burns 1997, 28:565.

