© Borgis - Postępy Fitoterapii 1/2012, s. 15-21
*Gerard Nowak, Arletta Moroch, Maria Urbańska, Joanna Nawrot, Lidia Ratajczak, Renata Dawid-Pać
Ekdysony roślinne
Plant ecdysones
Katedra i Zakład Naturalnych Surowców Leczniczych i Kosmetycznych, Uniwersytet Medyczny im. K. Marcinkowskiego w Poznaniu
Kierownik Katedry i Zakładu: prof. dr hab. n. farm. Gerard Nowak
Summary
Ecdysones are present in both animals and plants. These compounds constitute a family of about 300 structures with distinctive physical, chemical and biological properties. They are considered to be of a very polar nature. The plants usually contain one or a few major ecdysteroids along with other closely related compounds occurring in lower amounts. The following phytoecdysones are the most famous: 20-hydroxyecdysone (polypodine A) and polypodine B. The compounds in question, and the materials in which they play a dominant role, are very promising for phytotherapy. Phytoecdysones have been proven to have anabolic activity. They stimulate the protein synthesis in the liver, kidneys and muscles with no apparent detrimental effects to the functions of human organism. Some pharmacological studies indicate a possible increase in human body’s efficiency owing to the influence of phytoecdysteroids. These compounds have been also noted in literature to have a positive effect in hyperglycaemia, hypercholesterolemia and physical and/or mental weakness. There are suggestions of phytoecdysones being applied as a supplement in the treatment of several diseases of the cardiovascular system. However, despite the positive results of pharmacological studies on phytoecdysones and their presence on the pharmaceutical market, the plants containing these compounds are not mentioned in international monographs.

Ekdysony wśród roślinnych steroidów
Fitoekdysteroidy (ekdysony, fitoekdysony), obok brasinosteroidów, bufadienolidów, kardenolidów, kukurbitacyn, saponozydów steroidowych, alkaloidów steroidowych i witanolidów, należą do rodziny związków steroidowych (ryc. 1). Pod względem fizjologicznym dzielone są one niekiedy na trzy grupy. Pierwsza, w fizjologii roślin pełni rolę hormonów i feromonów (brassinosteroidy, anteridiol, oogoniol), druga, do której należą ekdysony, progestageny, cholekalcyferole (witamina D3) stanowi grupę związków powiązanych pod względem struktury z hormonami zwierząt bezkręgowych, a w skład trzeciej grupy wchodzą metabolity wtórne – substancje pełniące rolę ochronną roślin jako repelenty, deterenty i związki o działaniu toksycznym wobec zwierząt (1).
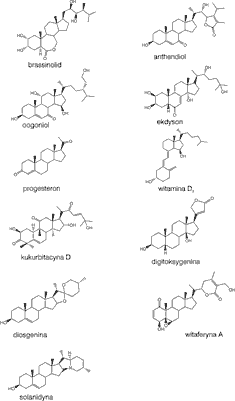
Ryc. 1. Struktury niektórych naturalnych związków steroidowych.
Charakterystyka chemiczna ekdysonów
Ekdysony są pochodnymi cyklopentano-perhydrofenantrenu. Zdecydowana większość z nich ma 27 atomów węgla, podwójne wiązanie przy C7 i grupę ketonową przy C6. Tylko niektóre fitoekdysony pochodzą od fitosteroli i mają szkielety 28- lub 29-węglowe z grupą alkilową przy C24 (makisteron i makisteron C). Wszystkie ekdysteroidy charakteryzują się obecnością grup metylowych przy C10 i C13 w konfiguracji β. Pierścienie B/C i C/D są zawsze połączone konfiguracją trans. Natomiast pierścienie A/B przeważnie mają konfigurację cis. Większość ekdysonów posiada grupę α-hydroksylową przy C14, która wraz z podwójnym wiązaniem przy C7/8 i ketonem przy C6, stanowi układ chromoforowy o charakterystycznej absorpcji UV przy λmax =242 nm w metanolu i 254 nm w mieszaninie chlorek metylenu – metanol (ryc. 2). Charakterystyczną cechą chemiczną ekdysonów jest obecność kilku grup hydroksylowych, które nadają im charakter hydrofilny. Struktura steroidowa i różnorodność wymienionych wyżej podstawników stanowi o dużych możliwościach biosyntezy naturalnych ekdysonów. Bierze się pod uwagę występowanie ponad 1000 różnych modyfikacji strukturalnych naturalnych ekdysonów, z których dotychczas wyizolowano ok. 300 (2).
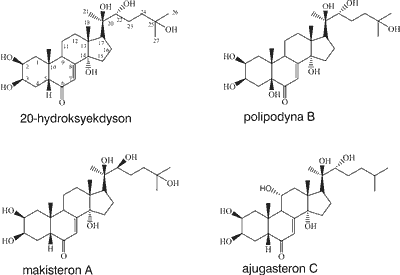
Ryc. 2. Struktury niektórych fitoekdysonów.
Najdokładniejsze informacje o strukturze i zawartości fitoekdysteroidów w roślinach można uzyskać w badaniu protonowego magnetycznego rezonansu jądrowego (1H NMR). Wspomniane wcześniej sprzężenie wiązań 7-en-6-on rozpoznawalne jest w zakresie przesunięcia chemicznego δ 5,75-6,0 ppm (diagnostyczny proton w pozycji H-7). Natomiast grupy metylowe, przy atomach węgla C-21, C-26, C-27 są wyraźne przy sygnałach w zakresie 0,6-1,5 ppm.
Występowanie ekdysonów w roślinach
Fitoekdysteroidy są szeroko rozpowszechnione w świecie roślinnym, występują zarówno u okrytonasiennych, jak i nagonasiennych. Ekdysteroidowo-podobne substancje znaleziono również w brunatnych algach morskich z gatunku Laurencia pinnata Yamada, w grzybach i bezkręgowcach. Jednak tylko ok. 2% roślin na świecie zostało przebadanych pod kątem obecności tych związków. Przyjmuje się, że w 5-6% badanych na obecność ekdysonów roślin, uzyskano efekt pozytywny (1). Zawartość tych związków zmienia się wraz z cyklem wegetacyjnym rośliny. Stwierdzono na przykład, że maksymalne stężenie 20-hydroksyekdysonu w gatunkach Serratula występuje w dwóch okresach, na przełomie kwietnia i maja oraz w sierpniu (w czasie kwitnienia). Ekdysony kumulują się w tkankach, które są najważniejsze dla przeżycia rośliny, w większych ilościach występują w liściach i kwiatach, natomiast w mniejszych – w łodygach, korzeniach i nasionach (1, 2).
Występowanie fitoekdysteroidów potwierdzone jest w ok. 120 rodzinach (tab. 1), jednak tylko gatunki należące do pięciu z nich charakteryzują się wysoką zawartością tych związków, która wynosi ok. 1%. Jedną z tych rodzin jest Asteraceae. W niektórych gatunkach Serratula 20-hydroksyekdyson występuje w stężeniu od 0,9-2,0%. Wysoką zawartość fitoekdysonów wykazują także gatunki z rodziny Chenopodiaceae, np. szpinak (Spinacia oleracea L.) zawiera je w ilości 50 μg/g suchej masy (1).
Tabela 1. Niektóre rodziny i gatunki roślin zawierające fitoekdysony (1, 3, 4).
| Rodzina | Gatunek |
| Adoxaceae | Adoxa moschatellina L. |
| Amaranthaceae | Achyranthes bidentata, A. aspera L. |
| Amaranthus retropflexus L., A. albus L. |
| Cyathula achyranthoides (Kunth) Moq., C. officinalis K.C. Kuan |
| Gomphrena L. |
| Pfaffia paniculata (Mart.) Kuntze, P. iresinoides (Kunth) Spreng |
| Apiaceae | Cicuta virosa L. |
| Pimpinella saxifraga L. |
| Angelica archangelica L., A. sylvestris L. |
| Asteraceae | Arctium tomentosum Mill. |
| Carduus nutans L. |
| Centaurea phrygia L., C. fischeri Schlecht., C. jacea L., C. scabiosa L., |
| Cirsium heterophyllum (L.) Hill, C. oleraceum (L.) Scop., C. palustre (L.), Scop., C. setosum (Willd.) Bess., C. vulgare (Savi) Ten. |
| Saussurea alpina (L.) DC, S. parviflora (Poir.) DC |
| Serratula algida Iljin, S. centauroides L., S. chinensis S. Moore, S. coronata L. = S. wolfii Andrae, S. erucifolia (L.) Boriss., S. inermis Gilib., S. komarovii Iljin., S. lyratifolia Schrenk, S. procumbens Regel, S. sogdiana Bunge, S. strangulata Iljin., S. tinctoria L. |
| Rhaponticum uniflorum (L.) DC., Rh. integrifolium C. Winkl., Rh. nanum Lipsky, Rh. carthamoides (Willd.) Iljin. = Leuzea carthamoides (Willd.) DC. |
| Boraginaceae | Symphytum officinale L. |
| Butomaceae | Butomus umbellatus L. |
| Caryophyllaceae | Silene L. |
| Chenopodiaceae | Chenopodium album L., C. rubrum L. |
| Spinacia oleracea L. |
| Atriplex patula L. |
| Axyris amaranthoides L. |
| Kochia scoparia (L.) Schrad. |
| Commelinaceae | Cyanotis somaliensis C.B. Clarke |
| Lamiaceae | Lamium L. |
| Ajuga reptans L., A. turkestanica (Regel) Briq. |
| Menispermaceae | Tinospora cordifolia (Willd.) Hook. f. & Thomson |
| Pinaceae | Abies sibirica Ledeb. |
| Plumbaginaceae | Limonium Mill. |
| Polypodiaceae | Polypodium vulgare L., P. aurea L., P. glycyrrhiza D.C. Eaton |
| Ranunculaceae | Anemonastrum biarmiense (Juz.) Holub |
| Anemonoides altaica (C.A. Mey) Holub, A. ranunculoides (L.) Holub |
| Anemone silvestris L. |
| Saxifragaceae | Chrysosplenium alternifolium L. |
| Trilliaceae | Paris quadrifolia L. |
| Verbenaceae | Vitex L. |
Badając 411 gatunków flory rosyjskiej z Zachodniej Syberii, Centralnej Azji oraz części północno-wschodniej Rosji stwierdzono, że w 29 gatunkach ekdysteroidy występowały na poziomie średnim (10-102 μg/g suchej masy) lub wysokim (102-104 μg/g suchej masy). Okazało się, że szczególnie duża zawartość tych związków występuje w gatunkach z plemienia Cardueae (Asteraceae) oraz Lichnideae (Caryophyllaceae) (3).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Klain R. Phytoecdysteroids. J Am Herbal Guild 2004; 5:18-28. 2. Báthori M, Gergely A, Kalász H i wsp. Liquid Chromatographic monitoring of phytoecdysteroid production of Serratula wolffii. J Liquid Chromatogr Related Technol 2000; 23:281-94. 3. Volodin V, Chadin I, Whiting P. Screening plants of European North-East Russia for ecdysteroids. Bioch Syst Ecol 2002; 30:525-578. 4. Nowak G, Nawrot J, Latowski K. Arbutin in Serratula quinquefolia M.B. (Asteraceae). Acta Soc Bot Pol 2009; 78:137-40. 5. Lafont R, Dinan L. Practical uses for ecdysteroids in mammals including humans: and update. J Insect Sci 2003; 3:7. 6. Takás M, Simon A, Liktor-Busa E. i wsp. Structure and stereochemistry of novel ecdysteroids from the roots of Serratula wolffii. Magnet Reson Chem 2010; 48:386-91. 7. Chermnykh NS, Shimanovsky NL, Shutko GV i wsp. Effects of methandrostenolone and ecdysterone on physical endurance of animals and protein metabolism in the skeletal muscles. Farmakol Toksikol 1988; 6:57-62. 8. Timofeev NP. Leuzea-Rhaponticum carthamoides (Maral root): introduction questions and application prospects as biologically active additives. www.leuzea.ru. 9. Dinan L. The Karlson lecture. Phytoecdysteroids: what use are they? Archiv Insect Biochem Physiol 2009; 72:126-41. 10. Gorelick-Feldman J, MacLean D, Ilic N i wsp. Phytoecdysteroids increase protein synthesis in skeletal muscle cells. J Agric Food Chem 2008; 56:3532-7. 11. Báthori M, Tóth N, Hunyadi A i wsp. Phytoecdysteroids and anabolic-androgenic steroids – structure and effects on humans. Curr Med Chem 2008; 15:75-91. 12. Báthori M, Pongrácz Z. Phytoecdysteroids – from isolation to their effects on humans. Curr Med Chem 2005; 12:153-72. 13. Wilborn CD, Taylor LW, Campbell BI i wsp. Effects of methoxyisoflavone, ecdysterone, and sulfo-polysaccharide supplementation on training adaptations in resistance-trained males. J Inter Soc Sports Nutrit 2006; 3:19-27. 14. Dermar M, Dumas M, Bonte F i wsp. Effect of ecdysterone on the differentiation of normal keratinocytes in vitro. Eur J Dermatol 1994; 4:558-69. 15. Meybeck A, Bonte F, Redziniak G. Use of an ecdysteroid for the preparation of cosmetics or dermatological compositions intended, in particular, for strengthening the water barrier function of the skin or for the preparation of a skin cell culture medium, as well as to the compositions. United States Patent 5609873; 1999. 16. Meybeck A, Bonte F. Hydrated lipidic lamellar phases or liposomes based on ecdysteroids. United States Patent 5198225; 1993. 17. Tsuji K, Shibata J, Okada M i wsp. Blood flow amount-improving agent comprising steroid derivate and cosmetic using same. United States Patent 5976515; 1999. 18. Faian L, Argay G, Kalman A i wsp. Crystal structures of ecdysteroids: the role of solvent molecules in hydrogen bonding and izostructuality. Acta Crystalogr Sect B 2002; 58:710-20. 19. Dinan L, Harmatha J, Lafont R. Chromatographic procedures for the isolation of plant steroids. J Chromatogr A 2001; 935:1235-8.


