© Borgis - Postępy Fitoterapii 1/2012, s. 28-34
Agata Wilczańska-Barska, Barbara Chmura, *Mirosława Krauze-Baranowska
Dotychczasowy stan badań nad aktywnością farmakologiczną flawonów z rodzaju Scutellaria
Current state-of the art research on pharmacological activity of scutellaria flavones
Katedra i Zakład Farmakognozji z Ogrodem Roślin Leczniczych, Wydział Farmaceutyczny, Gdański Uniwersytet Medyczny
Kierownik Katedry: dr hab. Mirosława Krauze-Baranowska, prof. nadzw.
Summary
Species belonging to a genus Scutellaria are a rich source of flavones (wogonin, wogonoside, baicalein and baicalin) possessing differential pharmacological activity – anti-inflammatory, antioxidant, anticancer and antiviral. The article presents biochemical and molecular mechanisms of activity the above mentioned compounds with emphasis on their anticancer action. The anticancer action of wogonin, baicalin and baicalein results from their ability to induce apoptosis of cancer cells and inhibit of cell cycle, what was proved in many in vitro and in vivo research on cancer cell lines, among others prostate, urinary bladder, colon, leukaemia and myeloma. On the other hand it was proved that free radical scavenging action of Scutellaria flavones decides on hepato- and cardioprotective effects. Moreover, against baicalin and baicalein, wogonin has strong anti-hepatitis B virus activity (HBV).

Obecnie szacuje się, że ok. 3/4 związków stosowanych jako leki przeciwnowotworowe, pochodzi ze świata roślinnego (m.in. winblastyna, paklitaksel, podofilotoksyna, kamptotecyna) i w większości wywodzą się one z tradycyjnej medycyny chińskiej (1).
Gatunki z rodzaju Scutellaria L. (tarczyca) są bogatym źródłem flawonów – m.in. wogoniny, wogonozydu, bajkaliny oraz bajkaleiny. Związki te wykazują interesującą aktywność biologiczną – cytostatyczną, cytotoksyczną, przeciwnowotworową, przeciwwirusową oraz przeciwzapalną, przez co stanowią obiekt intensywnych badań naukowych od przeszło 20 lat. Spośród tarczyc do najważniejszych surowców o znaczeniu leczniczym należą Scutellaria baicalensis (tarczyca bajkalska), S. barbata (tarczyca brodata) oraz S. lateriflora (tarczyca bocznokwiatowa). W krajach azjatyckich w warunkach klinicznych wykorzystuje się wyciągi z ziela tarczycy brodatej w leczeniu nowotworów płuc, przewodu pokarmowego i wątroby (2).
Aktywność surowca potwierdzono w wielu badaniach in vitro i in vivo. Wynika ona z obecności składników bioaktywnych odpowiedzialnych za hamowanie wzrostu szeregu nowotworowych linii komórkowych oraz indukcję apoptozy. Składnikami tymi są w głównej mierze flawony: wogonina, bajkalina i bajkaleina. Związki te występują również w korzeniach tarczycy bajkalskiej i w częściach nadziemnych tarczycy bocznokwiatowej (3, 4). Na polskim rynku farmaceutycznym obecnie dostępne są trzy roślinne produkty lecznicze zawierające wyciąg z korzeni tarczycy bajkalskiej. Są one stosowane w chorobach dziąseł i przyzębia (Baikadent), w stanach zapalnych skóry o różnym podłożu (Baikaderm) oraz w leczeniu podrażnień i pielęgnacji okolic intymnych (Baifem K).
Mechanizmy działania przeciwnowotworowego, przeciwwolnorodnikowego, przeciwzapalnego i przeciwwirusowego flawonów tarczyc rozpoznano na poziomie biochemicznym i molekularnym.
Wzór ogólny flawonów przedstawiono na rycinie 1, natomiast dane dotyczące budowy chemicznej flawonów występujących w rodzaju Scutellaria zebrano w tabeli 1.
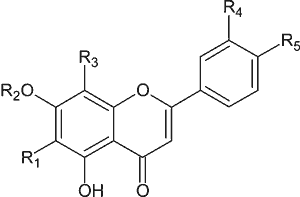
Ryc. 1. Wzór ogólny flawonów.
Tabela 1. Dane charakteryzujące budowę chemiczną flawonów występujących w rodzaju Scutellaria.
| Związek | R1 | R2 | R3 | R4 | R5 |
| bajkalina | OH | kwas glukuronowy | H | H | H |
| bajkaleina | OH | H | H | H | H |
| chryzyna | H | H | H | H | H |
| skutellareina | OH | H | H | H | OH |
| skutellaryna | OH | kwas glukuronowy | H | H | OH |
| wogonina (oroksylina B) | H | H | OCH3 | H | H |
| 7-O-glukuronid wogoniny (wogonozyd) | H | kwas glukuronowy | OCH3 | H | H |
| oroksylina A | OCH3 | H | H | H | H |
| 7-O-glukuronid oroksyliny A | OCH3 | kwas glukuronowy | H | H | H |
Mechanizm aktywności biologicznej wogoniny (5,7-dihydroksy-8-metoksyflawonu)
Związek ten wykazuje działanie przeciwnowotworowe, przeciwzapalne oraz przeciwwirusowe.
Działanie przeciwnowotworowe
Aktywność przeciwnowotworowa wogoniny w warunkach in vitro wynika z jej zdolności do indukcji apoptozy (5). Apoptoza jest programowaną śmiercią komórek i jednym z procesów uczestniczących w utrzymaniu homeostazy organizmu. Głównym efektem apoptozy jest wewnątrzpochodna (związana z mitochondriami) lub zewnątrzpochodna (związana z receptorami) aktywacja kaspaz – enzymów blokujących wiele białek komórkowych. Śmierć komórek wskutek apoptozy również kontroluje szereg białek pro-apoptycznych (Bax, Bad, Bid, Bak) oraz anty-apoptycznych (Bcl-2, Mcl-1, Bcl-xL) (1, 6). Wobec zdolności tkanki nowotworowej do nieograniczonej proliferacji, indukcja apoptozy komórek nowotworowych stanowi jedną ze strategii terapii przeciwnowotworowej (6).
Spośród dróg indukcji apoptozy przez wogoninę wymienia się hamowanie aktywności jądrowego czynnika transkrypcji (NF-κB), regulatora genów kodujących białka anty-apoptyczne (1). Wskazuje się również na atenuację aktywności czynnika NF-κB w wyniku neutralizacji wolnych rodników przez wogoninę (7). Korzystny wynik terapii skojarzonej TNF-α z wogoniną w leczeniu białaczki jest konsekwencją uwrażliwienia komórek białaczki na apoptozę indukowaną przez TNF-α. Jednocześnie ograniczone zostają efekty uboczne monoterapii (działanie prozapalne TNF-α wobec zdrowych tkanek).
Na liniach komórkowych ludzkiego raka prostaty LNCaP i ludzkiego raka okrężnicy HCT116 wykazano, że wogonina stymuluje ekspresję nowotworowego białka supresorowego p53. Białko p53 w odpowiedzi na czynniki stresowe, np. uszkodzenia DNA, reguluje transkrypcję szeregu genów odpowiedzialnych za blokadę cyklu komórkowego oraz indukuje apoptozę. Proces apoptozy kontrolowany przez wogoninę stanowi kaskadę przemian komórkowych przebiegających w szlaku p53 – PUMA (p53 – zależny modulator apoptozy) – Bax (białko pro-apoptyczne) – cytochrom c – kaspaza 9 – kaspaza 3 (8).
Wyjaśniono również mechanizm aktywności wogoniny w zaburzeniach hematologicznych o podłożu nowotworowym (6). Selektywna indukcja śmierci złośliwych komórek T, bez wpływu na normalne limfocyty T, była wynikiem celowanej aktywacji fosfolipazy Cγ1 (PLCγ1) tylko w komórkach zmienionych nowotworowo (produkujących intensywniej rodnik O2-˙). Aktywacja tego enzymu, powodując wzrost poziomu Ca2+ wewnątrzkomórkowego oraz uwalnianie cytochromu c z mitochondriów jest kolejną z dróg aktywacji kaspazo-zależnej apoptozy komórek nowotworowych przez wogoninę.
Proces ten decydował również o hamowaniu proliferacji linii komórkowych ludzkiego nowotworu piersi (ER-pozytywnego i ER-negatywnego) (9) oraz mysich linii komórkowych mięsaka S180 (10) zarówno w warunkach in vitro, jak i in vivo. Ponadto wogonina hamowała proliferację ludzkich linii komórkowych białaczki HL-60, a także była inhibitorem angiogenezy ludzkiego nowotworu żołądka in vivo (11).
Obecnie analizowane są mechanizmy działania przeciwnowotworowego wogoniny, wynikające z jej zdolności hamowania cyklu komórkowego. Kolejne etapy cyklu komórkowego są kontrolowane przez kinazy cyklino-zależne (CDKs) – enzymy, których aktywność regulują cykliny oraz inhibitory kinaz (1). Ekspozycja linii komórkowych ludzkiego nowotworu piersi na wogoninę skutkowała zmniejszeniem całkowitego poziomu białek cykliny D1 (9) i zatrzymaniem cyklu komórkowego na przełomie faz G0/G1 (1).
W dawkach 10-200 mg/kg m.c. wogonina znacząco hamowała wzrost i rozwój komórek nowotworowych, nie wywierając działania toksycznego w stosunku do zdrowych komórek badanych zwierząt (1, 6, 8, 9, 11). Jednocześnie obserwowano działanie ochronne wobec tymocytów, których apoptozę stymulowały glukokortykosteroidy o działaniu immunosupresyjnym (12).
Z jednej strony, potwierdzone działanie przeciwnowotworowe, a z drugiej wymagająca wyjaśnienia kwestia skuteczności i bezpieczeństwa stosowania, stwarzają nadzieję na kliniczne wykorzystanie wogoniny lub związków bazujących na strukturze tego flawonu w terapii nowotworów (1).
Działanie przeciwzapalne
W badaniach in vitro i in vivo w różnych modelach zwierzęcych wykazano zdolność wogoniny do ochrony tkanek przed zapaleniem (1). Działanie przeciwzapalne wogoniny wynika częściowo z hamowania aktywności cyklooksygenazy-2 (COX-2) na poziomie ekspresji genów (13, 14, 15). W przeprowadzonych doświadczeniach (12) skutkiem inhibicji tego enzymu było obniżenie poziomu białek i mRNA cyklooksygenezy-2 w komórkach ludzkiego nowotworu płuc. Nadekspresja COX-2 w tkankach jest związana nie tylko ze stanem zapalnym, ale i z rozwojem nowotworów.
Wogonina w sposób zależny od dawki hamowała w warunkach in vitro produkcję prozapalnej prostaglandyny E2 (PGE2). W stężeniu 10 μmol stopień inhibicji był porównywalny z hamowaniem produkcji PGE2 przez indometacynę (15).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Li-Weber M. New therapeutic aspects of flavones: The anticancer properties of Scutellaria and its main active constituents wogonin, baicalein and baicalin. Cancer Treat Rev 2009; 35:57-68. 2. Yin X, Zhou J, Jie C i wsp. Anticancer activity and mechanism of Scutellaria barbata extract on human lung cancer cell line A549. Life Sci 2004; 75:2233-44. 3. Lee TK, Lee DK, Kim DI i wsp. Inhibitory effects of Scutellaria barbata D. Do on human uterine mylelomal smooth muscle cell proliferation through cell cycle analysis. Int Immunopharmacol 2004; 4:447-54. 4. Powell CB, Fung P, Jackson J i wsp. Aqueos extract of herba Scutellariae barbatae, a Chinese herb used for ovarian cancer, induces apoptosis of ovarian cancer cell lines. Gynecol Oncol 2003; 91:332-40. 5. Yu JQ, Liu HB, Tian DZ i wsp. Changes in mitochondrial membrane potential and reactive oxygen species during wogonin-induced cell death in human hepatoma cells. Hepatol Res 2007; 37:68-76. 6. Baumann S, Fas SC, Giaisi M i wsp. Wogonin preferentially kills malignant lymphocytes and suppresses T-cell tumor growth by inducing PLCγ1-Ca2+-dependent apoptosis. Blood 2008; 111:2354-63. 7. Daniel PT, Fas SC, Baumann S i wsp. Wogonin sensitizes resistant malignant cells to TNFα-and TRAIL-induced apoptosis. Blood 2006; 108:3700-6. 8. Lee DH, Kim C, Zhang L i wsp. Role of p53, PUMA, and Bax in wogonin-induced apoptosis in human cancer cells. Biochem Pharmacol 2008; 75:2020-33. 9. Chung H, Jung YM, Shin DH i wsp. Anticancer effects of wogonin in both estrogen receptor-positive and -negative human breast cancer cell lines in vitro and in nude mice xenografts. Int J Cancer 2008; 122:816-22. 10. Wang W, Guo QL, You QD i wsp. The anticancer activities of wogonin in murine sarcoma S180 both in vitro and in vivo. Biol Pharm Bull 2006; 29:1132-7. 11. Lu N, Gao Y, Ling Y i wsp. Wogonin suppresses tumor growth in vivo and VEGF-induced angiogenesis throught inhibiting tyrosine phosphorylation of VEGFR2. Life Sci 2008; 82:956-63. 12. Enomoto R, Sugahara C, Suzuki C i wsp. Wogonin prevents glucocorticoid-induced thymocyte apoptosis without diminishing its anti-inflammatory action. J Pharmacol Sci 2007; 104:355-65. 13. Chen LG, Hung LY, Tsai KW i wsp. Wogonin, a bioacive flavonoid in herbal tea, inhibits inflammatory cyclooxygenase-2 gene expression in human lung epithalial cancer cells. Mol Nutr Food Res 2008; 52:1349-57. 14. Chi YS, Lim H, Park H i wsp. Effect of wogonin, a plant flavone from Scutellaria radix, on skin inflammation: in vivo regulation of inflammation-associated gene expression. Biochem Pharmacol 2003; 66:1271-8. 15. Wakabayashi I, Kenichi Y. Wogonin inhibits inducible prostaglandin E2 production in macrophages. Eur J Pharmacol 2000; 406:477-81. 16. Park S, Hahm KB, Oh TY i wsp. Preventive effect of flavonoid, wogonin, against ethanol-induced gastric mucosal damage in rats. Dig Dis Sci 2004; 49:384-94. 17. Chen YC, Shen SC, Chen LG i wsp. Wogonin, baicalin, and baicalein inhibition of inducible nitric oxide synthase and cyclooxygenase-2 gene expressions induced by nitric oxide synthase inhibitors and lipopolisaccharide. Biochem Pharmacol 2001; 61:1417-27. 18. Wong VWS, Law MY, Hui AY i wsp. A hospital clinic-based survey on traditional Chinese medicine usage among chronic hepatitis B patients. Complement. Ther Med 2005; 13:175-82. 19. Huang RL, Chen CC, Huang HL i wsp. Anti-hepatitis B virus effects of wogonin isolated from Scutellaria baicalensis. Planta Med 2000; 66:694-8. 20. Guo Q, Zhao L, You Q i wsp. Anti-hepatitis B virus activity of wogonin in vitro and in vivo. Antivir Res 2007; 74:16-24. 21. Ma SC, Du J, But PPH i wsp. Antiviral Chinese medicinal herbs against respiratory syncytial virus. J Ethnopharmacol 2002; 79:205-11. 22. Chen S, Ruan Q, Bedner E i wsp. Effects of the flavonoid baicalin and its metabolite baicalein on androgen receptor expression, cell cycle progression and apoptosis of prostate cancer cell lines. Cell Prolif 2001; 34:293-304. 23. Leung HWC, Yang WH, Lai MY i wsp. Inhibition of 12-lipoxygenase during baicalein-induced human lung nonsmall carcinoma H460 cell apoptosis. Food Chem Toxicol 2007; 45:403-11. 24. Shieh DE, Cheng HY, Yen MH i wsp. Baicalin-induced apoptosis is mediated by Bcl-2-dependent, but not p53-dependent, patchway in human leukemia cell lines. Am J Chin Med 2006; 34:245-61. 25. Ma Z, Otsuyama KI, Liu S i wsp. Baicalein, a component of Scutellariae radix from Huang-Lian-Jie-Du-Tang (HLJDT), leads to suppression of proliferation and induction of apoptosis in human myeloma cells. Blood 2005; 105:3312-8. 26. Parajuli P, Joshee N, Rimando AM i wsp. In vitro antitumor mechanisms of various Scutellaria extracts and constituent flavonoids. Planta Med 2009; 75:41-8. 27. Schapoval EES, Winter de Vargas MR, Chaves CG i wsp. Antiinflammatory and antinociceptive activities of extracts and isolated compounds from Stachytarpheta cayennensis. J Ethnopharmacol 1998; 60:53-9. 28. Woo KJ, Lim JH, Suh SI i wsp. Differential inhibitory effects of baicalein and baicalin on LPS-induced cyclooxygenase-2 expression through inhibition of C/EBP β DNA-binding activity. Immunobiol 2006; 211:359-68. 29. Li BQ, Fu T, Gong WH i wsp. The flavonoid baicalin exhibits anti-inflammatory activity by binding to chemokines. Immunopharmacol 2000 49:295-306. 30. Shen YC, Chiou WF, Chou YC i wsp. Mechanisms in mediating the antiinflammatory effects of baicalin and baicalein in human leukocytes. Eur J Pharmacol 2003; 465:171-81. 31. Li BQ, Fu T, Dongyan Y i wsp. Flavonoid baicalin inhibits HIV-1 infection at the level of viral entry. Biochem Biophys Res Commun 2000; 276:534-8. 32. Jang SI, Kim HJ, Hwang KM i wsp. Hepatoprotective effect of baicalin, a major flavone from Scutellariae radix, on acetaminophen-induced liver injury in mice. Immunopharmacol Immonotoxicol 2003; 25:585-94. 33. Park SW, Lee CH, Kim YS i wsp. Protective effect of baicalin against carbon tetrachloride-induced acute hepatic injury in mice. J Pharmacol Sci 2008; 106:136-43. 34. Wan JY, Gong X, Zhang L i wsp. Protective effect of baicalin against lipopolisaccharide/D-galactosamine-induced liver injury in mice by up-regulation of heme oxygenase-1. Eur J Pharmacol 2008; 587:302-8. 35. Kim JY, Lee SY, Kim DH. Effects of flavonoids isolated from Scutellariae radix on cytochrome P-450 activities in human liver microsomes. J Toxicol Environ Health A 2002; 65:373-81. 36. Chang WT, Shao ZH, Yin JJ i wsp. Comparative effects of flavonoids on oxidant scavenging and ischemia-reperfusion injury in cardiomycetes. Eur J Pharmacol 2007; 566:58-66. 37. Gao Z, Huang K, Yang X i wsp. Free radical and antioxidant activities of flavonoids extracted from the radix of Scutellaria baicalensis Georgi. Biochem Biophys Acta 1999; 1472:643-50. 38. Chen YC, Chow JM, Lin CW i wsp. Baicalein inhibition of oxidative stress-induced apoptosis via modulation of ERKs activation and induction of HO-1 gene expression in rat glioma cells C6. Toxicol Applied Pharmacol 2006; 216:263-73.

