© Borgis - Postępy Fitoterapii 1/2012, s. 35-47
Katarzyna Kujawa-Warchala, *Jolanta Nazaruk
Aktywność farmakologiczna pentacyklicznych związków triterpenowych
Pharmacological activity of pentacyclic triterpene compounds
Zakład Farmakognozji, Uniwersytet Medyczny w Białymstoku
p.o. Kierownika Zakładu: dr Michał Tomczyk
Summary
Pentacyclic triterpenes are structurally divers, widespread secondary metabolites of plants. This review shows that their pharmacological potential is very high. In many experiments, in vitro and in vivo, it was stated that they display various pharmacological effects, among others anti-cancer, antioxidant, anti-inflammatory, anti-diabetic, anti-atherosclerotic, spasmolytic, antiallergic. They are promising compounds for the development of new multi-targeting bioactive agents.

Podstawowe struktury pentacyklicznych związków triterpenowych i ich występowanie w świecie roślin
Triterpeny, obok steroli, saponin i glikozydów nasercowych, należą do grupy triterpenoidów. Triterpeny pentacykliczne charakteryzują się obecnością pięciu sześciowęglowych lub jednego pięcio- i czterech sześciowęglowych pierścieni. Ich szkielet jest uformowany z sześciu jednostek izoprenowych i powstaje w wyniku cyklizacji cząsteczki skwalenu. Związki te są zazwyczaj bezbarwne, krystaliczne, mało reaktywne i mają wysoką temperaturę topnienia. Strukturę triterpenów pentacyklicznych podzielono na kilka typów przedstawionych na rycinie 1.
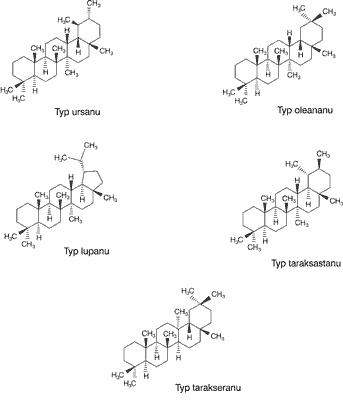
Ryc. 1. Podstawowe struktury pentacyklicznych związków triterpenowych.
Do poszczególnych typów należą następujące pochodne:
– typ ursanu: kwas ursolowy, α-amyryna, uwaol,
– typ oleananu: kwas oleanolowy, β-amyryna, erytrodiol,
– typ lupanu: lupeol, betulina, kwas betulinowy,
– typ taraksastanu: taraksasterol,
– typ tarakseranu: tarakserol (1-4).
Związki triterpenowe występują na ogół w korze, korku, żywicy, skórce i woskowym nalocie liści oraz kwiatów, pełniąc funkcję ochronną przed atakiem owadów i drobnoustrojów (1). Są szeroko rozpowszechnione w świecie roślin i stanowią przedmiot licznych badań fitochemicznych i farmakologicznych. W tabeli 1 przedstawiono występowanie poszczególnych związków w surowcach roślinnych (4, 5).
Tabela 1. Rozpowszechnienie pentacyklicznych triterpenów w roślinach leczniczych i użytkowych.
| Związek | Rodzina | Gatunek | Część rośliny |
| Kwas oleanolowy | Oleaceae | Olea europaea | liście, owoce, kora |
| Myrtaceae | Syzygium aromaticum | kwiaty |
| Lamiaceae | Rosmarinus officinalis | liście |
| Melissa officinalis | liście |
| Lavandula angustifolia | liście, kwiaty |
| Loranthaceae | Viscum album | ziele |
| Kwas ursolowy | Lamiaceae | Rosmarinus officinalis | liście |
| Salvia officinalis | liście |
| Lavandula angustifolia | liście, kwiaty |
| Thymus vulgaris | liście |
| Origanum majorana | liście |
| Apocynaceae | Nerium oleander | liście |
| Rosaceae | Malus domestica | owoce, skórka, wytłoki |
| Rubiaceae | Coffea arabica | liście |
| Kwas betulinowy | Platanaceae | Platanus acerifolia | kora |
| Betulaceae | Betula alba | kora |
| Lamiaceae | Rosmarinus officinalis | liście |
| Betulina | Betulaceae | Betula alba | kora |
| Oleaceae | Olea europaea | kora |
| Caprifoliaceae | Sambucus nigra | kora |
| α- i β-Amyryna | Gentianaceae | Centaurium erythraea | ziele |
| Ericaceae | Arctostaphylos uva-ursi | liście |
| β-Amyryna | Apiaceae | Pimpinella anisum | nasiona |
| Lamiaceae | Salvia officinalis | liście |
| Solanaceae | Solanum lycopersicum | skórka owoców |
| Lupeol | Asphodelaceae | Aloë vera | liście |
| Ericaceae | Arctostaphylos uva-ursi | liście |
| Betulaceae | Betula alba | kora |
| Vitaceae | Vitis vinifera | liście |
| Asteraceae | Calendula officinalis | kwiaty |
Rośliny o wysokiej zawartości triterpenów pentacyklicznych często są wykorzystywane w fitoterapii ze względu na cenne właściwości lecznicze (4). Niniejszy przegląd obejmuje głównie aktywność pochodnych ursanu, oleanu i lupanu.
Aktywność farmakologiczna pentacyklicznych pochodnych triterpenowych
Aktywność przeciwnowotworowa
Komórki rakowe dysponują szerokimi możliwościami namnażania, transformacji, tworzenia przerzutów do innych organów i tkanek oraz oporności na terapeutyki, co utrudnia ich niszczenie. W związku z tym ważne jest znalezienie leków działających precyzyjnie w poszczególnych stadiach karcynogenezy i poznanie dokładnego mechanizmu ich działania (6). Związki triterpenowe mogą być potencjalnym elementem strategii przeciwnowotworowej. Przeprowadzone badania wykazują ich aktywność na wielu etapach powstawania nowotworu.
Aktywność antyoksydacyjna i cytoochronna
W ostatnich latach pojawiło się wiele danych wskazujących na istotną rolę stresu oksydacyjnego w przebiegu transformacji nowotworowej. W komórkach nowotworowych stwierdzono nasilone wytwarzanie wolnych rodników, co może prowadzić do niestabilności genomu, mutacji DNA, wzrostu tempa proliferacji oraz potencjalnej oporności na terapię (7). Triterpeny można uznać za potencjalne czynniki cytoochronne i przeciwnowotworowe z uwagi na ich działanie przeciwko wolnym rodnikom (8).
Przebadano aktywność antyoksydacyjną wybranych triterpenów metodami in vitro i in vivo na organizmach myszy i szczurów narażonych na działanie wolnych rodników.
W tkankach prostaty myszy, w których wywołano silny stres oksydacyjny za pomocą testosteronu, po podaniu lupeolu odnotowano spadek poziomu produktów peroksydacji lipidów i liczby wolnych rodników oraz wzrost aktywności enzymów (dysmutaza ponadtlenkowa (SOD), katalaza (CAT), reduktaza glutationowa (GR), transferaza S-glutationowa (GST)). Na podstawie otrzymanych wyników można przypuszczać, że lupeol jest potencjalnym czynnikiem zapobiegającym nowotworom prostaty wywołanym stresem oksydacyjnym (9). Podobne badania, prowadzone na organizmach myszy ze zmianami w wątrobie, wywołanymi silnym karcynogenem DMBA (dimetylobenzenoantracen), wykazały, że lupeol powoduje spadek poziomu peroksydacji lipidów i wzrost aktywności enzymów antyoksydacyjnych. Może być on zatem traktowany jako czynnik hepatoprotekcyjny wobec czynników karcynogennych (10). Hepatoochronne działanie lupeolu stwierdzono także w testach na szczurach poddanych działaniu silnie karcynogennej aflatoksyny B1. Lupeol obniżał poziom stresu oksydacyjnego poprzez redukcję poziomu peroksydacji lipidów oraz wzmożenie aktywności SOD, CAT, peroksydazy glutationowej (GPx), GR, GST, dehydrogenazy glukozo-6-fosforanowej (G6PD) i czynników nieenzymatycznych, takich jak glutation zredukowany (GSH), witaminy C i E. Ponadto wykazano, że skuteczność lupeolu jest porównywalna do sylimaryny (11).
Badano również aktywność lupeolu przeciwko reakcjom rodnikowym wywołanym przez metale ciężkie indukujące nowotwory nerek i wątroby. U szczurów, którym wstrzyknięto podskórnie kadm, wykazano spadek poziomu produktów peroksydacji lipidów i wzrost poziomu antyoksydantów w nerkach (12). Podobne efekty dla lupeolu i jego estru linoleinianowego uzyskano w tkance wątrobowej. Aktywność linoleinianu lupeolu była zbliżona do aktywności sylimaryny (13).
W innym teście skórę myszy, w celu indukcji nowotworu, poddawano działaniu wolnego rodnika – nadtlenku benzoilu. Podany jednocześnie lupeol zredukował stopień uszkodzeń DNA, białek i lipidów, obniżył poziom generowanego nadtlenku wodoru, zmniejszył ilość produktów peroksydacji lipidów oraz podwyższył aktywność CAT, GPx, GR, GST i GSH. Związek ten może więc być traktowany jako potencjalny czynnik zapobiegający rozwojowi nowotworów skóry (14, 15).
Aktywność kwasu oleanolowego, kwasu 2-hydroksyoleanolowego (kwas krategolowy), erytrodiolu i uwaolu, przebadano na liniach komórkowych raka sutka MCF-7. Wykazano, że uwaol, kwas oleanolowy i krategolowy obniżają poziom wolnych rodników w komórkach i chronią je przed uszkodzeniami wywołanymi nadtlenkiem wodoru. Ponadto dla wszystkich czterech triterpenów odnotowano działanie ochronne wobec uszkodzeń DNA pod wpływem nadtlenku wodoru. Dodatkowo wykazano cytotoksyczność erytrodiolu, uwaolu i kwasu oleanolowego wobec komórek raka sutka (16). Natomiast badania na liniach komórkowych białaczki szpikowej (L1210, K562 i HL-60) wykazały aktywność antyoksydacyjną kwasu oleanolowego i ursolowego. Oba triterpeny spowodowały obniżenie częstości występowania uszkodzeń DNA indukowanych nadtlenkiem wodoru. Odnotowano również działanie cytotoksyczne kwasu oleanolowego i ursolowego wobec komórek białaczki (17).
Wpływ na apoptozę
Jedną z cech charakterystycznych transformacji nowotworowej jest zanik zdolności komórek do apoptozy. Mutacje genowe, prowadzące do rozwoju nowotworu, warunkują upośledzenie mechanizmów regulacji cyklu komórkowego i niekontrolowane podziały. Zaburzenia te polegają na utracie równowagi w odniesieniu do czynników pro- i antyapoptotycznych oraz na uszkodzeniu białek uczestniczących w procesie programowanej śmierci komórki. Przywrócenie komórkom nowotworowym zdolności do obumierania jest potencjalnym punktem uchwytu leków przeciwnowotworowych (6). Pochodne triterpenowe zostały przebadane pod kątem zdolności do indukowania apoptozy w komórkach nowotworowych. W przypadku poszczególnych pochodnych udowodniono szereg mechanizmów aktywacji apoptozy poprzez szlak zewnątrzpochodny oraz wewnątrzpochodny.
Kwas betulinowy indukuje apoptozę poprzez mechanizm mitochondrialny. W badaniach na liniach komórek nowotworowych, związek ten powodował utratę potencjału błonowego mitochondriów, uwolnienie z mitochondriów cytochromu c i czynnika indukcji apoptozy (AIF), aktywację kaspaz cytozolowych oraz fragmentację jądra (18). Innym udowodnionym mechanizmem działania kwasu betulinowego jest generowanie reaktywnych form tlenu (ROS). Zaobserwowano, że w komórkach nowotworowych poddanych działaniu kwasu betulinowego dochodziło do wzrostu poziomu ROS, których obecność powoduje aktywację kaspaz cytozolowych i apoptozę (19). W badaniach na hodowli komórkowej czerniaka wykazano, że ROS uwalniane pod wpływem kwasu betulinowego są również odpowiedzialne za indukcję proapoptotycznych kinaz rodziny MAPK, takich jak p38 oraz SAP/JNK (20).
Kolejnym dyskutowanym mechanizmem jest wpływ kwasu betulinowego na ekspresję białek rodziny Bcl-2, które są czynnikami zarówno pro- jak i antyapoptotycznymi. Ich bilans warunkuje przeżycie lub śmierć komórki. Przykładowo, w badaniach na liniach komórkowych różnych nowotworów, poddanych działaniu kwasu betulinowego, odnotowano wzrost ilości białek proapoptotycznych Bax i Bcl-XS. (19, 21-23). Kwas betulinowy uczestniczy w regulacji apoptozy także poprzez modulację aktywności czynnika transkrypcji jądrowej NF-κB. Badania wykazały, że aktywuje on czynnik NF-κB, który odpowiada za nasilenie transkrypcji genów białek regulujących apoptozę (24). Natomiast w badaniach na komórkach lekoopornego nowotworu prostaty z konstytutywną nadekspresją czynnika NF-κB, uzyskano przeciwny efekt. W komórkach wykazano spadek ekspresji czynnika NF-κB, spowodowany działaniem kwasu betulinowego. Mniejsza aktywność NF-κB skutkowała zmianą stosunku ilościowego białek Bcl-2/Bax oraz rozpadem jądrowego enzymu naprawczego – polimerazy poli-ADP-rybozy (PARP) – co w efekcie indukowało śmierć komórek (25). Odmienne wyniki dotyczące aktywności NF-κB są prawdopodobnie spowodowane jego wielokierunkowym i niekiedy przeciwstawnym działaniem w zakresie regulacji cyklu komórkowego i proliferacji (26).
Badania przeprowadzone na komórkach raka prostaty wykazały aktywację apoptozy przez kolejny triterpen – lupeol. Działanie lupeolu wiąże się ze szlakiem zewnątrzpochodnym. W komórkach poddanych działaniu lupeolu stwierdzono wzrost ekspresji białka Fas, które stanowi receptor błonowy aktywujący szlak apoptozy (tzw. receptor śmierci) oraz wzrost ekspresji białka FADD, uczestniczącego w przekazywaniu sygnału od receptora Fas. Ponadto zaobserwowano rozkład enzymu PARP, co skutkowało kondensacją i degradacją chromatyny (27). Doświadczenia, prowadzone na komórkach raka trzustki opornych na terapię rekombinowanym białkiem TRAIL (TNF-related apoptosis-inducing ligand), wskazały mechanizm, dzięki któremu lupeol uwrażliwia je na działanie tego czynnika. Komórki te wykazują nadekspresję białka cFLIP, będącego inhibitorem kaspazy-8. W ten sposób zostaje zahamowany szlak apoptozy zapoczątkowany przez białka TRAIL. Komórki nowotworowe poddane działaniu lupeolu wykazały spadek ekspresji białek cFLIP i uwrażliwienie na działanie białek TRAIL (28). Inne badania na komórkach raka trzustki udowodniły, że lupeol redukuje ekspresję antyapoptotycznej onkoproteiny Ras odpowiedzialnej za wzrost komórek nowotworowych (29).
Kolejne triterpeny, dla których udowodniono aktywność proapoptotyczną, to kwas ursolowy, oleanolowy i β-amyryna. Badania, przeprowadzone na liniach komórkowych czerniaka B16F-10, wykazały aktywację apoptozy przez kwas ursolowy na drodze różnorakich mechanizmów. Stwierdzono wzrost ekspresji białka p53, które jest istotnym czynnikiem regulującym cykl komórkowy, proces starzenia i apoptozę komórek. Wykazano także wzrost ekspresji kaspazy-3. Ponadto zaobserwowano spadek ekspresji proapoptotycznego białka Bcl-2, poprzez inhibicję czynnika NF-κB, odpowiedzialnego za regulację ekspresji białek z rodziny Bcl-2 (30). W linii komórkowej nowotworu układu nerwowego (1321N1), poddanej działaniu kwasu oleanolowego, stwierdzono wzrost produkcji reaktywnych form tlenu oraz azotu, których obecność wiązała się z utratą potencjału błonowego mitochondriów i dezintegracją ich błon (31). Badania na liniach komórkowych białaczki szpikowej HL60 wskazały kolejny mechanizm indukcji apoptozy przez kwas oleanolowy. Stwierdzono aktywację kaspazy 3 i 9 oraz rozpad enzymu PARP (32). Kolejny triterpen, β-amyryna, powoduje indukcję apoptozy w komórkach nowotworowych poprzez generowanie wolnych rodników. Badania in vitro wykazały także, że hamuje on aktywność oksydazy ksantynowej, co z kolei może świadczyć o potencjalnej aktywności antoksydacyjnej β-amyryny wobec zdrowych komórek (33).
Wpływ na angiogenezę
Wzrost nowotworu może następować pod warunkiem dostarczania mu substancji odżywczych i tlenu. Unaczynienie guza jest istotnym etapem karcynogenezy, bez którego nowotwór pozostaje w stadium przedinwazyjnym. Dopiero pobudzenie angiogenezy warunkuje dalszy rozrost i tworzenie przerzutów. Proces angiogenezy jest indukowany m.in. przez czynnik wzrostu śródbłonka naczyń (VEGF), czynnik wzrostu fibroblastów (FGF), czynnik wzrostu nowotworu (TGF) oraz interleukinę 8 (IL-8). Zastosowanie związków obniżających aktywność tych czynników stanowi kolejną strategię walki z nowotworem (6). Badania prowadzone w warunkach in vitro i in vivo wykazały, że niektóre pochodne triterpenowe są zdolne przeciwdziałać rozrostowi nowotworu na etapie angiogenezy.
Kwas betulinowy hamował aktywność czynnika FGF w komórkach śródbłonka naczyniowego pochodzących z aorty wołowej (34). Badania prowadzone na linii komórkowej raka prostaty wykazały spadek ekspresji czynnika VEGF pod wpływem kwasu betulinowego (35). Hamowanie ekspresji czynnika VEGF przez kwas betulinowy zostało potwierdzone również w badaniach na linii komórkowej nowotworu endometrium. Oprócz tego odnotowano obniżenie ekspresji czynnika HIF-1α (hypoxia-induced factor 1), regulującego ekspresję genu VEGF.
Ponadto zaobserwowano obniżenie aktywności prolidazy – enzymu odpowiedzialnego za metabolizm kolagenu i odgrywającego rolę w angiogenezie. Prolidaza degraduje cząsteczki kolagenu i dostarcza budulca do syntezy nowych łańcuchów kolagenu przez unaczyniający się nowotwór. Zmniejszenie jej aktywności skutkowało hamowaniem biosyntezy kolagenu przez komórki nowotworowe. Prolidaza odpowiada także za aktywację czynnika HIF-1 i pośrednio VEGF (36). Badania na linii komórkowej nowotworu endometrium pokazują szerzej mechanizmy hamowania biosyntezy kolagenu przez kwas betulinowy. Kolagen, jako białko macierzy pozakomórkowej, pełni rolę budulcową, odpowiada za integralność tkanek i interakcje międzykomórkowe. Oddziałuje na komórki poprzez receptory powierzchniowe zwane integrynami α2β1. Reguluje wzrost, różnicowanie oraz procesy nowotworzenia. Wytwarzanie kolagenu jest regulowane m.in. poprzez czynnik wzrostowy IGF-I i pośrednio przez aktywność prolidazy. W komórkach nowotworowych, poddanych działaniu kwasu betulinowego, stwierdzono spadek biosyntezy kolagenu oraz obniżenie aktywności prolidazy. Ponadto zaobserwowano spadek ekspresji integryny α2 oraz receptora dla IGF-I i jego białek sygnałowych – kinaz MAP. Odnotowano także wzrost ekspresji czynnika NF-κB, który odpowiada za spadek ekspresji białek biosyntezy kolagenu (37).
Kolejne triterpeny o potencjalnej aktywności przeciwnowotworowej, to lupeol, kwas ursolowy i oleanolowy. Testy z użyciem modelu śródbłonka ludzkiej żyły pępowinowej udowodniły hamujący wpływ lupeolu na angiogenezę (38). Kwas ursolowy w testach in vitro hamował aktywność urokinazy i katepsyny B – enzymów uczestniczących w etapie degradacji macierzy pozakomórkowej przez rozwijający się guz (39). Testy na modelach biologicznych wykazały, że kwasy ursolowy i oleanolowy są zdolne do inhibicji proliferacji komórek śródbłonka naczyniowego (40).
Ochrona komórek poprzez działanie antyoksydacyjne
Wolne rodniki są zaangażowane w powstawanie uszkodzeń wielu narządów i stanowią bezpośrednią przyczynę degradacji DNA, starzenia organizmu i różnorodnych chorób. Triterpeny pentacykliczne wykazują udowodnioną aktywność antyoksydacyjną, co wiąże się z ich potencjalnym zastosowaniem jako czynników cytoochronnych (8). Wyniki badań potwierdzają działanie ochronne triterpenów wobec komórek nerek, wątroby, serca i limfocytów.
Wolne rodniki odpowiadają za uszkodzenia nerek w przebiegu kamicy nerkowej. Kamienie szczawianowo-wapniowe indukują peroksydację lipidów, stres oksydacyjny i uszkodzenie tkanek. W jednym z doświadczeń implantowano kawałki cynku do tkanki nerkowej szczurów oraz podawano im szczawian amonu, co zapoczątkowało rozwój kamicy szczawianowej. Kuracja lupeolem i betuliną podniosła poziom antyoksydantów: CAT, SOD, GPx, GST, GSH oraz witamin C i E w tkance nerkowej, a także obniżyła poziom peroksydacji lipidów i stopień uszkodzenia narządu (41).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Harborne JB, Baxter H. Phytochemical dictionary. A handbook of bioactive compounds from plants. Taylor and Francis, London 1993. 2. Steglich W, Fugmann B, Lang-Fugmann S (red.). Römpp Encyclopedia – Natural Products. Georg Thieme Verlag, Stuttgart 2000. 3. Xu R, Fazio G, Matsuda S. On the origins of triterpenoid skeletal diversity. Phytochem 2004; 65:261-91. 4. Jäger S, Trojan H, Kopp T i wsp. Pentacyclic triterpene distribution in various plants – rich sources for a new group of multi-potent plant extracts. Molecules 2009; 14:2016-31. 5. Akihisa T, Yasukawa B, Oinuma H i wsp. Triterpene alcohols from the flowers of Compositae and their anti-inflammatory effects. Phytochem 1996; 43:1255-60. 6. Bal J. Biologia molekularna w medycynie. Wyd Nauk PWN Warszawa 2001; 336-81. 7. Ścibior-Bentkowska D, Czeczot H. Komórki nowotworowe a stres oksydacyjny. Post Hig Med Dośw 2009; 63:58-72. 8. Laszczyk M. Pentacyclic triterpenes of the lupane, oleanane and ursane group as tools in cancer therapy. Planta Med 2009; 75:1549-60. 9. Prasad S, Kalra N, Singh M i wsp. Protective effects of lupeol and mango extract against androgen induced oxidative stress in Swiss albino mice. Asian J Androl 2008; 10:313-8. 10. Prasad S, Kalra N, Shukla Y. Hepatoprotective effects of lupeol and mango pulp extract of carcinogen induced alternation in Swiss albino mice. Mol Nutr Food Res 2007; 51:352-9. 11. Preetha S, Kanniappan M, Selvakumar E i wsp. Lupeol ameliorates aflatoxin B1-induced peroxidative hepatic damage in rats. Comp Biochem Physiol C Pharmacol Toxicol Endocrinol 2006; 143:333-9. 12. Nagaraj M, Sunitha S, Varalakshmi P. Effect of lupeol, a pentacyclic triterpene, on the lipid peroxidation and oxidant status in rat kidney after chronic cadmium exposure. J Appl Toxicol 2000; 20:413-7. 13. Sunitha S, Nagaraj M, Varalakshmi P. Hepatoprotective effect of lupeol and lupeol linoleate on tissue antioxidant defence system in cadmium-induced hepatotoxicity in rats. Fitoter 2001; 72:516-23. 14. Sultana S, Saleem M, Sharma S i wsp. Lupeol, a triterpene, prevents free radical mediated macromolecular damage and alleviates benzoyl peroxide induced biochemical alternations in murine skin. Indian J Exp Biol 2003; 41:827-31. 15. Saleem M, Alam A, Arifin S i wsp. Lupeol, a triterpene, inhibits early responses of tumor promotion induced by benzoyl peroxide in murine skin. Pharmacol Res 2003; 43:127-34. 16. Allouche Y, Warleta F, Campos M i wsp. Antioxidant, antiproliferative and pro-apoptotic capacities of pentacyclic triterpenes found in the skin of olives on MCF-7 human breast cancer cells and their effects on DNA damage. J Agric Food Chem 2011; 59:121-30. 17. Ovesna Z, Kozics K, Slamenova D. Protective effects of ursolic acid and oleanolic acid in leukemic cells. Mutat Res 2006; 600:131-7. 18. Fulda S, Scaffidi C, Suzin S i wsp. Activation of mitochondria and release of mitochondrial apoptogenic factors by betulinic acid. J Biol Chem 1998; 273:33942-8. 19. Wick W, Grimmel C, Wagenknecht B i wsp. Betulinic acid-induced apoptosis in glioma cells: A sequential requirement for new protein synthesis, formation of reactive oxygen species, and caspase processing. J Pharmacol Exp Therapeut 1999; 289:1306-12. 20. Tan Y, Yu R, Pezzuto J. Betulinic acid-induced programmed cell death in human melanoma cells involves mitogen-activated protein kinase activation. Clin Canc Res 2003; 9:2866-75. 21. Häcker G, Vaux L. Apoptosis. A sticky business. Curr Biol 1995; 6:622-4. 22. Fulda S, Friesen C, Los M i wsp. Betulinic acid triggers CD95 (APO-1/Fas)- and p35-independent apoptosis via activation of caspases in neuroectodermal tumors. Canc Res 1997; 57:4956-64. 23. Fulda S. Betulinic acid for cancer treatment and prevention. Int J Mol Sci 2008; 9:1096-107. 24. Kasperczyk H, La Ferla-Bruhl K, Westhoff M i wsp. Betulinic acid as new activator of NF-kappaB: molecular mechanisms and implications for cancer therapy. Oncogene 2005; 46:6945-56. 25. Rabi T, Shukla S, Gupta S. Betulinic acid suppresses constitutive and TNF-alpha-induced NF-kappaB activation and induces apoptosis in human prostate carcinoma PC-3 cells. Mol Carcinog 2008; 47:964-73. 26. Skrzycki M, Ścibior-Bentkowska D, Podsiad M i wsp. Poziom białka czynników transkrypcyjnych AP-1 i NF-κB w wybranych nowotworach przewodu pokarmowego człowieka. Pol Merkur Lek 2008; 150:510-5. 27. Saleem M, Kweon M, Yun J i wsp. A novel dietary triterpene lupeol induces Fas-mediated apoptotic death of androgen-sensitive prostate cancer cells and inhibits tumor growth in a xenograft model. Canc Res 2005; 65:11203-13. 28. Murtaza I, Saleem M, Adhami V i wsp. Suppression of cFLIP by lupeol, a dietary triterpene, is sufficient to overcome resistance to TRAIL-mediated apoptosis in chemoresistant human pancreatic cells. Canc Res 2009; 69:1156-65. 29. Saleem M, Kaur S, Kweon M i wsp. Lupeol, a fruit and vegetable based triterpene, induces apoptotic death of human pancreatic adenocarcinoma cells via inhibition of Ras signaling pathway. Carcinogenesis 2005; 26:1956-64. 30. Manu K, Kuttan G. Ursolic acid induces apoptosis by acitvating p53 and caspase-3 gene expressions and suppressing NF-kappaB mediated activation of Bcl-2 in B16F-10 melanoma cells. Immunopharmacol 2008; 8:974-81. 31. Martin R, Carvalho-Tavares J, Ibeas E i wsp. Acidic triterpenes compromise growth and survival of astrocytoma cell lines by regulating reactive oxygen species accumulation. Canc Res 2007; 67:3741-51. 32. Zhang P, Li H, Chen D i wsp. Oleanolic acid induces apoptosis in human leukemia cells through caspase activation and poly(ADP-ribose) polymerase cleavage. Acta Biochim Biophys Sin 2007; 39:803-9. 33. Lin K, Huang A, Tu H i wsp. Xanthine oxidase inhibitory triterpenoid and phloroglucinol from guttiferaceous plants inhibit growth and induced apoptosis in human NTUB1 cells through a ROS-dependent mechanism. J Agric Food Chem 2011; 59:407-14. 34. Kwon H, Shim J, Kim J i wsp. Betulinic acid inhibits growth factor-induced in vitro angiogenesis via the modulation of mitochondrial function in endtothelial cells. Jpn J Canc Res 2002; 93:417-25. 35. Chintharlapalli S, Papinemi S, Ramaiah S i wsp. Betulinic acid inhibits prostate cancer growth through inhibition of specificity protein transcritpion factors. Canc Res 2007; 67:2816-2823. 36. Karna E, Szoka Ł, Pałka J. Betulinic acid inhibits the expression of hypoxia-inducible factor 1 alpha and vascular endothelial growth factor in human endometrial adenocarcinoma cells. Mol Cell Biochem 2010; 340:15-20. 37. Karna E, Pałka J. Mechanism of betulinic acid inhibition of collagen biosynthesis in human endometrial adenocarcinoma cells. Neoplasma 2009; 56:361-6. 38. You Y, Nam N, Kim Y i wsp. Antiangiogenic acitivity of lupeol from Bombax ceiba. Phytother Res 2003; 17:341-4. 39. Jedinak A, Muckova M, Kostalova D i wsp. Antiprotease and antimetastatic activity of ursolic acid isolated from Salvia officinalis. Z Naturforsch C Biosci 2006; 61:777-82. 40. Sohn K, Lee H, Chung H i wsp. Anti-angiogenic activity of triterpene acids. Canc Lett 1995; 94:213-8. 41. Malini M, Lenin M, Varalakshmi P. Protective effect of triterpenes on calcium oxalate crystal-induced peroxidative changes in experimental urolithiasis. Pharmacol Res 2000; 41:413-8. 42. Szuster-Ciesielska A, Kandefer-Szerszeń M. Protective effects of betulin and betulinic acid against ethanol-induced cytotoxicity in HepG2 cells. Pharmacol Rep 2005; 57:588-95. 43. Donfack J, Simo C, Ngameni B i wsp. Antihepatotoxic and antioxidant activities of methanol extract and isolated compounds from Ficus chlamydocarpa. Nat Prod Commun 2010; 10:1607-12. 44. Liu J, Wu Q, Lu Y i wsp. New insights into generalized hepatoprotective effects of oleanolic acid: key roles of metalothionein and Nrf2 induction. Biochem Pharmacol 2008; 76:922-8. 45. Sudharsan P, Mythili Y, Selvakumar E i wsp. Cardioprotective effect of pentacyclic triterpene, lupeol and its ester on cyclophosphamide-induced oxidative stress. Hum Exp Toxicol 2005; 24:313-8. 46. Ramachandran S, Prasad N. Effect of ursolic acid, a triterpenoid antioxidant, on ultraviolet-B radiation-induced cytotoxicity, lipid peroxidation and DNA damage in human lymphocytes. Chem Biol Interact 2008; 176:99-107. 47. Gołąb J, Jakóbisiak M, Lasek W i wsp. Immunologia. PWN, Warszawa 2008; 377-82. 48. Mutschler E, Geisslinger G, Kroemer H i wsp. Kompendium farmakologii i toksykologii Mutschlera. MedPharm Polska, Wrocław 2008; 437. 49. Mantovani A, Allavena P, Sica A i wsp. Cancer-related inflammation. Nature 2008; 454:436-44. 50. Bernard P, Scior T, Didier B i wsp. Ethnopharmacology and bioinformatic combination for leads discovery: application to phospholipase A(2) inhibitors. Phytochem 2001; 58:865-74. 51. Dharmappa K, Kumar R, Nataraju A i wsp. Anti-inflammatory activity of oleanolic acid by inhibition of secretory phospholipase A2. Planta Med 2009; 75:211-5. 52. Suh N, Honda T, Finlay H i wsp. Novel triterpenoids suppress inducible nitric oxide synthase (iNOS) and inducible cycloxygenase (COX-2) in mouse macrophages. Canc Res 1998; 58:717-23. 53. Garg A, Aggarwal B. Nuclear transcription factor-κB as a target for cancer drug development. Leuk 2002; 16:1053-68. 54. Sun H, Fang W, Wang W i wsp. Structure-activity relationships of oleanane and ursane type triterpenoids. Bot Stud 2006; 47:339-68. 55. Akihisa T, Kojima N, Kikuchi T i wsp. Anti-inflammatory and chemopreventive effects of triterpene cinnamates and acetates from shea fat. J Oleo Sci 2010; 59:273-80. 56. Kweifio-Okai G, Macrides T. Antilipoxygenase activity of amyrin triterpenes. Res Comm Chem Pathol Pharmacol 1992; 78:367-72. 57. Ding Y, Nguyen H, Kim S i wsp. The regulation of inflammatory cytokine secretion in macrophage cell line by the chemical constituents of Rhus sylvestris. Bioorg Med Chem Lett 2009; 19:3607-10. 58. Fernandez M, de las Heras B, Garcia M i wsp. New insights into the mechanism of action of the anti-inflammatory triterpene lupeol. J Pharm Pharmacol 2001; 53:1533-9. 59. Bani S, Kaul A, Khan B i wsp. Suppression of T-lymphocyte activity by lupeol isolated from Crataeva religiosa. Phytother Res 2006; 20:279-87. 60. Kang S, Yoon S, Roh D i wsp. The anti-arthritic effect of ursolic acid on zymosan-induced acute inflammation and adjuvant-induced chronic arthritis models. J Pharm Pharmacol 2008; 60:1347-54. 61. Ahmad S, Khan B, Bani S i wsp. Amelioration of adjuvant-induced arthritis by ursolic acid through altered Th1/Th2 cytokine production. Pharmacol Res 2006; 53:233-40. 62. Reyes C, Nunez M, Jimenez I i wsp. Activity of lupane triterpenoids from Maytenus species as inhibitors of nitric oxide and prostaglandin E2. Bioorg Med Chem 2006; 14:1573-9. 63. Geetha T, Varalakshmi P, Latha R. Effect of triperpenes from Crataeva nurvala stem bark on lipid peroxidation in adjuvant induced arthritis in rats. Pharmacol Res 1998; 37:191-5. 64. Melo C, Carvalho K, Neves J i wsp. α-, β-Amyrin, a natural triterpenoid ameliorates L-arginine-induced acute pancreatitis in rats. World J Gastroenterol 2010; 34:4272-80. 65. Recio M, Giner R, Manez S i wsp. Investigations on the steroidal anti-inflammatory activity of triterpenoids from Diospyros leucomelas. Planta Med 1995; 61:9-12. 66. Gao D, Li Q, Li Y i wsp. Antidiabetic potential of oleanolic acid from Ligustrum lucidum. Can J Physiol Pharmacol 2007; 85:1076-83. 67. Jang S, Yee S, Choi J i wsp. Ursolic acid enhances the cellular immune system and pancreatic beta-cell function in streptozotocin-induced diabetic mice fed a high-fat diet. Int Immunopharm 2009; 9:113-9. 68. Singh A, Yadav D, Maurya R i wsp. Antihyperglycaemic activity of alpha-amyrin acetate in rats and db/db mice. Nat Prod Res 2009; 23:876-82. 69. Narender T, Khaliq T, Singh A i wsp. Synthesis of alpha-amyrin derivatives and their in vivo antihyperglycemic activity. Eur J Med Chem 2009; 44:1215-22. 70. Wang Z, Hsu C, Huang C i wsp. Anti-glycative effects of oleanolic acid and ursolic acid in kidney of diabetic mice. Eur J Pharmacol 2010; 628:255-60. 71. Thor P. Podstawy patofizjologii człowieka. Vesalius, Kraków 2009; 281-5. 72. Sudhahar V, Ashok Kumar S, Varalakshmi P i wsp. Protective effect of lupeol an lupeol linoleate in hypercholesterolemia associated renal damage. Mol Cell Biochem 2008; 317:11-20. 73. Sudhahar V, Kumar S, Sudharsan P i wsp. Protective effect of lupeol and its ester on cardiac abnormalities in experimental hypercholesterolemia. Vasc Pharmacol 2007; 46:412-8. 74. Sudhahar V, Ashokkumar S, Varalakshmi P. Effect of lupeol and lupeol linoleate on lipemic – hepatocellular aberrations in rats fed a high cholesterol diet. Mol Nutr Food Res 2006; 50:1212-9. 75. Lee W, Im K, Park Y i wsp. Human ACAT-1 and ACAT-2 inhibitory activities of pentacyclic triterpenes from the leaves of Lycopus lucidus. Biol Pharmaceut Bull 2006; 29:382-4. 76. Karachurina L, Sapozhnikova T, Zarudii F i wsp. Antiinflammatory and antiulcer properities of betulin bis-hemiphthalate. Pharmaceut Chem J 2002; 36:432-3. 77. Astudillo L, Rodriguez J, Schmeda-Hirschmann G. Gastroprotective activity of oleanolic acid derivatives on experimentally induced gastric lesions in rats and mice. J Pharm Pharmacol 2002; 54:583-8. 78. de Andrade S, Comunello E, Noldin V i wsp. Antiulcerogenic activity of fractions and 3,15-dioxo-21α-hydroxy-friedelane isolated from Maytenus robusta (Celastraceae). Pharmacol Res 2008; 31:41-6. 79. Lira S, Rao V, Carvalho A i wsp. Gastroprotective effect of lupeol on ethanol-induced gastrin damage and the underlying mechanism. Inflammopharmacol 2009; 17:221-8. 80. Vidya L, Varalakshmi U. Control of urinary risk factors of stones by betulin and lupeol in experimental hiperoxaluria. Fitoterapia 2000; 71:535-43. 81. Pinto S, Pinto L, Guedes M i wsp. Antinociceptive effect of triterpenoid α,β-amyrin in rats in orofacial pain induced by formalin and capsaicin. Phytomed 2008; 15:630-4. 82. Lima-Junior R, Sousa D, Brito G i wsp. Modulation of acute visceral nociception and bladder inflammation by plant triterpene, α,β-amyrin in a mouse model cystitis: role of tachykinin NK1 – receptors, and K+ATP channels. Inflamm Res 2007; 56:487-94. 83. Begum S, Sultana I, Siddigui B i wsp. Structure and spasmolytic activity of eucalyptanoic acid from Eucalyptus camaldulensis var. obtusa and synthesis of its active derivative from oleanolic acid. J Nat Prod 2002; 65:1939-41. 84. Jin J, Lee Y, Heo J i wsp. Anti-platelet pentacyclic triterpenoids from leaves of Campsis grandiflora. Arch Pharm Res 2004; 27:376-80. 85. Ching J, Chua T, Chin L i wsp. β-amyrin from Ardisia elliptica Thunb. is more potent than aspirin inhibiting collagen-induced platelet aggregation. Indian J Exp Biol 2010; 48:275-9. 86. Zhang L, Ma T. Antagonistic effect of oleanolic acid on anaphylactic shock. Acta Pharmacol Sin 1995; 16:527-30. 87. Matsuda H, Dai Y, Ido Y i wsp. Studies on Kochiae fructus. V. Antipruritic effects of oleanolic acid glycosides and the structure – requirement. Biol Pharmaceut Bull 1998; 11:1231-3. 88. Oliveira F, Lima-Junior R, Cordeiro W i wsp. Pentacyclic triterpenoids, α,β-amyrins, suppress the scratching behavior in a mouse model of pruritis. Pharmacol Biochem Behav 2004; 78:719-25. 89. Alakurtti S, Mäkrelä T, Koskimies S i wsp. Pharmacological properties of the ubiquitous natural product betulin. Eur J Pharmaceut Sci 2006; 29:1-13. 90. Min B, Jung H, Lee J i wsp. Inhibitory effect of triterpenes from Crataegus pinatifida on HIV-1 protease. Planta Med 1999; 65:374-5. 91. Baltina L, Flekhter O, Nigmatullina L i wsp. Lupane triterpenes and derivatives with antiviral activity. Bioorg Med Chem Lett 2003; 13:3549-52. 92. Pavlova N, Savinova O, Nikolaeva S i wsp. Antiviral activity of betulin, betulinic and betulonic acids against some enveloped and non-enveloped viruses. Fitoter 2003; 74:489-92. 93. Yao D, Li H, Gou Y i wsp. Betulinic acid-mediated inhibitory effect on hepatitis B virus by suppression of manganese superoxide dismutase expression. FEBS J 2009; 276:2599-614. 94. Ma C, Wu X, Masao H i wsp. HCV protease inhibitory, cytotoxic and apoptosis-inducing effects of oleanolic acid derivatives. J Pharm Pharmaceut Sci 2009; 12:243-8. 95. Higuchi C, Sannomiya M, Pavan F i wsp. Byrsonima fagifolia Niedenzu apolar compounds with antitubercular activity. Evid Base Compl Alternative Med 2008; 17:1-5. 96. Tanachatchairatana T, Bremner J, Chokchaisiri R i wsp. Antimycobacterial activity of cinnamate-based esters of the triterpenes betulinic, oleanolic and ursolic acids. Hem Pharmaceut Bull 2008; 56:194-8. 97. Cunha W, de Matos G, Souza M i wsp. Evaluation of the antibacterial activity of the methylene chloride extract of Miconia ligustroides, isolated triterpene acids, and ursolic acid derivatives. Pharmaceut Biol 2010; 48:166-9. 98. Horiuchi K, Shiota S, Hatano T i wsp. Antimicrobial activity of oleanolic acid from Salvia officinalis and related compounds on vancomycin-resistant enterococci (VRE). Biol Pharmaceut Bull 2007; 30:1147-9. 99. Kazakova O, Giniiatullina G, Tolstikov G i wsp. Synthesis, modifications and antimicrobial activity of the methylpiperazinyl amides of triterpenic acids. Bioorg Khim 2010; 36:416-22. 100. Salin O, Alakurtti S, Pohjala L i wsp. Inhibitory effect of natural product betulin and its derivatives against the intracellular bacterium Chlamydia pneumoniae. Biochem Pharmacol 2010; 80:1141-51. 101. Johann S, Soldi C, Lyon J i wsp. Antifungal acitivty of the amyrin derivatives and in vitro inhibition of Canidia albicans adhesion to human epithelial cells. Lett Appl Microbiol 2007; 45:148-53. 102. Kuiate J, Mouokeu S, Wabo H i wsp. Antidermatophytic triterpenoids from Syzygium jambos (L.) Alston (Myrtaceae). Phytother Res 2007; 21:149-52. 103. Steele J, Warhust D, Kirby G i wsp. In vitro and in vivo evaluation of betulinic acid as an antimalarial. Phytother Res 1999; 13:115-9. 104. Moon H, Jung J, Lee J. Antiplasmodial activity of triterpenoid isolated from whole plants of Viola genus from South Korea. Parasitol Res 2007; 100:641-4. 105. Chung I, Kim M, Park S i wsp. In vitro evaluation of the antiplasmodial activity of Dendropanax morbifera against chloroquine-sensitive strains of Plasmodium falciparum. Phytother Res 2009; 11:1634-7. 106. van Baren C, Anao I, Leo Di Lira P i wsp. Triterpenic acids and flavonoids from Satureja parvifolia. Evaluation of their antiprotozoal activity. Z Naturforsch C Biosci 2006; 61:189-92. 107. Sairafianpour M, Bahreininejad B, Witt M i wsp. Terpenoids of Salvia hydrangea: two new, rearranged 20-norabietanes and the effect of oleanolic acid on erythrocyte membranes. Planta Med 2003; 69:846-50. 108. Abe F, Yamauchi T, Nagao T i wsp. Ursolic acid as a trypanocidal constituent in rosemary. Biol Pharmaceut Bull 2002; 25:1485-87. 109. Camacho M, Mata R, Castaneda P i wsp. Bioactive compounds from Celaenodendron mexicanum. Planta Med 2000; 66:463-8.

