liczba unikniętych zgonów i zyskane lata życia u leczonych celekoksibem w porównaniu do terapii diklofenakiem.
Ponieważ:
a) nie przeprowadzono w Polsce badań, w których oceniona zostałaby bezpośrednio zarówno efektywność, jak i koszty stosowania diklofenaku oraz celekoksibu,
b) opublikowane na świecie randomizowane kontrolowane badania kliniczne, w których oceniano skuteczność w/w leków dotyczą różnych aspektów wywołanych przez NLPZ powikłań ze strony przewodu pokarmowego,
c) opublikowane na świecie randomizowane kontrolowane badania kliniczne nie odpowiadają w pełni praktyce medycznej w Polsce, skonstruowano matematyczny model, w którym dokonano połączenia danych z różnych źródeł.
Określono następujące podstawowe scenariusze:
1) stu chorych na RZS otrzymuje diklofenak w dawce 75 mg 2 razy dziennie przez 6 miesięcy
2) stu chorych na RZS otrzymuje przez 6 miesięcy 2 razy po 0,2 g celekoksibu
Źródłem danych o efektywności (wynikach) jest wieloośrodkowe, randomizowane, kontrolowane badanie kliniczne typu „head to head”, czyli bezpośrednio porównujące efektywność i toksyczność diklofenaku oraz celekoksibu w odpowiednich dawkach. Schematy postępowania w przypadku wystąpienia działań niepożądanych NLPZ pochodzą z danych literaturowych (standardy międzynarodowe) oraz sformułowane zostały przez polskich ekspertów. Pod uwagę brano tylko bezpośrednie koszty medyczne. Zużyte zasoby wyrażone są w jednostkach oraz w wartościach pieniężnych (po pomnożeniu liczby zużytych jednostek zasobów przez wartość pieniężną poszczególnych jednostek). Źródłem danych o kosztach, wobec braku oficjalnego, opublikowanego cennika usług medycznych, są informacje uzyskane od ekspertów oraz cennik hurtowni farmaceutycznej (12).
Model
Scenariusz podstawowy
Hipotetyczny model przedstawiający konsekwencje przewlekłego stosowania diklofenaku 75 SR i celekoksibu przedstawia ryc. 1. Poszczególne gałęzie drzewa decyzyjnego reprezentują możliwe konsekwencje alternatywnych decyzji. Punkty, z których wychodzą gałęzie, dotyczą albo decyzji dotyczących form opieki nad pacjentem (kwadraty), albo zdarzeń występujących samoistnie (koła). Możliwe są następujące scenariusze:
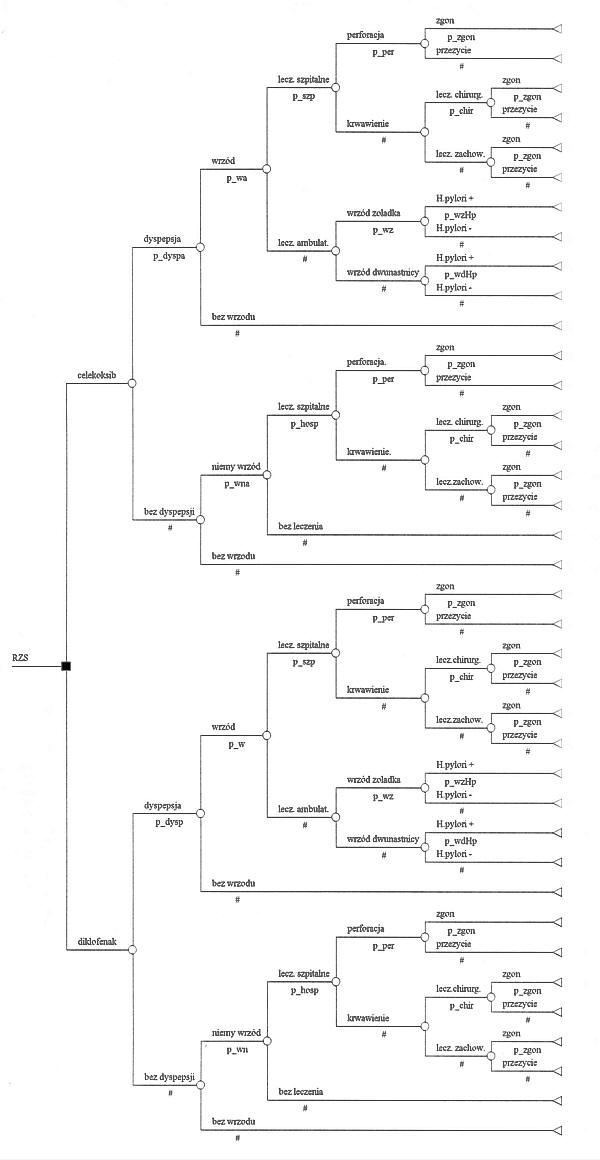
Ryc. 1. Celekoksib vs diklofenak 75 SR, pacjenci z RZS. Jednostka efektywności: przeżycie.
1) u pacjenta występują objawy dyspeptyczne, po wykonaniu gastroskopii rozpoznano u niego wrzód, który musi być leczony chirurgicznie w szpitalu,
2) u pacjenta występują objawy dyspeptyczne, po wykonaniu gastroskopii rozpoznano u niego wrzód, który musi być leczony w szpitalu, ale zabieg chirurgiczny nie jest konieczny,
3) u pacjenta występują objawy dyspeptyczne, po wykonaniu gastroskopii rozpoznano u niego wrzód, który musi być leczony ambulatoryjnie,
4) u pacjenta występują objawy dyspeptyczne, ale po wykonaniu gastroskopii nie stwierdzono owrzodzenia,
5) u pacjenta nie ma objawów dyspeptycznych, ale występuje „niemy” wrzód, który z powodu powikłań wymaga leczenia szpitalnego,
6) u pacjenta nie ma objawów dyspeptycznych, ale występuje „niemy” wrzód, który nie wymaga leczenia,
7) u pacjenta nie ma objawów dyspeptycznych ani owrzodzeń.
W modelu założono, że działania niepożądane NLPZ występują po około 3 miesięcznym stosowaniu diklofenaku lub celekoksibu i w czasie ich leczenia zaprzestaje się stosowania NLPZ (wyjątkiem jest dyspepsja, którą leczy się nie przerywając podawania NLPZ). Po zakończeniu leczenia u chorych, u których wystąpiła tylko dyspepsja stosuje się te same leki, co na początku, natomiast w przypadku innych działań niepożądanych diklofenak zastępuje się preparatem złożonym, zawierającym stałe dawki diklofenaku (75 mg) i mizoprostolu (200 mikrogramów). W modelu założono, że u jednego chorego może wystąpić tylko jedno zdarzenie niepożądane i koszt leczenia zdarzeń niepożądanych jest taki sam, niezależnie od zastosowanego NLPZ.
Prawdopodobieństwa zdarzeń:
Podstawę dla skonstruowania modelu stanowi badanie Emery´ego i wsp. z 1999 r. (1). Jest to randomizowane, kontrolowane badanie kliniczne z podwójnie ślepą próbą, przeprowadzone w 132 ośrodkach (Europa, Izrael, Południowa Afryka, Australia i Nowa Zelandia). Horyzont czasowy badania wynosi 6 miesięcy, a populację badaną stanowią chorzy na RZS. Celekoksib w dawce 0,4 g/d stosowano w grupie liczącej 326 osób, a diklofenak w dawce 0,15 g/d w grupie liczącej 329 osób. U wszystkich chorych objętych badaniem (n=655) oceniano częstość występowania objawów dyspeptycznych i bólów brzucha. U 430 chorych wykonano badanie gastroskopowe w celu określenia częstości występowania owrzodzeń błony śluzowej żołądka i dwunastnicy. Wyniki badania przedstawia tab. 4.
Tabela 4. Wyniki badania Emery´ego i wsp. (1999): częstość występowania owrzodzeń (%) po 6 miesiącach stosowania diklofenaku i celekoksibu.
| | Celekoksib | Diklofenak |
| Owrzodzenia rozpoznane endoskopowo | 4% | 15% |
| Dyspepsja i bóle brzucha | 21% | 34% |
W ciągu 6 miesiącach za pomocą badania endoskopowego owrzodzenia stwierdzono u 4 % pacjentów otrzymujących celekoksib oraz u 15% chorych przyjmujących diklofenak 75 mg SR. Z praktyki klinicznej wiadomo, że nie wszystkie rozpoznane endoskopowo owrzodzenia powodują objawy i są leczone. Również nie wszyscy chorzy z objawami zgłaszają się do lekarza, aby otrzymać leczenie. Ponieważ w modelu interesują nas tylko owrzodzenia wymagające leczenia, należy oszacować, jaki odsetek rozpoznanych endoskopowo owrzodzeń daje objawy. Według danych przedstawionych przez Hillmana (13) nieme owrzodzenia stanowią 40% wszystkich owrzodzeń, częstość występowania objawowych owrzodzeń wynosi więc 60%. W badaniach, w których w losowo wybranej grupie chorych z RZS wykonano badanie endoskopowe, a następnie zapytano o obecność objawów ze strony przewodu pokarmowego, odsetek objawowych owrzodzeń wynosił 33% i 44% (14, 15). Ten niższy odsetek został uwzględniony w analizie wrażliwości.
Tylko niektóre wrzody są przyczyną ciężkich powikłań, takich jak krwawienie lub perforacja, i wymagają leczenia szpitalnego. Analiza wszystkich opublikowanych dużych badań epidemiologicznych i klinicznych, w których przedstawiono dane na temat częstości występowania wrzodów i ich ciężkich powikłań wykazała, że istnieje pewien stały związek pomiędzy częstością objawowych wrzodów, a częstością występowania ciężkich powikłań: 30% lub 1 z 3,3 przypadków objawowych wrzodów jest powikłany (16). Singh (17) w prospektywnym badaniu obserwacyjnym wykazał, że prawdopodobieństwo hospitalizacji „niemych wrzodów” wynosi 0,091.
Problem stanowi oszacowanie, jaki odsetek hospitalizowanych pacjentów wymaga leczenia chirurgicznego. Wobec braku polskich danych, przyjęto wartość średnią – 23%, obliczoną na podstawie danych pochodzących z Holandii (18), Belgii (19), Wielkiej Brytanii i USA (20) (tab. 5).
Tabela 5. Odsetek chorych hospitalizowanych z powodu powikłań wywołanych przez NLPZ, leczonych operacyjnie. Dane z Holandii, Belgii, Francji, Wielkiej Brytanii i USA.
wartość średnia - 23%, zakres 12-43%
| Belgia | Holandia | W.Brytania | USA |
| 16,7% | 22,5% | 43% | 12% |
Ponieważ schematy leczenia wrzodu żołądka i wrzodu dwunastnicy różnią się, ustalono proporcję tych typów owrzodzeń. W podstawowym modelu przyjęto, że stosowanie NLPZ powoduje o 20% więcej wrzodów żołądka niż wrzodów dwunastnicy, czyli na 6 wrzodów żołądka przypada 5 wrzodów dwunastnicy (21-23).
W celu oszacowania odsetka zgonów spowodowanych toksycznym działaniem NLPZ w obrębie przewodu pokarmowego, wykorzystano dane literaturowe, wg których śmiertelność wśród pacjentów hospitalizowanych z powodu powikłań wywołanych NLPZ wynosi 7 – 15%, średnio 10% (24-30).
Prawdopodobieństwa zdarzeń występujących w modelu decyzyjnym oraz źródła danych przedstawia tab. 6.
Schematy postępowania w przypadku działań niepożądanych NLPZ
Tabela 6. Prawdopodobieństwa zdarzeń przedstawionych w modelu decyzyjnym oraz źródła danych. Horyzont czasowy 6 miesięcy.
Diklofenak:
| Zdarzenie | Prawdopodobieństwo | Zródło danych |
| Wrzód rozpoznany endoskopowo | 0,15 | 1 |
| Dyspepsja i ból brzucha | 0,34 | 1 |
| Wrzód u pacjentów z dyspepsją | 0,26 | 1, 13 |
| Hospitalizacja, jeśli wrzód objawowy | 0,3 | 16 |
| Leczenie operacyjne, jeśli hospitalizacja | 0,23 | Średnia z kilku krajów |
| Niemy wrzód u pacjentów bez dyspepsji | 0,09 | 1, 13 |
| Hospitalizacja, jeśli niemy wrzód | 0,091 | 17 |
| Zgon z powodu powikłań | 0,1 | 24-30 |
| Wrzód żołądka: wrzód dwunastnicy | 1,2: 1 | 21-23 |
Celekoksib:
| Zdarzenie | Prawdopodobieństwo | Źródło danych |
|
Wrzód rozpoznany endoskopowo | 0,04 | 1 |
|
Dyspepsja i ból brzucha | 0,21 | 1 |
| Wrzód u pacjentów z dyspepsją | 0,11 | 1 |
| Hospitalizacja, jeśli wrzód objawowy | 0,3 | 16 |
| Leczenie operacyjne, jeśli hospitalizacja | 0,226 | Średnia z kilku krajów |
| Niemy wrzód u pacjentów bez dyspepsji i bólów brzucha | 0,02 | 1 |
| Hospitalizacja, jeśli niemy wrzód | 0,091 | 17 |
| Zgon z powodu powikłań | 0,1 | 24-30 |
| Wrzód żołądka: wrzód dwunastnicy | 1,2: 1 | 21-23 |
W celu obliczenia zużytych zasobów należy ustalić schemat postępowania w przypadku dyspepsji, wrzodu żołądka i dwunastnicy oraz ciężkich powikłań (krwawienia z przewodu pokarmowego, perforacji). Przyjęto, że postępowanie diagnostyczno-terapeutyczne w przypadku dyspepsji wskutek działań niepożądanych NLPZ w obrębie przewodu pokarmowego jest zgodne z zaleceniami Europejskiej Grupy Roboczej w sprawie wskazań i sposobu leczenia chorób żołądka i dwunastnicy (31). Zalecenia te zostały zaakceptowane przez polską Grupę Roboczą i Specjalistę Krajowego w dziedzinie gastroenterologii. Algorytm postępowania przedstawia ryc. 2. Schematy postępowania w przypadku krwawienia z przewodu pokarmowego oraz perforacji ustalono na podstawie opinii panelu ekspertów (3 gastroenterologów i 4 chirurgów).
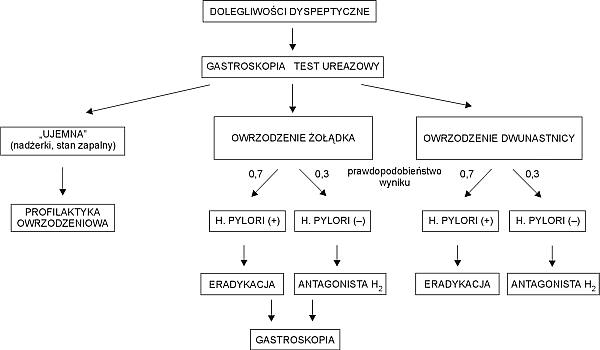
Ryc. 2. Algorytm postępowania przy dolegliwościach dyspeptycznych u chorego leczonego NLPZ.
1. Dyspepsja
Pacjent z dyspepsją korzysta średnio z jednej konsultacji lekarskiej, wykonuje się u niego gastroskopię, test na Helicobacter pylori. Dalsze postępowanie zależy od tego, czy stwierdzono owrzodzenie żołądka lub dwunastnicy, czy też nie.
2. Dyspepsja bez wrzodu
Leczenie ogranicza się do stosowania przez 28 dni: ranitydyny w dawce 2 razy dziennie 150 mg oraz leku zobojętniającego (Maalox lub Alugastrin) 6 razy dziennie 1 tbl.
3. Wrzód żołądka
Diagnostykę rozszerza się o biopsję (6 wycinków), badanie histopatologiczne oraz gastroskopię wykonywaną po leczeniu. W przypadku zakażenia Helicobacter pylori (70% przypadków owrzodzeń) prowadzi się leczenie eradykacyjne: inhibitor pompy protonowej (omeprazol 20 mg, pantoprazol 40 mg lub lansoprazol 30 mg) 2 razy dziennie przez 7 dni, a potem 1 raz dziennie przez 35 dni, amoksycylina 1 g 2 razy dziennie przez 7 dni i klarytromycyna 0,5 g 2 razy dziennie przez 7 dni. W przypadku ujemnego testu na Helicobacter pylori (30% przypadków) przez 42 dni podaje się inhibitor pompy protonowej (omeprazol 20 mg, pantoprazol 40 mg lub lansoprazol 30 mg) 1 raz dziennie.
3. Wrzód dwunastnicy
W przypadku zakażenia Helicobacter pylori (90% przypadków owrzodzeń) prowadzi się leczenie eradykacyjne: inhibitor pompy protonowej (omeprazol 20 mg, pantoprazol 40 mg lub lansoprazol 30 mg) 2 razy dziennie przez 7 dni, a potem 1 raz dziennie przez 21 dni, amoksycylina 1 g 2 razy dziennie przez 7 dni i klarytromycyna 0,5 g 2 razy dziennie przez 7 dni. W przypadku ujemnego testu na Helicobacter pylori (10% przypadków) przez 28 dni podaje się inhibitor pompy protonowej (omeprazol 20 mg, pantoprazol 40 mg lub lansoprazol 30 mg) 1 raz dziennie .
4. Krwawienie z przewodu pokarmowego
U chorego z krwawieniem z wrzodu żołądka i dwunastnicy stosuje się leczenie zachowawcze: sonda do żołądka, płukanie zimnym roztworem soli fizjologicznej bez lub z dodatkiem noradrenaliny, dożylnie antagoniści H2 lub inhibitory pompy protonowej, płyny, krew (2-3 j. masy erytrocytarnej), osocze mrożone. W dobrze wyposażonych oddziałach istnieje możliwość wykonania doraźnej gastroskopii tamującej krwawienie (gastroskopia i koagulacja za pomocą bimera argonowego lub wstrzyknięcie igłą endoskopową adrenaliny lub aetoksysklerolu). Wykonuje się zestaw badań podstawowych (morfologia, mocznik, kreatynina, jonogram, grupa krwi), 2 gastroskopie (na początku i na końcu leczenia). Średni pobyt w szpitalu trwa 5 dni. Po wypisaniu ze szpitala zaleca się 6-tygodniowe leczenie doustne antagonistą H2, np.ranitydyną 150 mg 2 razy dziennie. Około 20% przypadków nie udaje się wyleczyć zachowawczo i konieczna jest doraźna operacja (laparotomia i podkłucie wrzodu lub też resekcja żołądka). Pacjent przebywa w szpitalu średno 7 dni, otrzymuje rutynowo antybiotyki. Przed operacją obok zestawu badań podstawowych wykonuje się ekg. Po wypisaniu pacjentom, u których wykonano podkłucie wrzodu, zaleca się 6-tygodniowe leczenie doustne antagonistą H2, np ranitydyną (150 mg 2 razy dziennie).
5. Perforacja żołądka lub dwunastnicy
Leczenie polega na wykonaniu zabiegu chirurgicznego:
1) zeszycie perforacji i drenaż otrzewnej,
2) resekcja żołądka
3) resekcja żołądka i wagotomia
4) wagotomia i pyloroplastyka
Jeśli perforacja wrzodu jest pierwszym epizodem choroby wrzodowej i jednocześnie jej powikłaniem, z zasady wykonuje się zeszycie perforacji. U pacjenta wykonuje się zestaw badań podstawowych (morfologia, mocznik, kreatynina, jonogram, grupa krwi), zdjęcie przeglądowe jamy brzusznej, ekg. Pacjent otrzymuje antybiotyki: 1 godz. przed operacją i przez czas hospitalizacji (cefuroksym z metronidazolem, piperacylinę lub amoksycylinę z kwasem klawulanowym), płyny dożylnie. Średni pobyt w szpitalu trwa 7 dni.
6. Nieme owrzodzenie
U pacjentów z niemym owrzodzeniem nie ma dolegliwości dyspeptycznych, zakładamy że trafiają oni bezpośrednio do szpitala z powodu krwawienia lub perforacji.
Kalkulacja kosztów leczenia działań niepożądanych NLPZ z perpsektywy płatnika za usługi zdrowotne (pacjent i budżet kas chorych).
Kalkulując koszty leczenia działań niepożądanych NLPZ w obrębie przewodu pokarmowego brano pod uwagę:
1) najtańsze w Polsce preparaty z danej grupy terapeutycznej.
2) najdroższe w Polsce preparaty z danej grupy
Koszt doby pobytu w szpitalu obejmuje tzw. koszty stałe i koszt stosowanych u pacjenta leków, koszt badań dodatkowych, koszt masy erytrocytarnej i osocza mrożonego.
Dane o kosztach jednostkowych i całkowitych zużytych zasobów przedstawiono w tabelach 7 i 8.
Analiza efektywności kosztów
Wyniki analizy efektywności kosztów, w której efektem jest brak objawowego owrzodzenia, przedstawia tabela 9.
Wyniki analizy efektywności kosztów, w której efektem jest brak objawów ze strony przewodu pokarmowego, przedstawia tabela 10.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Emery P., Zeidler H., Kvien T.K., et al. Celecoxib versus diclofenac in long-term management of rheumatoid arthritis: randomised double-blind comparison. The Lancet, 1999, 354, 2106-2111.
2. Simon L.S., Weaver A.L., Graham D.Y., et al. Anti-inflammatory and upper gastrointestinal effects of celecoxib in rheumatoid arthritis. A randomized controlled trial. JAMA, 1999, 282(20), 1921-1928.
3. Gierse J.K., Hauser S.D., Creely D.P., et al. Expression and selctive inhibition of the constitutive and inducible forms of human cyclooxygenase. Biochem. J., 1995, 305, 479-84.
4. Laneuville O., Breurer D.K., Devitt D.L., et al. Differential inhibition of human prostaglandin endoperoxide H synthases-1 and –2 by nonsteroidal anti-inflammatory drugs. J. Pharmacol. Exp. Ther., 1994, 271, 927-34.
5. Johnson R.E., Hornbroock M.C. et al. Analysis of the costs of NSAID-associated gastropathy: experience in a US health maintenance organisation. Pharmacoeconomics, 1997, 12 (1), 76-88.
6. de Pouvourville G. The economic consequences of NSAID induced gastrointestinal damage. Br. J. Med. Econ. 1992; 2: 93-102.
7. Fort J. Celecoxib, a COX-2-specific inhibitor: the clinical data. Am. J. Of Orthopedics, 1999, Supplement (March 1999), 13-18.
8. Geiss G.S. Upfate on clinical develpments with celecoxib, a new specific COX-2 inhibitor. What can we expect? J. Rheumatol., 1999, 26 (Supplement 56), 31-36.
9. Celebrex (Celecoxib) Food and Drug Administration (FDA) Advisory Committee Briefing Document. 1998.
10. Goldstein J.L., Agrawal N.M., Silverstein F., et al. Celecoxib is associated with a low rate of clinically significant upper GI events: a ten year open label trial. Am. J. Gastroenterol., 1999, 94, 2752 abstract 699.
11. Fries JF, Williams C.A., Bloch D.A., Michel B.A. Nonsteroidal anti-inflammatory drug-associated gastropathy: incidence and risk factors. Am. J. Med., 1991, 90, 213-222.
12. Cennik hurtowni farmaceutycznej CEFARM, lipiec-sierpień 2000.
13. Hillman A., Bloom B.S. Economic effects of prophylactic use of misoprostol to prevent gastric ulcer in patients taking non-steroidal anti-inflammatory drugs. Arch. Intern. Med., 1989, 149, 2061-2065.
14. Larkai E.N., Smith J.L., Lidsky M.D. Gastroduodenal mucosa and dyspeptic symptoms in arthritic patients during chronic nonsteroidal anti-inflammatory drug use. Am. J. Agstroenterol., 1987, 82, 1153-8.
15. Farah D., Sturrock R.D., Russell R.I. peptic ulcer in rheumatoid arthritis. Ann. Rheum. Dis., 1988, 47, 478-80.
16. Tramer M.R., Moore R.A., Reynolds D.J.M., McQuay H. Quantitative estimation of rare adverse events which follow a biological progression: a new model applied to chronic NSDAID use. 2000, Pain 85, 169-182.
17. Singh G. et al. Gastrointestinal tract complications of nonsteroidal anti-inflammatory drug treatment in rheumatoid arthritis. A prospective observational study. Arch. Inter. Med., 1996, 156, 1529-1536.
18. Al. M.J., Rutten F.F.H. The cost-effectiveness of diclofenac plus misoprostol compared with diclofenac monotherapy in patients with rheumatoid arthritis. Pharmacoeconomics, 1996, 10(2), 141-151.
19. Carrin G.J., Torfs K.E. Economic evaluation of prophylactic treatment with misoprostol in osteoarthritis patients treated with NSAIDs. The case of Belgium. Rev. Epidemiol. Et Sante, 1990, 38, 187-199.
20. Drummond M., Ferraz M.B., Mason J. Assesing the cost-effectiveness of NSAID: an international perspective. J. Rheumatol., 1995, 22:7, 1408-11.
21. Farah D., Sturrock R.D., Russell R.I. Peptic ulcer in rheumatoid arthritis. Ann. Rheum. Dis., 1988, 47, 478-80.
22. Mellem H., Stave R., Myren J. et al. Symptoms in patients with peptic ulcer and hematemesis and/or melena related to use of non-steroid anti-inflammatory drugs. Scand. J. Gastroenetrol, 1985, 20, 1246-8.
23. Mc Carthy D.M. Nonsteroidal antiinflammatory drug-induced ulcers: management by traditional therapies. Gastroenterology, 1989, 96, 662-74.
24. Fries J.F. NSAID gastropathy: the second most deadly rheumatioc disease? Epidemiology and risk appraisal. J. Rheumatol., 1991, Suppl.28, 186-210.
25. Fries J.F. NSAID-induced GI damage. Risk and risk factors. New Standards in Arthritis Care. 1992, 32-5.
26. Fries J.F. The epidemiology of NSAID gastropathy. The ARAMIS experience. J. Clin. Rheumatol., 1998, 4(5), S11-S16.
27. Garcia R.L., Ruigomez A., Hasselgres G., et al. Comparison of mortality from peptic ulcer bleed between patients with or without peptic ulcer antecedents. Epidemiology, 1998, 9(4), 452-6.
28. Coleman S.Y., Wong J., Pritchett C.J., et al. Risk models for rebleeding and postoperative mortality in bleeding gastric ulcer. Ann. R. Coll. Surg. Engl., 1991, 73, 179-84.
29. Smart H.L., Langman M.J.S. Late outcome of bleeding gastric ulcers. Gut, 1986, 27, 926-8.
30. Rorbaek-Madsen M., Fischer L., Thomsen H., et al. Late outcome of bleeding gastric ulcer: five to eight years follow-up. Scand. J. Gastroenterol., 1994, 29, 983-7.
31. Stanowisko Grupy Roboczej ds Helicobacter pylori. Gastroenterologia Polska, 1996, 3,5.
32. Orlewska E. Analiza koszty-efektywność stosowania preparatu Arthrotec 75 vs diklofenak SR 75 u chorych z reumatoidalnym zapaleniem stawów lub chorobą zwyrodnieniową stawów w Polsce. Farmakoekonomika, 2000, 1, 2-18.
33. Lindberg G., Seensalu R., nilsson l.H., et al. Transferability of a computer system for medical history taking and decision support in dyspepsia: a comparison of indicants for peptic ulcer disease. Scand. J. Gastroenterol., 1987, 22 (suppl. 128), 190-196.
34. Gotthard R., Bodemar G., Joensson K.A. Diagnostic outcome in patients with dyspepsia: a preliminary report. Scand. J. Gastroenterol, 22 (suppl. 128), 86-69.
35. Kagevi I., Loefstedt S., Persson L-G. Endoscopic findings and diagnoses in unselected dyspepsia at a primary health care center. Scand. J. Gastroenterol., 1989, 24, 145-150.
36. Zhao S.Z., Arguelles L.M., Dedhiya S.D., et al. Healthcare utilization associated with dyspepsia in patients withs arthritis. Am. J.Menaged Care, 1999, 10 (5),1285-1295.
37. Svarvar P., et al. Modelling the health economic impact of introducing celecoxib in NSAID-taking rheumatoid arthritis and osteoarthritis populations in the Nordic countries. Annals of the Rheumatic Diseases, 2000, 59 (Suppl.1), 277
38. Hunsche E., et al. Cost-effectiveness of celecoxib – a COX-2 specific inhibitor – in the treatment of arthritis in Switzerland. Annals of the Rheumatic Diseases, 2000, 59 (Suppl.1), 279.
39. Orlewska E., Mierzejewski P. Polskie wytyczne przeprowadzania badań farmakoekonomicznych. Farmakoekonomika, 2000, Suplement 1, 3-11.
Pozostałe artykuły z numeru 2/2001:


