Tilden D1, Aristides M1, Stynes G1, Orlewska E2, Krzakowski M3, Jassem J4, Załuski J5, Włodarczyk H5
Analiza kosztów i efektów stosowania gemcytabiny w połączeniu z cisplatyną w porównaniu z winorelbiną w połączeniu z cisplatyną w leczeniu niedrobnokomórkowego raka płuca w Polsce: retrospektywna analiza ekonomiczna badań klinicznych
1 M-TAG Hammersmith, United Kingdom
2 Centrum Farmakoekonomiki, Warszawa, Polska
3 Instytut Centrum Onkologii im. M. Skłodowskiej-Curie, Klinika Nowotworów Płuc i Klatki Piersiowej, Warszawa, Polska
4 Klinika Onkologii i Radioterapii, Akademia Medyczna, Gdańsk, Polska
5 Wielkopolskie Centrum Onkologii, Klinika Chemioterapii, Poznań, Polska
Streszczenie
Cel: Ocena kosztów i efektywności gemcytabiny w skojarzeniu z cisplatyną (Gem/Cis) oraz winorelbiny w skojarzeniu z cisplatyną (Vin/Cis) w leczeniu niedrobnokomórkowego raka płuca (NDRP) w Polsce.
Metody: Koszty i efektywność Gem/Cis i Vin/Cis oceniono, biorąc pod uwagę dane o skuteczności i toksyczności pochodzące z opublikowanych międzynarodowych badań klinicznych bezpośrednio porównujących względem siebie strategie brane pod uwagę w analizie oraz polskie dane o zużytych zasobach i kosztach jednostkowych. Analizę przeprowadzono z punktu widzenia płatnika za świadczenia medyczne, uwzględniając wyłącznie bezpośrednie koszty medyczne (koszty chemioterapii, leczenia towarzyszącego i leczenia działań niepożądanych) w 1-rocznym horyzoncie czasowym. Informacje na temat zasobów zużytych w związku z występowaniem działań niepożądanych cytostatyków uzyskano od polskich ekspertów z 3 ośrodków onkologicznych (Warszawa, Gdańsk i Poznań). Przeprowadzono jednokierunkowe analizy wrażliwości.
Wyniki: Wyniki badań klinicznych nie wykazują statystycznie istotnych różnic w całkowitym czasie przeżycia chorych, u których stosowano Gem/Cis lub Vin/Cis. Całkowite bezpośrednie koszty medyczne oszacowano na 17 132 PLN dla Gem/Cis i 17 023 PLN dla Vin/Cis. Głównym składnikiem kosztów był koszt nabycia cytostatyków, który stanowił odpowiednio 64% i 50% całkowitych kosztów Gem/Cis i Vin/Cis. Wyższy koszt nabycia gemcytabiny kompensowany jest przez niższy koszt podawania leków i niższy wskaźnik hospitalizacji chorych leczonych Gem/Cis. Wyniki analiz wrażliwości wskazują, że w większości przypadków koszty Gem/Cis i Vin/Cis są podobne.
Wniosek: przeprowadzona analiza ekonomiczna, w której przyjęto udowodnioną jednakową skuteczność Gem/Cis i Vin/Cis oraz większą toksyczność winorelbiny, dostarcza argumentów na opłacalność stosowania gemcytabiny w leczeniu NDRP.

Wstęp
Leczenie niedrobnokomórkowego raka płuca (NDRP) jest trudną i kontrowersyjną dziedziną onkologii. Problem ten jest bardzo istotny, ponieważ w większości krajów nowotwory złośliwe płuca stanowią jedną z głównych przyczyn zgonów, a zapadalność na nie wciąż wzrasta. Niniejsze badanie dotyczy leczenia chorych w zaawansowanym stadium niedrobnokomórkowego raka płuca (NDRP), czyli grupy, do której należy większość chorych na NDRP. Ze względu na coraz wyższe koszty związane z leczeniem NDRP na świecie w wyborze sposobu terapii brane są pod uwagę wyniki analiz ekonomicznych. Na ich podstawie można ocenić opłacalność nowych metod terapeutycznych, uwzględniając ich skuteczność, toksyczność oraz koszt w porównaniu do standardowego postępowania klinicznego.
Przedstawione badanie jest adaptacją oceny ekonomicznej przeprowadzonej dla National Institute of Clinical Excellence (NICE) w Wielkiej Brytanii. Głównym celem tego badania jest porównanie kosztów i wyników stosowania gemcytabiny w skojarzeniu z cisplatyną (Gem/Cis) oraz winorelbiny w skojarzeniu z cisplatyną (Vin/Cis) w leczeniu zaawansowanego NDRP w Polsce.
Gemcytabina i winorelbina należą do nowej generacji leków o udowodnionej skuteczności w leczeniu NDRP, niewiele jest jednak do tej pory dowodów na względną opłacalność stosowania Gem/Cis i Vin/Cis w NDRP w poszczególnych krajach.
Epidemiologia
Nowotwory złośliwe płuca są w Polsce najczęstszym nowotworem złośliwym u mężczyzn (29,4%), a u kobiet stanowią drugą lokalizację nowotworową (7%) (1-3). U mężczyzn są co trzecią, a u kobiet co 10 przyczyną zgonu z powodu nowotworów złośliwych (1, 2). Liczba zarejestrowanych zachorowań na raka płuca w skali całej Polski wynosi rocznie około 20 000, w czym 80% stanowią zachorowania na niedrobnokomórkowego raka płuca (NDRP) (4). U około 50-55% chorych na NDRP w chwili ustalenia rozpoznania stwierdza się obecność przerzutów (stopień IV zaawansowania) (5). Rokowanie u tych chorych jest bardzo złe – praktycznie wszyscy chorzy umierają w ciągu 2 lat od chwili rozpoznania. Mediana przeżycia chorego z nieleczonym NDRP z przerzutami wynosi tylko 4-5 miesięcy, a zaledwie 10% chorych przeżywa 1 rok (6).
Rola chemioterapii w leczeniu NDRP
Dane uzyskane w randomizowanych badaniach klinicznych jednoznacznie pokazują, że zastosowanie chemioterapii powoduje znaczącą, chociaż umiarkowaną poprawę czasu przeżycia we wszystkich fazach NDRP (6-9). Współczynnik ryzyka pooperacyjnej chemioterapii wspomagającej opartej o cisplatynę, stosowanej we wczesnej fazie choroby, wynosi 0,87, co odpowiada bezwzględnemu wzrostowi współczynnika przeżycia o 5% po 5 latach. W przypadku pacjentów z bardziej zaawansowanym nowotworem, współczynnik ryzyka chemioterapii wynosi 0,73, co odpowiada bezwzględnemu wzrostowi współczynnika przeżycia po roku o 10% (w porównaniu z samym leczeniem podtrzymującym). Ponadto randomizowane badania porównujące chemioterapię z najlepszymi metodami leczenia objawowego wykazały, że chemioterapia zmniejsza objawy i poprawia jakość życia (10, 11).
W chemioterapii NDRP stosuje się wiele leków cytostatycznych o udowodnionej skuteczności (4, 12, 13). Istnieje powszechna zgodność, że programy chemioterapii pierwszego rzutu powinny zawierać cisplatynę (8, 9). Cisplatyna jednak, mimo że pozostaje ważnym składnikiem najaktywniejszych terapii, paradoksalnie może przyczynić się do ograniczenia zastosowania chemioterapii w leczeniu NDRP. W ostatniej dekadzie wprowadzenie do praktyki klinicznej kilku nowych leków o udowodnionym działaniu przeciwnowotworowym u chorych na NDRP oraz obniżonej toksyczności, wzbudziło nadzieję na poprawę wyników chemioterapii NDRP. Najbardziej obiecujące spośród nowych aktywnych leków są: winorelbina, gemcytabina i taksany. Charakteryzują się one aktywnością cytotoksyczną, ogólnie mniejszą toksycznością i jednocześnie zróżnicowanym profilem działań niepożądanych oraz wykazują synergizm z cisplatyną w programach wielolekowych (13). Wyniki uzyskane w badaniach fazy II i III (14-42) wykazują, że w zaawansowanym NDRP:
1) dodanie do cisplatyny nowego leku zarówno wydłuża czas przeżycia, jak i poprawia jakość życia w porównaniu z monoterapią cisplatyną,
2) nowe leki w monoterapii wykazują podobną skuteczność do konwencjonalnych programów wielolekowych,
3) nowe leki w skojarzeniu z cisplatyną (programy trzeciej generacji) w porównaniu do konwencjonalnych programów wielolekowych zawierających cisplatynę co najmniej zwiększają odsetek obiektywnych odpowiedzi na leczenie oraz wydłużają czas do postępu choroby,
4) żaden z nowych programów wielolekowych nie wyróżnia się w znamienny statystycznie sposób w zakresie czasu trwania odpowiedzi i ogólnego przeżycia chorych w porównawczych badaniach bezpośrednich, różnią się one jednak między sobą profilem działań niepożądanych.
Potrzeby kliniczne a praktyka
W Polsce większość chorych na NDRP otrzymuje leczenie objawowe i radioterapię paliatywną. Może to częściowo wynikać z panującego wśród lekarzy i pacjentów przekonania o toksyczności chemioterapii i jej nieskuteczności w leczeniu NDRP. Szacuje się, że w Polsce potencjalnie 4000-5000 osób, u których rozpoznano NDRP mogłoby być poddawanych chemioterapii (4). Najczęściej w chemioterapii NDRP stosowane są konwencjonalne programy wielolekowe, takie jak: PE (etopozyd/cisplatyna), MIC (mitomycyna, ifosfamid, cisplatyna) i MVP (mitomycyna, windezyna lub winblastyna i cisplatyna) (4).
Według wytycznych klinicznych gemcytabina, winorelbina i paclitaksel w skojarzeniu z cisplatyną mogą być brane pod uwagę jako jedna z opcji chemioterapii pierwszego rzutu u pacjentów w zaawansowanym stadium NDRP (stadium III i IV). Monoterapię docetakselem powinno się rozważyć jako leczenie drugiego rzutu u chorych z miejscowo zaawansowanym NDRP lub NDRP z przerzutami.
Cel badania
Celem badania była ocena opłacalności stosowania gemcytabiny w skojarzeniu z cisplatyną (GemCis) w porównaniu z programem zawierającym winorelbiną i cisplatynę (VinCis) w leczeniu chorych na NDRP w stadium IIIB i IV w Polsce. Program Vin/Cis jest obecnie w Polsce najczęściej stosowanym programem chemioterapii wielolekowej z udziałem nowych leków i cisplatyny.
Metody
Niniejsza analiza oparta jest na oryginalnej analizie przeprowadzonej dla NICE (National Institute of Clinical Excellence). Modyfikacje polegają na zastąpieniu i/lub uzupełnieniu informacji o zużytych zasobach uzyskanych za granicą o polskie dane, w celu skorygowania i zaadoptowania analizy do polskich warunków. Zmiany dotyczą przede wszystkim rodzaju i liczby zużytych zasobów związanych z leczeniem działań niepożądanych oraz kosztów jednostkowych zużytych zasobów.
Źródła danych
Dane o skuteczności (oczekiwane przeżycie) i toksyczności porównywanych strategii, dawkowaniu leków i liczbie cykli chemioterapii pochodzą z opublikowanego randomizowanego kontrolowanego badania klinicznego, bezpośrednio porównującego alternatywy brane pod uwagę w analizie (41). W badaniu tym chorzy z zaawansowanym NDRP (42% w stadium IIIB, 58% w stadium IV), w wieku 70 lat i stanie sprawności 1 wg skali WHO zostali losowo przydzieleni do grupy otrzymującej Gem/Cis oraz do grupy przyjmującej Vin/Cis. Wstępną analizę przeprowadzono w momencie, gdy można było dokonać oceny czasu przeżycia u 60 pacjentów z każdej grupy.
Jeżeli w referencyjnym badaniu klinicznym (41) brakowało informacji na temat zużycia określonych zasobów, korzystano z dodatkowych źródeł danych: zaakceptowanej Charakterystyki Produktu oraz innych badań klinicznych: badania Scagliotti´ego i wsp., które porównuje gemcytabinę/cisplatynę, paklitaksel/karboplatynę i winorelbinę/cisplatynę (42), badania Schillera i wsp., które porównuje gemcytabinę/cisplatynę, paklitaksel/karboplatynę, paklitaksel/cisplatynę i docetaksel/cisplatynę (43) oraz nieopublikowanej modelowej oceny gemcytabiny/cisplatyny w porównaniu z paklitakselem/karboplatyną i winorelbiną/cisplatyną (44).
Dane o zużyciu zasobów medycznych odpowiadające specyficznej dla Polski praktyce klinicznej uzyskano za pomocą ankiety przeprowadzonej w 3 ośrodkach onkologicznych w Polsce (Warszawa, Poznań, Gdańsk). Zgromadzone w ten sposób informacje zostały następnie zweryfikowane i potwierdzone przez panel ekspertów klinicznych.
Plan badania
Analizę przeprowadzono z perspektywy płatnika za świadczenia zdrowotne. W związku z tym uwzględniono tylko bezpośrednie koszty medyczne, pomijając koszty utraty produktywności (w ramach pracy zarobkowej, niezarobkowej i tzw. czasu wolnego) oraz koszty opieki społecznej i opieki nieformalnej sprawowanej przez rodzinę lub innych opiekunów. Możliwości zmniejszenia tych kosztów dzięki lepszym metodom leczenia zaawansowanego NDRP powinny być brane pod uwagę jako zysk jakościowy, nawet jeśli analiza ilościowa ich nie uwzględnia.
Kalkulację kosztów przeprowadzono metodą „zamiaru leczenia” (intention-to-treat). W ten sposób uwzględniono wszelkie potencjalne związki między wykorzystaniem zasobów a uzyskanymi wynikami. Kosztów nie dyskontowano ze względu na 12-miesięczny horyzont czasowy badania. Koszty jednostkowe zużytych zasobów pochodzą z 2002 r.
Schemat porównywanych programów, dawkowanie leków i liczbę cykli chemioterapii przedstawia tabela 1.
Tabela 1. Dawkowanie leków i liczba cykli porównywanych programów chemioterapii wg referencyjnego badania klinicznego (41).
| Gem/Cis | Gemcytabina | Cisplatyna |
| Dawka (wg protokołu badania) | 1000 mg/m2 | 100 mg/m2 |
| Zastosowana dawkaa | 1800 mg | 180 mg |
| Liczba dawek na jeden cykl | 3 | 1 |
| Liczba cykli na jednego pacjentab | 2,6 | 2,6 |
| Długość cyklu | 28 dni | 28 dni |
| Dni podawania leku | 1, 8, 15 | 2 |
| Vin/Cis | Winorelbina | Cisplatyna |
| Dawka (wg protokołu badania) | 30 mg/m2 | 120 mg/m2 |
| Zastosowana dawkaa | 54 mg | 216 mg |
| Liczba dawek na jeden cykl | 5 | 1 |
| Liczba cykli na jednego pacjentab | 2,5 | 2,5 |
| Długość cyklu | 35 dni | 35 dni |
| Dni podawania leku | 1, 8, 15, 22, 29 | 1, 29, następnie co 42 dni |
a Dawka zastosowana przy założeniu, że średnia powierzchnia ciała wynosi 1,8 m2, co odpowiada średniej powierzcni ciała uczestników badania klinicznego
b Średnia liczba cykli na jednego pacjenta w badaniu klinicznym.
Wyniki
Wyniki kliniczne
Rycina 1 przedstawia podsumowanie wstępnych wyników klinicznych uzyskanych w referencyjnym badaniu klinicznym. Gem/Cis w porównaniu z Vin/Cis w wydłuża średni czas przeżycia (42 vs 35 tygodni) i zwiększa odsetek obiektywnych odpowiedzi na leczenie (30% vs 25%). Analiza statystyczna tych wstępnych danych nie została przeprowadzona, ale należy podkreślić, że z powodu niekorzystnego współczynnika przeżycia zakończono wcześniej próbę kliniczną w grupie Vin/Cis. Ponieważ w referencyjnym badaniu klinicznym nie oceniono znamienności statystycznej różnic dla punktów końcowych oceny skuteczności porównywanych programów, w analizie przyjęto konserwatywne założenie takiej samej skuteczności obu metod leczenia. Ocena ekonomiczna przeprowadzona na podstawie referencyjnego badania klinicznego (41) jest więc analizą minimalizacji kosztów.
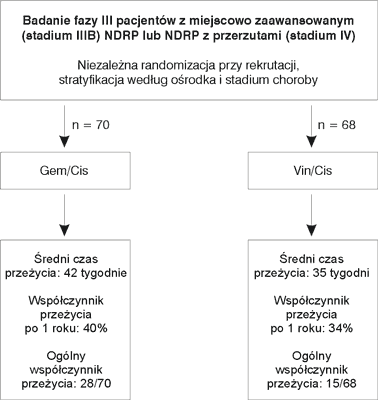
Ryc. 1. Porównywane strategie i ich wyniki wg referencyjnego badania klinicznego (41).
Koszty
W analizie uwzględniono następujące elementy bezpośredniego kosztu medycznego:
1) koszt nabycia cystostatyków,
2) koszt podania chemioterapii,
3) koszt hospitalizacji spowodowanych działaniami niepożądanymi cytostatyków,
4) koszty innych zasobów medycznych (konsultacje, radioterapia, transfuzje krwi i leki towarzyszące).
Kalkulacja kosztów nabycia leków cytostatycznych
Koszt zakupu leków do chemioterapii w przeliczeniu na 1 chorego obliczono, mnożąc oczekiwany koszt leków w jednym cyklu chemioterapii przez średnią liczbę cykli podanych jednemu choremu w referencyjnym badaniu klinicznym (tab. 2).
Tabela 2. Koszt nabycia cytostatyków na podst. danych o dawce i liczbie fiolek zużytych w referencyjnym badaniu klinicznym (41).
| Terapia | Koszt programua (PLN/pacjenta) | Lek | Koszt leku (PLN/pacjenta) | Dawka | Liczba fiolek/1 pacjenta | Cena fiolki (PLN) |
| Gem/Cis | 10 975,77 | Gemcytabina | 10 790,91 | 1000 mg | 7,8 | 756,85 |
| 200 mg | 31,2 | 156,65 |
| Cisplatyna | 184,86 | 50 mg | 7,8 | 18,20 |
| 25 mg | 2,6 | 11,20 |
| 10 mg | 2,6 | 5,30 |
| Vin/Cis | 8558,50 | Winorelbina | 8350,00 | 50 mg | 12,5 | 550,00 |
| 10 mg | 12,5 | 118,00 |
| Cisplatyna | 208,50 | 50 mg | 10 | 18,20 |
| 10 mg | 5 | 5,30 |
a Koszt programu na 1 pacjenta = suma (liczba fiolek poszczególnych leków w programie x koszt jednostkowy fiolki)
Kalkulacja kosztów podawania chemioterapii
Koszt podawania chemioterapii (tab. 3) obliczono mnożąc oczekiwaną liczbę podań leków przez koszt jednostkowy podania leku. Koszt jednostkowy jest kosztem ważonym, uwzględniającym odsetek podań dokonanych w warunkach szpitalnych oraz podań dokonanych w warunkach ambulatoryjnych.
Tabela 3. Liczba i koszt podań chemioterapii wg referencyjnego badania klinicznego (41).
| Terapia | Koszt podania na 1 pacjentaa (PLN) | Liczba dni podawania w 1 cyklu | Liczba cykli na 1 pacjenta | Liczba dni podawania na 1 pacjenta | Liczba dni podawania w warunkach szpitalnych | Liczba dni podawania w warunakch ambulatoryjnych | Dzienny koszt podawania ambulatoryjnego (PLN) |
| Gem/Cis | 1287,00 | 3 | 2,6 | 7,8 | 0 | 7,8 | 165,00 |
| Vin/Cis | 2062,50 | 5 | 2,5 | 12,5 | 0 | 12,5 | 165,00 |
a koszt podawania na 1 pacjenta = (liczba dni podawania w szpitalu x koszt jednostkowy podawania w szpitalu) + (liczba dni podawania ambulatoryjnego x koszt jednostkowy podawania ambulatoryjnego);
Kalkulacja kosztów hospitalizacji z powodu działań niepożądanych
Koszty hospitalizacji z powodu działań niepożądanych obliczono, mnożąc oczekiwaną liczbę chorych hospitalizowanych z powodu działań niepożądanych według referencyjnego badania klinicznego (lub innego źródła danych) przez oczekiwany koszt jednej hospitalizacji (tab. 4.)
Tabela 4. Odsetek pacjentów hospitalizowanych z powodu działań niepożądanych i koszty tych hospitalizacji.
| Działanie niepożądane | Koszt jednostkowy (PLN) | Gem/Cis | Vin/Cis |
| Odsetek chorych | Koszt (PLN) | Odsetek chorych | Koszt (PLN) |
| Neutropenia z gorączką | 4142,00 | 10,7%a | 442,37 | 27,8%b | 1151,48 |
| Małopłytkowość | 1326,00 | 30,0%c | 397,80 | 20,0%c | 265,20 |
| Nudności/wymioty | 613,00 | 30,0%c | 183,90 | 50,0%c | 306,50 |
| Neuropatia | 2321,00 | 3,0%f | 69,63 | 20,0%g | 464,20 |
| Anemia | 831,00 | 1,7%a | 14,13 | 3,4%d | 28,25 |
| Antybiotyki IV | 1454,00 | 25,0%a | 363,65 | 26,5%e | 385,93 |
| Koszt hospitalizacji na pacjentah | | | 1471,47 | | 2601,56 |
a Schiller et al. (42); b Informacja o produkcie; c Comella et al. (41); d Scagliotti et al. (43); e Średnia dla innych nowych metod leczenia; f Średnia wyników z badań Comella et al. (41), Rubio Terres et al. (44), Schiller et al. (42); g Średnia wyników z badań Rubio Terres et al. (44), Schiller et al. (42);
h Koszt hospitalizacji na 1 pacjenta = suma (prawdopodobieństwo wystąpienia każdego z działań niepożądanych x koszt jednostkowy każdego działania niepożądanego)
Koszty innych zasobów medycznych
Koszty innych zasobów medycznych obejmują konsultacje lekarskie i pielęgniarskie (tab. 5), radioterapię (tab. 6), transfuzje krwi i produktów krwiopochodnych (tab. 7) oraz stosowanie leków towarzyszących (tab. 8).
Tabela 5. Koszty konsultacji lekarzy ogólnych udzielanych chorym wg referencyjnego badania klinicznego (41).
| Gem/Cis | Vin/Cis |
| Czas do postępu choroby | 4,5 miesięcy | 4,0 miesiące |
| Całkowity czas przeżycia | 8,1 miesięcy | 8,1 miesięcy |
| Liczba wizyt u lekarza ogólnego | 11,7 | 12,2 |
| Koszt jednej wizyty | 35,00 PLN | 35,00 PLN |
| Koszt wizyt u lekarza ogólnego na 1 pacjentaa | 409,50 PLN | 427,00 PLN |
a Koszt wizyt u lekarza ogólnego na 1 pacjenta = zakładana liczba wizyt x koszt jednostkowy wizyty
Tabela 6. Koszty pacjentów wymagających radioterapii.
| Gem/Cis | Vin/Cis |
| Procent pacjentów wymagających radioterapii | 23,3%b | 23,3%b |
| Koszt podawania radioterapii | 7717,00 PLN | 7717,00 PLN |
| Koszt radioterapiia | 1800,63 PLN | 1800,63 PLN |
a Koszt radioterapii na 1 pacjenta = prawdopodobieństwo stosowania radioterapii x koszt kursu radioterapii; b Comella et al. (41)
Tabela 7. Koszt transfuzji krwi w trakcie leczenia (41). Koszty jednostkowe przetaczanych produktów podane są w załączniku (tab. A.2.).
| Gem/Cis | Vin/Cis |
| Krwinki czerwone | 16%a | 21%a |
| Koszt na 1 pacjentab | 212,00 PLN | 212,00 PLN |
| Płytki krwi | 8%a | 8%a |
| Koszt na 1 pacjentac | 372,00 PLN | 372,00 PLN |
| Oczekiwany koszt na 1 pacjentad | 63,68 PLN | 74,28 PLN |
a Scagliotti et al. (43); b koszt 600 ml krwi do transfuzji (100,00 PLN za 300 ml) i kosztu wykonania transfuzji (12,00 PLN); c koszt 300 ml krwi do transfuzji (60,00 PLN za 50 ml) i kosztu wykonania transfuzji (12,00 PLN); d Koszt transfuzji krwi na 1 pacjenta = (prawdopodobieństwo przetoczenia czerwonych krwinek x koszt krwinek na 1 pacjenta) + (prawdopodobieństwo przetoczenia płytek krwi x koszt płytek krwi na 1 pacjenta)
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Zatoński W., Przewoźniak K. Palenie tytoniu w Polsce: postawy, następstwa zdrowotne i profilaktyka. Centrum Onkologii - Instytut im. M. Skłodowskiej Curie, Warszawa 1996.
2. Zatoński W. Rozwój sytuacji zdrowotnej w Polsce na tle innych krajów Europy Środkowej i Wschodniej. Wydawnictwo ANTA, Warszawa 2000.
3. Zatoński W., Tyczyński J. (red.). Epidemiologia nowotworów złośliwych w Polsce w piętnastoleciu 1980-1994. Centrum Onkologii - Instytut im. M. Skłodowskiej Curie, Warszawa 1997.
4. Krzakowski M., Siedlecki P. Standardy leczenia systemowego nowotworów złośliwych u dorosłych w Polsce. Polskie Towarzystwo Onkologii Klinicznej, Warszawa, 1999.
5. Krzakowski M. (red). Onkologia Kliniczna. Borgis, Warszawa 2001.
6. Rapp E., Pater J.L., Willan A., et al. Chemotherapy can prolong survival in patients with advanced non-small-cell lung cancer - a report of a Canadian multicenter randomized trial. J. Clin. Oncol. 1998, 6, 633-41.
7. Marino P., Pampallona S., Preatoni A., et al. Chemotherapy vs. supportive care in advanced non-small-cell lung cancer: results of a meta-analysis of the literature. Chest, 1994, 106, 861-5.
8. Non-small Cell Lung Cancer Collaborative Group. Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials. BMJ, 1995, 311, 899-909.
9. Non-Small Cell Lung Cancer Collaborative Group: Chemotherapy for non-small cell lung cancer (Cochrane Review). Cochrane Library 2. Oxford, United Kingdom, The Cochrane Collaboration, 2000 (update software).
10. Cullen M., Oxman A.D., Billingham J., Woodraffe C., at al. Mitomycin, ifoisfamide and cisplatyn in unresectabela non-small cell lung cancer: effects on survival and quality of life. J. Clin. Oncol., 1999, 17, 3188-94.
11. Helsing M., Bergman B., Thaning L., et al. Quality of life and survival in patients with advanced non-small cell lung cancer receiving supportive care plus chemotherapy with carboplatin and etoposoide or supportive care only: A multicentre randomized phase III trial - Joint Lung Cancer Study Group. Eur. J. cancer, 1998, 34, 1036-1044.
12. Gralla R. New directions in non-small cell lung cancer. Semin. Oncol., 1990, 17 (suppl. 7), 20-29.
13. Lilelbaum R.C., Green M.R. Novel chemotherapeutic agents in the treatment of non-small cell lung cancer. J. Clin. Oncol., 1993, 11, 1391-1402.
14. Fossella F. V., Devore R., Kerr R.N., Crawford J., Natale M., Dunphy F., Kalman L.A., Miller V., Soo Lee J., Moore M., Gandara D.R., Karp D., Vokes E.E., Kris M.G., Kim Y., Gamza F., Hammershaimb L., and TAX 320 Non-Small-Cell Lung Cancer Study Group. Randomised phase III trial of docetaxel versus vinorelbine or ifosfamide in patients with advanced non-small-cell lung cancer previously treated with platinum-containing chemotherapy regimes. J. Clin. Oncol., 2000, 18(12), 2354-2362.
15. Bokkel-Huinink W.W., Bergman B., Chemaissani A., Dornoff W., Drings P., Kellokumpu-Lehtinen P.L., et al. Single-agent gemcitabine: an active and better tolerated alternative to standard cisplatyn-based chemotherapy in locally advanced or metastatic non-small cell lung cancer. Lung Cancer, 1999, 26, 85-94.
16. Manegold C., Bergman B., Chemaissani A., Dornoff W., Drings P., Kellokumpu L.P., et al. Single-agent gemcitabine versus cisplatyn-etoposide: early results of a randomized phase II study in locally advanced or metastatic non-small-cell lung cancer. Ann. Oncol., 1997, 8, 525-9.
17. Cardenal F., Lopez-Cabrerizo M.P., Anton A., Alberola V., Massuti B., Carrato A., et al. Randomized phase III study of gemcitabine-cisplatyn versus etoposide-cisplatyn in the treatment of locally advanced or metastatic non-small-cell lung cancer. J. Clin. Oncol., 1999, 17, 12-8.
18. Crino L., Scagliotti G.V., Ricci S., De Marinis F., Rinaldi M., Gridelli C., et al. Gemcitabine and cisplatyn versus mitomycin, ifosfamide, and cisplatyn in advanced non-small-cell lung cancer: A randomized phase III study of the Italian Lung CancerProject. J. Clin. Oncol., 1999, 17, 3522-30.
19. Perng R.P., Chen Y.M., Ming L.J., Tsai C.M., Lin W.C., Yang K.Y., et al. Gemcitabine versus the combination of cisplatyn and etoposide in patients with inoperable non-small-cell lung cancer in a phase II randomized study. J. Clin. Oncol., 1997, 15, 2097-102.
20. Sandler A.B., Nemunaitis J., Denham C., von Pawel J., Cormier Y., Gatzemeier U., et al. Phase III trial of gemcitabine plus cisplatyn versus cisplatyn alone in patients with 178 locally advanced or metastatic non-small-cell lung cancer. J. Clin. Oncol., 2000, 18, 122-30.
21. Bonomi P., Kim K., Fairclough D., Cella D., Kugler J., Rowinsky E., et al. Comparison of survival and quality of life in advanced non-small-cell lung cancer patients treated with two dose levels of paclitaxel combined with cisplatyn versus etoposide with cisplatyn: results of an Eastern Cooperative Oncology Group trial. J. Clin. Oncol., 2000, 18, 623-31.
22. Chang A.Y., Kim K., Glick J., Anderson T., Karp D., Johnson D. Phase II stud y of taxol, merbarone, and piroxantrone in stage IV non-small-cell lung cancer: The Eastern Cooperative Oncology Group Results J. Natl. Cancer Inst., 1993, 85, 388-94.
23. Ranson M., Davidson N., Nicolson M., Falk S., Carmichael J., Lopez P., Anderson H., Gustafson N., Jeynes A., Gallant G., Washington T., Thatcher N. Randomized trial of paclitaxel plus supportive care versus supportive care for patients with advanced non-small cell lung cancer. J. Natl. Cancer Inst., 2000, 92(13), 1074-1080.
24. Postmus P.E., Giaccone G., Debruyne C., Sahmoud T., Splinter T.A., van Zandwijk N. Results of the phase II EORTC study comparing paclitaxel/cisplatyn with teniposide/cisplatyn in patients with non-small cell lung cancer. EORTC Lung CancerCooperative Group. Semin. Oncol., 1996, 23, 10-3.
25. Gatzemeier U., von Pawel J., Gottfried M., ten Velde G.P.M., Mattson K., DeMarinis F., Harper P., Salvati F., Robinet G., Lucenti A., Bogaerts J., Gallant G. Phase III comparative study of high-dose cisplatyn versus a combination of paclitaxel and cisplatyn in patients with advanced non-small-cell lung cancer. J. Clin. Oncol., 2000, 18(19), 3390-3399.
26. Giaccone G., Splinter T.A., Debruyne C., Kho G.S., Lianes P., van Zandwijk N., et al. Randomized study of paclitaxel-cisplatyn versus cisplatyn-teniposide in patients with advanced non-small-cell lung cancer. The European Organization for Research and Treatment of Cancer Lung Cancer Cooperative Group J. Clin. Oncol., 1998, 16, 2133-41.
27. Baldini E., Tibaldi C., Ardizzoni A., Salvati F., Antilli A., Portalone L., et al. Cisplatyn-vindesine-mitomycin (MVP) vs cisplatyn-ifosfamide-vinorelbine (PIN) vs carboplatin vinorelbine(CaN) in patients with advanced non-small-cell lung cancer (NDRP): a FONICAP randomized phase II study. Italian Lung Cancer Task Force (FONICAP). Br. J. Cancer, 1998, 77, 2367-70.
28. Colleoni M., Vicario G., Pancheri F., Sgarbossa G., Nelli P., Manente P. A randomized phase II trial of cisplatynum plus mitomycin-C plus vinorelbine and carboplatin plus vinorelbine in advanced non-small cell lung cancer. Int. J. Oncol., 1997, 10, 619-22.
29. Colucci G., Gebbia V., Galetta D., Riccardi F., Cariello S., Gebbia N. Cisplatyn and vinorelbine followed by ifosfamide plus epirubicin vs the opposite sequence in179 advanced unresectable stage III and metastatic stage IV non-small-cell lung cancer: a prospective randomized study of the Southern Italy Oncology Group (GOIM). Br. J. Cancer, 1997, 76, 1509-17.
30. Comella P., Frasci G., De Cataldis G., Panza N., Cioffi R., Curcio C., et al. Cisplatyn/carboplatin + etoposide + vinorelbine in advanced non-small-cell lung cancer: a multicentre randomised trial. Gruppo Oncologico Campano. Br. J. Cancer, 1996, 74, 1805-11.
31. Crawford J., O´Rourke M., Schiller J.H., Spiridonidis C.H., Yanovich S., Ozer H., et al. Randomized trial of vinorelbine compared with fluorouracil plus leucovorin inpatients with stage IV non-small-cell lung cancer. J. Clin. Oncol., 1996, 14, 2774-84.
32. Depierre A., Chastang C., Quoix E., Lebeau B., Blanchon F., Paillot N., et al. Vinorelbine versus vinorelbine plus cisplatyn in advanced non-small cell lung cancer: a randomized trial. Ann. Oncol., 1994, 5, 37-42.
33. Furuse K., Fukuoka M., Kuba M., Yamori S., Nakai Y., Negoro S., et al. Randomized study of vinorelbine (VRB) versus vindesine (VDS) in previously untreated stage IIIBor IV non-small-cell lung cancer (NDRP). The Japan Vinorelbine Lung Cancer Cooperative Study Group. Ann. Oncol., 1996, 7, 815-20.
34. Le Chevalier T., Brisgand D., Douillard J.Y., Pujol J.L., Alberola V., Monnier A., et al. Randomized study of vinorelbine and cisplatyn versus vindesine and cisplatyn versus vinorelbine alone in advanced non-small-cell lung cancer: results of a European multicenter trial including 612 patients. J. Clin. Oncol,. 1994, 12, 360-7.
35. Lorusso V., Pezzella G., Catino A.M., Guida M., Scoditti S., Lorenzo R., et al. Results of a clinical multicentric randomized phase II study of non-small cell lung cancer treated with vinorelbine-cisplatyn versus vinorelbine alone. Int. J. Oncol., 1995, 6, 65-8.
36. Martoni A., Guaraldi M., Piana E., Strocchi E., Petralia A., Busutti L., et al. Multicenter randomized clinical trial on high-dose epirubicin plus cisplatynum versus vinorelbine plus cisplatynum in advanced non small cell lung cancer. Lung Cancer, 1998, 22, 31-8.
37. Perol M., Guerin J.C., Thomas P., Poirier R., Carles P., Robinet G., et al. Multicenter randomized trial comparing cisplatyn-mitomycin- vinorelbine versus cisplatyn- mitomycin-vindesine in advanced non-small cell lung cancer. "Groupe Francais de Pneumo-Cancerologie". Lung Cancer, 1996, 14, 119-34.
38. Wozniak A.J., Crowley J.J., Balcerzak S.P., Weiss G.R., Spiridonidis C.H., Baker L.H., et al. Randomized trial comparing cisplatyn with cisplatyn plus vinorelbine in the treatment of advanced non-small-cell lung cancer: a Southwest Oncology Group study. J. Clin. Oncol., 1998,16, 2459-65.
39. The Elderly Lung Cancer Vinorelbine Italian Study Group (ELVIS). Effects of vinorelbine on quality of life and survival of elderly patients with advanced non-small-cell lung cancer. J. Natl. Cancer Inst., 1999, 91, 66-72.
40. Comella P., Frasci G., Panza N., Manzione L., Lorusso V., Di Rienzo G., et al. Cisplatyn, gemcitabine, and vinorelbine combination therapy in advanced non-small-cell lung cancer: a phase II randomized study of the Southern Italy Cooperative Oncology Group. J. Clin. Oncol., 1999, 17, 1526-34.
41. Comella P., Frasci G., Panza N., Manzione L., De Cataldis G., Cioffi R., et al. Randomized trial comparing cisplatyn, gemcitabine, and vinorelbine with either cisplatyn and gemcitabine or cisplatyn and vinorelbine in advanced non-small-cell lung cancer: interim analysis of a phase III trial of the Southern Italy CooperativeOncology Group. J. Clin. Oncol., 2000, 18, 1451-7.
42. Scagliotti G.V., De Marinis F., Rinaldi M., et al. Phase III randomized trial comparing three platinum-based doublets in non-small cell lung cancer. ASCO 2001: proceedings of the 37th Annual meeting of the American Society of Clinical Oncology.
43. Schiller J.H., Harrington D., et al. Comparison of four chemotherapy regimens for advanced non-small-cell lung cancer. N. Engl. J. Med., 2002, 346(2), 92-98.
44. Rubio-Terres, et al. An unpublished modeled evaluation of gemcitabine/cisplatyn compared with paclitaxel/carboplatin and vinorelbin/cisplatyn. Eli Lilly on file, 2001.
45. Nuijten M.J.C. Data management in modeling studies: the selection of data sources. Pharmacoeconomics, 1998, 3, 305-16.
46. Weinstein M.C., O´Brien B., Hornberger J., et al. Principles of good practice for decision analytic modeling in health care evaluation: report of the ISPOR Task Force on Good Research Practices - Modeling Studies. Value in Health, 2003, 6(1), 9-17.
47. Orlewska E., Mierzejewski P. Polskie wytyczne przeprowadzania badań farmakoekonomicznych (projekt). Farmakoekonomika, 2000, Suplement 1, 2-11. Dostępne: http://www.decyzjemedyczne/org.pl
48. Australian Department of Health and Aged Care. Guidelines for the Pharmaceutical Industry on Preparation of Submissions to the Pharmaceutical benefits Advisory Committee: including major submissions involving economic analyses [online]. Available form URL: http://www.health.gov.au/pgs/pubs/pharmpac/gusubpac.htm [Accessed 2002, Mar 28].

