© Borgis - Postępy Fitoterapii 4/2013, s. 225-235
*Katarzyna Karłowicz-Bodalska1, Stanisław Han1, Tomasz Han2, Marta Miranowicz3, Agnieszka Bodalska3
Centella asiatica (L.) Urban, syn. Hydrocotyle asiatica L. – wąkrota azjatycka – znana roślina lecznicza Dalekiego Wschodu
Centella asiatica (L.) Urban, syn. Hydrocotyle asiatica L. – chemistry and activity
1Zakład Farmacji Przemysłowej, Wydział Farmaceutyczny, Uniwersytet Medyczny we Wrocławiu
Kierownik Zakładu: dr Stanisław Han
2Przedsiębiorstwo Produkcji Farmaceutycznej Hasco-Lek S.A.
3Studenckie Koło Naukowe, Zakład Farmacji Przemysłowej, Uniwersytet Medyczny we Wrocławiu
Opiekun Koła: mgr farm. Katarzyna Karłowicz-Bodalska
Summary
The leaves and the whole herb of Indian Pennywort (Centella asiatica (L). Urban), (often mentioned in combination with the related marsh pennywort Hydrocotyle vulgaris L.) are used in Ajurveda medicine for thousands of years for improving memory and as remedium for treatment of central nervous system diseases, vasculo-cardiac disorders, chronic gastric ulcers, dermatopathies, hard healing wounds, lepra, and in edema with increased capillary filtration. The main components of this longevity herb, responsible for above activity, are the triterpenoids, mainly asiatic and madecassic acids and their sugar esters (pseudosaponins), asiaticoside and madecassoside. The objective of this article was to demonstrate some last investigations of the healing properties of Centella asiatica herb and of its active pseudosaponins, especially asiaticoside and madecassoside, mainly related to their action for some connective tissue and mental disorders.

Wstęp
Centella asiatica (L.) Urban, syn. Hydrocotyle asiatica (L.) wąkrota azjatycka, rodz. Apiaceae (Selerowate), ang. Indian Pennywort, Indian Hydrocotyle – jest cenioną rośliną medycyny ajurwedyjskiej (ayur – życie i veda – wiedza), jednej z najstarszych metod leczenia, rozpowszechnionej w południowo-wschodniej Azji, głównie w Indiach, od ponad 3000 lat. Medycyna ajurwedyjska wywodzi się z tekstów religijnych holistycznej wizji rzeczywistości, według której (w odniesieniu do medycyny) organizm ludzki tworzy układ całościowy bez podziału na ciało i duszę. Podstawowym założeniem tej metody jest usuwanie przyczyny choroby, nie tylko jej skutków, a także traktowanie, jako obiektu leczenia, całego organizmu, a nie jego pojedynczych organów. Proces leczenia według tego systemu obejmuje trzy etapy: przygotowanie, terapię właściwą oraz oczyszczanie i regenerację (wzmacnianie i usuwanie z organizmu substancji toksycznych). W medycynie ajurwedyjskiej, poza wąkrotą azjatycką, wykorzystywanych jest wiele roślin leczniczych, m.in. kardamon (Elettaria cardamomum), rauwolfia (Rauwolfia serpentina), sandałowiec biały (Santalum album), witania ospała (Withania somnifera), miłorząb dwuklapowy (japoński) (Ginkgo biloba), biedrzyga (Podophyllum hexandrum) i in. (1).
Centella asiatica (L.) Urban występuje rodzimie i jest hodowana w tropikalnych i subtropikalnych krajach południowo-wschodniej Azji, głównie w Indiach, Chinach, Japonii, Malezji i Indonezji, lecz również w Południowej Afryce, na Madagaskarze, w Australii oraz w Południowej i Środkowej Ameryce, najczęściej na terenach obfitujących w wodę, zarówno nasłonecznionych, jak i zacienionych.
Roślina jest znana pod różnymi nazwami. W Indiach i Nepalu powszechnie znana jest jako Gotu kola oraz Brahmi (od imienia bogini mądrości) i Saraswati (od imienia bogini wiedzy i mądrości).
W Indiach, w zależności od położenia geograficznego uprawianych terenów, Centella asiatica przyjmuje różne lokalne nazwy, np. Manimuni (Assam), Karinga, Karivana (okolice Bombaju), Vallari (wyżyna Dekanu), Brahmi, Brahma-manduki, Brahmi Bheda, Khulakudi, Madukaparni (dial. hindu), Vallarai, Yoshanavalli, Chandaki (dial. tamilski), Mandookaparni i Eka-parni (sanskryt) (2).
Surowcem leczniczym pozyskiwanym z wąkroty azjatyckiej w medycynie Dalekiego Wschodu są zarówno liście, jak i cała roślina z korzeniami, stosowane od tysięcy lat jako swoiste panaceum w różnych chorobach ośrodkowego układu nerwowego (usprawnienie funkcji szarych komórek, poprawa pamięci i kojarzenia, podwyższanie I.Q., w depresji), w niedomodze układu sercowo-naczyniowego (w nadciśnieniu, zaburzeniach krążenia obwodowego), chorobie wrzodowej przewodu pokarmowego, w chorobach skóry, w tym w leczeniu trudno gojących się ran. Lekarze indyjscy stosują preparaty z wąkroty azjatyckiej zewnętrznie i wewnętrznie w chronicznych owrzodzeniach, egzemach, łuszczycy, trądzie, a także w malarii oraz jako środek ogólnie wzmacniający. Brahmi jest jedną z postaci tego leku określaną jako Rasayana (środek odmładzający) lub jako podwyższający inteligencję (Caraca samhta) i wydłużający okres życia (Bhavaprakasha). Dla poprawienia pamięci oraz w zaburzeniach sfery mentalnej stosuje się proszek z wysuszonych liści (w określonych dawkach) z mlekiem (1).
Substancję biologicznie czynną surowca stanowi zespół związków triterpenowych, pochodnych zarówno ursanu (kwas azjatykowy i madekasowy oraz ich estry cukrowe – azjatykozyd i madekasozyd), jak i oleananu (kwas terminolowy i azjatykozyd B) (1, 3).
Z surowca otrzymywane są wyciągi: TECA (titrated extract of Centella asiatica), TTFCA (total triterpenoid fraction of Centella asiatica), TTF (total triterpenic fraction), CATTF (Centella asiatica total terpenic fraction), ETCA (Estratto Titolato di Centella asiatica). Wszystkie wymienione nazwy, jak wynika z danych piśmiennictwa, są różnymi akronimami tego samego ekstraktu, znanego w handlu jako Madecassol (TECA) lub Centellase i Blastoestimulina (TTFCA), zawierającego dodatkowo 40% azjatykozydu i 60% kwasu azjatykowego i madekasowego.
TECA jest oczyszczonym, frakcjonowanym wyciągiem, wzbogaconym we frakcje obu kwasów triterpenowych oraz azjatykozyd (jak wyżej). Proces oczyszczania surowca nie jest uszczegółowiony. Według European Medicines Agency (EMEA) (4) stosowane metody otrzymywania wyciągów nie tylko nie zapewniają stałej jakości uzyskiwanego produktu, lecz również mogą wywierać niekorzystny wpływ na macierzystą (pierwotną) strukturę chemiczną zawartych w nim związków. Ponadto w otrzymanym produkcie finalnym nie jest zachowana naturalna proporcja składników biologicznie aktywnych.
Szeroki wachlarz właściwości biologicznych, potwierdzony wynikami badań (od eksperymentów in vitro do prób klinicznych włącznie), spowodował powszechne zainteresowanie wąkrotą azjatycką. W miarę poszerzania badań chemicznych i biologicznych wyciągów z tej rośliny, prowadzonych powszechnie na świecie, a szczególnie intensywnie w krajach azjatyckich, w piśmiennictwie pojawiają się liczne opracowania przeglądowe, przedstawiające wyniki aktualnych badań, które ogólnie potwierdzają skuteczność wąkroty azjatyckiej w ograniczaniu objawów wielu chorób oraz celowość szerokiego stosowania przetworów z tej rośliny w medycynie ajurwedyjskiej od tysięcy lat (5-11). W dalszym ciągu monografia przetworów z Centella asiatica nie znalazła jak dotąd miejsca w urzędowym lekospisie produktów ziołowych Wspólnoty Europejskiej HMPC (Committee on Herbal Medicinal Products). Pełna dokumentacja, obowiązująca przy publikowaniu poszczególnych monografii w tym lekospisie, opatrzona odnośnym numerem urzędowego biuletynu, wymaga m.in. szczegółowego określenia procesu wytwarzania wyciągu, zapewniającego zachowanie stałej jakości produktu leczniczego.
HMPC w dniu 15 stycznia 2010 roku na posiedzeniu grupy roboczej MLWP (Working Party on Community Monographs and Community List), zajmującej się oceną i spisem monografii, na podstawie obecnych danych wyraziła opinię, zgodnie z wymogami obowiązującymi we Wspólnocie Europejskiej, że ekstrakt TECA nie może być aktualnie zarejestrowany jako preparat ziołowy, ze względu na jego zmienny skład oraz nieznany proces otrzymywania. Z tego powodu, mimo licznych danych piśmiennictwa dotyczących bezpieczeństwa i skuteczności stosowania w różnych chorobach produktów zawierających wyciąg TECA, nie jest możliwe opracowanie monografii dla tego wyciągu, ponieważ wszystkie dotychczasowe dane nie odnoszą się do wyciągu roślinnego (4).
Produkowane na bazie wyciągów z wąkroty azjatyckiej preparaty (np. Medacassol i Analen – mazidła, Alveo – płyn, Varixinal – tabletki i Cicatridine – globulki), obecne w sprzedaży w wielu krajach Wspólnoty Europejskiej: Belgii, Francji, Grecji, we Włoszech, Hiszpanii i Portugalii, również w Polsce, mają status suplementów diety.
Przedsiębiorstwo Produkcji Farmaceutycznej (PPF) Hasco-Lek produkuje preparaty Detocell Cellulit (kapsułki miękkie) oraz Detocell Aqua – suplementy diety przeznaczone dla kobiet ze skłonnością do cellulitu (nieprawidłowego metabolizmu tkanki tłuszczowej) rozmieszczonego w skórze w postaci nieregularnych zgrubień. Preparat Detocell Cellulit zawiera jako substancję czynną, poza olejem rybim (kwasy z grupy omega-3) i olejem z ogórecznika (kwasy omega-6), wyciąg suchy z wąkroty azjatyckiej, wspomagający krążenie obwodowe oraz pobudzający rozwój fibroblastów (najliczniejszych komórek tkanki łącznej właściwej) do syntezy kolagenu, elastyny i kwasu hialuronowego, warunkując właściwe dożywianie i dotlenianie komórek.
Detocell Aqua jest przeznaczony dla kobiet ze skłonnością do cellulitu oraz zatrzymywania wody w organizmie, szczególnie w II fazie cyklu miesiączkowego. Zawiera, poza wyżej wymienionymi olejami wyciągi suche z wąkroty azjatyckiej, morszczynu i korzenia pokrzywy zwyczajnej.
Wykorzystywanie przetworów z wąkroty azjatyckiej do gojenia zmienionej chorobowo struktury skóry (wyprysków, trądziku, oparzeń, odleżyn, wyrównywania zbliznowaceń) jest znane i od dawna stosowane w różnych preparatach dermatologicznych i kosmetycznych. W dostępnym piśmiennictwie, informacje dotyczące badania mechanizmu i leczenia licznych chorób skóry preparatami sporządzonymi na bazie wyciągów z wąkroty azjatyckiej, bądź azjatykozydu, są dość liczne (9, 12-20).
Roślina macierzysta i substancja lecznicza
Centella asiatica (L.) Urban – jest rośliną trwałą, występującą w zwartych skupiskach charakteryzujących się obfitością liści (zielony dywan) lub jako chwast pól uprawnych na dużych przestrzeniach do wysokości 600 m nad poziomem morza. Wykształca długą, pełzającą łodygę, opatrzoną ukorzenionymi węzłami. Z węzłów wyrastają okrągławe, nerkowate lub dłoniaste liście na długich ogonkach, zwykle 5-10 razy dłuższych od blaszki liściowej. U nasady liści wyrastają małe przylistki. Kwiatostanem jest baldach złożony z 1-5 siedzących drobnych kwiatów o barwie od bladoróżowej do czerwonawej. Owocem jest rozłupka o długości do 8 mm. Surowiec jest prawie bezwonny o słabo wyczuwalnym, korzennym smaku. Surowiec pozyskiwany jest przede wszystkim ze stanowisk naturalnych Indii, Sri Lanki, Madagaskaru i Afryki Południowej w okresie całego roku. Zbiór jest suszony powietrznie, na słońcu.
Wąkrota azjatycka pokrojem i składem chemicznym przypomina występującą w Europie wąkrotę zwyczajną (Hydrocotyle vulgaris L.), od której różni się nieco morfologią liści, kwiatostanu oraz owoców.
Szczegółowa monografia rośliny i surowca znajduje się w opracowaniu Hagers Handbuch pharm. Praxis (21).
Chemizm
Triterpenoidy
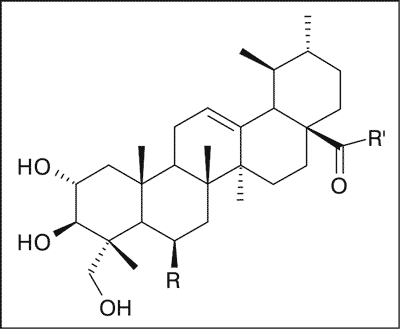
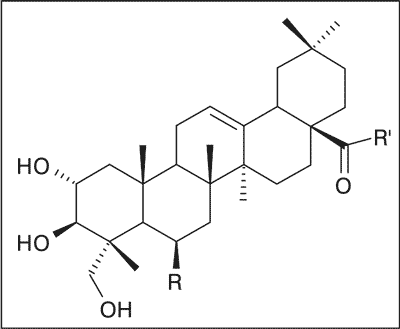
Głównymi składnikami chemicznymi ziela wąkroty azjatyckiej, prawdopodobnie odpowiedzialnymi za wielokierunkowe działanie biologiczne surowca, są pięciocykliczne triterpenowe kwasy pochodne ursanu: azjatykowy i 6-hydroksyazjatykowy (madekasowy) oraz ich estry cukrowe (pseudosaponiny), wśród których przeważają ilościowo dwa związki: azjatykozyd i madekasozyd; oraz pochodne oleananu – kwas terminolowy i jego tricukrowy ester – azjatykozyd B (ryc. 1). W mniejszych ilościach występują izomeryczne oligoglikozydy triterpenowe typu ursanu – centellasaponozydy B, C i D.
 |  |
| Pochodne ursanu | Pochodne oleananu |
R = H, R’ = OH – Kwas azjatykowy
R = OH, R’ = OH – Kwas madekasowy
R = H, R’ = O-glu-glu-ram – Azjatykozyd
R = OH, R’ = O-glu-glu-ram – Madekasozyd | R = OH, R’ = OH – Kwas terminolowy
R = OH, R’ = O-glu-glu-ram – Azjatykozyd B |
Ryc. 1. Triterpenoidy wąkroty azjatyckiej.
Z ziela wyizolowano i zidentyfikowano ponadto dalsze triterpenoidy pochodne ursanu i oleananu, a mianowicie kwasy: ursolowy (i jego lakton), betulinowy, bramikowy, centelikowy, tankunikowy oraz bramozyd, braminozyd, tankunizyd i in. (21, 22).
Stwierdzono przy tym, że skład chemiczny wąkroty azjatyckiej jest zróżnicowany w zależności od miejsca występowania rośliny, np. w Indiach stwierdzono obecność 5 różnych odmian chemicznych, zawierających w większości kwas azjatykowy i madekasowy oraz ich pochodne. W Chinach i na Madagaskarze natomiast występują rasy chemiczne Centella asiatica zawierające głównie pochodne kwasu madekasowego. Zaobserwowano również, że zawartość procentowa czterech podstawowych związków frakcji triterpenowej: kwasów (azjatykowego, madekasowego) oraz azjatykozydu i madekasozydu, w wyciągach wodnych i alkoholowych (ekstrahowanych z upraw polowych) różni się znacznie w zależności od ekotypu (23). Podobnie, zawartość całej frakcji triterpenoidowej w zielu waha się, w zależności od miejsca zbioru, w granicach od 1-8% (21).
Schaneberg i wsp. (3) dostosowali metodę wysokosprawnej chromatografii cieczowej (HPLC) do oznaczania zawartości bioskładników frakcji triterpenowej w ekstrakcie metanolowym z Centella asiatica oraz w otrzymywanych z surowca produktach handlowych. W badanych mieszaninach autorzy oznaczyli jakościowo i ilościowo, poza czterema znanymi pochodnymi ursanu (kwasami: azjatykowym i madekasowym oraz ich tricukrowymi estrami: azjatykozydem i madekasozydem), dwie pochodne oleananu (kwas terminolowy i azjatykozyd B), obecne w każdej badanej frakcji triterpenowej (ryc. 1). Strukturę dwóch ostatnich składników ustalono po zastosowaniu analiz 1H- i 13C-NMR oraz MS. Wzór strukturalny azjatykozydu przedstawiono na rycinie 2.
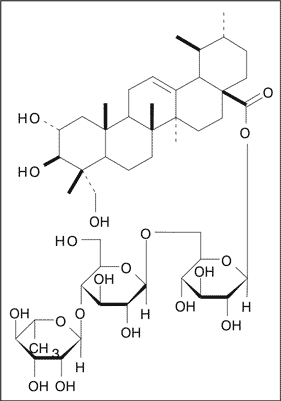
Ryc. 2. Wzór strukturalny azjatykozydu.
W publikowanym opracowaniu Schaneberg i wsp. (3) opisali szczegółowo warunki, w których po 50 min uzyskiwali rozdział i oznaczenie wyżej wymienionych związków w zakresie stężeń do 0,01 μg/ml. Według autorów oznaczenie każdego pojedynczego składnika frakcji triterpenowej jest celowe nie tylko ze względu na dokładniejszą standaryzację surowca, lecz również dla właściwego określenia aktywności każdego badanego preparatu rynkowego. Stosując dostosowaną do zamierzonych analiz metodę HPLC autorzy wykazali bowiem, że badane preparaty handlowe różniły się znacznie składem jakościowym i ilościowym.
Z wcześniejszych opracowań (13) wiadomo, że określona aktywność terapeutyczna wyciągów z ziela wąkroty azjatyckiej wiąże się z obecnością konkretnego składnika frakcji triterpenowej, np. właściwość leczenia trudno gojących się ran przypisuje się przede wszystkim azjatykozydowi, co wykazano w testach modelowych in vitro i in vivo. Związek ten działa ponadto przeciwzapalnie (m.in. w artretyzmie), anksjolitycznie, jako przeciwutleniacz oraz hamuje tworzenie się wrzodów (12, 24, 25). Madekasozyd i kwas madekasowy wykazują działanie przeciwzapalne, bramozyd (także wyciąg zawierający znaczną ilość tego związku) działają uspokajająco, całkowita frakcja triterpenowa działa przeciwdepresyjnie, surowy wyciąg zawierający izotankunizyd i tankunizyd powoduje bezpłodność, natomiast centellozyd i jego pochodne okazały się pomocne w leczeniu nadciśnienia żylnego (1). Jak wynika z przeprowadzonych badań całościowy zespół frakcji nie przedstawia precyzyjnie leku na konkretną chorobę, zwłaszcza gdy procentowa zawartość głównego składnika działającego w mieszaninie nie jest znana. Z tego względu określenie bioaktywnych substancji frakcji triterpenowej w ekstraktach z C. asiatica ma, wg Schaneberga (3), istotne znaczenie dla zapewnienia deklarowanego działania, skuteczności i powtarzalności preparatów sporządzanych z tego surowca.
Ostatnio Tassanawat i wsp. (26) opisali przystosowanie dwóch biologicznych testów: ELISA (enzyme-linked immunosorbent assay) oraz Eastern blotting (biochemiczną metodę opartą na analizie białek i najczęściej używaną do wykrywania epitopów cukrowych) do ilościowego oznaczania dwóch głównych triterpenowych estrów cukrowych: azjatykozydu (AS) i madekasozydu (MA) w wyciągach z Centella asiatica. Autorzy wykorzystali do tego celu wytwarzanie przeciwciała poliklonalnego w odniesieniu do madekasozydu (MA-Pab). Otrzymany MA-Pab okazał specyficzność wobec MA i AS. Opracowane metody wykazują dobrą swoistość, dokładność i zgodność z metodą HPLC oraz umożliwiają szybkie i proste wykonanie oznaczenia zawartości triterpenowych estrów cukrowych w materiale roślinnym.
Flawonoidy
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Sushma T, Sangeeta G, Gambir IS. Centella asiatica: a concisse drug review with probable clinical uses. J Stress Physiol Biochem 2011; 7:39-44. 2. Jamil SS, Nizami Q, Salam M. Centella asiatica (Linn.) Urban. A review. Natur Prod Radiance 2007; 6(2):158-70. 3. Schaneberg BT, Mikell JR, Bedir E i wsp. An improved HPLC method for quantitative determination of six terpenes in Centella asiatica extracts and commercial products. Pharmazie 2003; 58(6):381-4. 4. European Medicines Agency (EMEA) 2010. 5. Centella asiatica Monograph Altern Med Rev 2007; 12(1):69-72. 6. Chong NJ, Aziz Z. A systematic review of the efficacy of Centella asiatica for improvement of the signs and symptoms of chronic venous insufficiency (Review). Evid-Based Complement Altern Med 2013; p.2013: article number 627182. 7. Sarris J, McIntyre E, Camfield DA. Plant-based medicines for anxiety disorders, Part I: a review of preclinical studies. CNS Drugs 2013; 27(3):207-19. 8. Sarris J, McIntyre E, Camfield DA. Plant-based medicines for anxiety disorders, Part II: a review of clinical studies with supporting preclinical evidence (Review). CNS Drugs 2013; 27(4):301-19. 9. Brinkhaus B, Lindner M, Schuppan D i wsp. Chemical, pharmacological and clinical profile of the East Asian medical plant Centella asiatica. Phytomed 2000; 7(5):427-48. 10. Król D. Wąkrota azjatycka (Cetella asiatica (L.) – właściwości lecznicze. Post Fitoter 2010; 2:101-5. 11. Seevaratnam V, Banumathi P, Premalatha MR i wsp. Functional properties of Centella asiatica (L.): A review. Int J Pharm Pharmaceut Sci 2012; 4(Suppl. 5):8-14. 12. Kimura Y, Sumiyoshi M, Samukawa K-I i wsp. Facilitating action of asiaticoside at low doses on burn wound repair and its mechanism. Eur J Pharmacol 2008; 584:415-23. 13. Shukla A, Rasik AM, Jain GK i wsp. In vitro and in vivo wound healing activity of asiaticoside isolated from Centella asiatica. J Ethnopharmacol 1999; 65:1-11. 14. Mackay D, Miller AL. Nutritional support for wound healing. Altern Med Rev 2003; 8:359-77. 15. Maquart FX, Chastang F, Simeon A i wsp. Triterpenes from Centella asiatica stimulate extracellular matrix accumulation in rat experimental wounds. Eur J Dermatol 1999; 9(4):289-96. 16. Maquart FX, Bellon G, Gillery P i wsp. Stimulation of collagen synthesis in fibroblast cultures by a triterpene extracted from Centella asiatica. Connect Tissue Res 1990; 24:107-20. 17. Kataranovski M, Magic Z, Pejnovic N. Early inflammatory cytokine and acute phase protein response under the stress of termal injury in rats. Physiol Res 1999; 48:473-82. 18. Atavilla D, Saitta A, Cucinotta D i wsp. Inhibition of lipid peroxidation restores impaired vascular endothelial growth factor expression and stimulates wound healing and angiogenesis in the genetically diabetes mouse. Diabetes 2001; 50:667-74. 19. Wyk B-E, Wink M: Rośliny lecznicze świata. MedPharm Polska, Wrocław 2008; 90. 20. Lamer-Zarawska E, Kowal-Gierczak B, Niedworok J. Fitoterapia i leki roślinne. PZWL Warszawa 2000; 431-2. 21. Hansel R, Keller K, Rimpler R i wsp. Centella asiatica. [W:] Hagers Handbuch der Pharmazeutischen Praxis. 5 Auflage, B.4, Springer Vrl. Berlin, Heidelberg, New York 1992. 22. Matsuda H, Morikawa T, Ueda H, Yoshikawa M. Medicinal foodstaffs. XXVII. Saponins constituents of Gotu Kola (2): structures of new ursane- and oleanane-type triterpene oligoglycosides, centellasaponins B, C and D from Centella asiatica cultivated in Sri Lanka. Chem Pharm Bull 2001; 49:1368-71. 23. Randriamampionona D, Diallo B, Rakotoniriana F i wsp. Comparative analysis of active constituents in Centella asiatica samples from Madagaskar: application for ex situ conservation and clonal propagation. Fitoterapia 2007; 7-8:482-9. 24. Liang X, Huang YN, Chen SW i wsp. Antidepressant-like effect of asiaticoside in mice. Pharmacol Biochem Behav 2008; 3:444-9. 25. Liu M, Dai Y, Yao X i wsp. Anti-rheumatoid arthritic effect of madecassoside on type II collagen-induced arthritis in mice. Int Immunopharmacol 2008; 11:1561-6. 26. Tassanawat P, Putalum W, Yusakul G i wsp. Production of polyclonal antibody against madecassoside and development of immunoassay methods for analysis of triterpene glycosides in Centella asiatica. Phytochem Anal 2013; 24:256-62. 27. Hiller K. Isolierung von Quercetin 3-O-(6-O-alfa-L-arabinopyranosyl)-beta-D-galaktopyranosid aus Hydrocotyle vulgaris L. Pharmazie 1979; 34:192-3. 28. Centella asiatica Monograph. Altern Med Rev 2007; 12(1):69-72. 29. Yoshida M, Fuchigami M, Nagao T i wsp. Antiproliferative constituents from Umbelliferae plants. VII. Active triterpenes and rosmarinic acid from Centella asiatica. Biol Pharm Bull 2005; 28(1):173-5. 30. Farmakopea Polska IX T1. 2011; 359-61. 31. Physicians Desk Reference for Herbal Drugs. Medical Economics Company Montvale, New Yersey 2000; 359-61. 32. ESCOP Monographs (European Scientific Cooperative on Phytotherapy) Second Ed. Suplement 2009; 36-44. 33. Centella – Centellae asiaticae herba. European Pharmacopoeia, Council of Europe. 34. Suguna L, Sivakumar P, Chandrakasan G. Effect of Centella asiatica extract on dermal wound healing in rats. Indian J Exp Biol 1996; 34:1208-11. 35. Shetty BS i wsp. Effect of Centella asiatica L. (Umbelliferae) on normal and dexamethasone-suppressed wound healing in rats. Int J Low Extrem Wounds 2006; 5:137-43. 36. Sunilkumar I, Parameshwaraiah S, Shivakumar HG. Evaluation of topical formulations of aqueous extract of Centella asiatica on open wounds in rats. Indian J Exp Biol 1998; 36(6):569-72. 37. Shetty BS, Pemmineti S. Evaluation of Centella asiatica leaf extract for wound healing in streptozotocin induced diabetic rats. Res J Pharm,Biol Chem Sci 2013; 4:1082-90. 38. Sairam K, Rao CV, Goel RK. Effect of Centella asiatica L. on physical and chemical factors induced gastric ulceration and secretion in rats. Indian J Exp Biol 2001; 39:137-42. 39. Cheng CL, Koo MW. Effects of Centella asiatica on ethanol induced gastric mucosal lesions in rats. Life Sci 2000; 67:2647-53. 40. Incandela I, Cesarone MR, Cacchio M i wsp. Effects of the total triterpenic fraction of Centella asiatica in chronic venous insufficiency and in high-perfussion microangiopathy. Angiology 2001; 52(Suppl. 2):9-13. 41. Incandela L, Belcaro G, Cesarone MR i wsp. Treatment of diabetic microangiopathy and edema with total triterpenic fraction of Centella asiatica: a prospective, placebo-controlled randomized study. Angiology 2001; 52(Suppl. 2):27-31. 42. De Sanctis MT, Belcaro G, Incandela L i wsp. Treatment of edema and increased capillary filtration in venous hypertension with total triterpenic fraction of Centella asiatica: a clinical prospective randomized trial with a microcirculatory model. Angiology 2001; 52(Suppl. 2):55-9. 43. Cesarone MR, Belcaro G, Rulo A i wsp. Microcirculatory effects of total triterpenic fraction of Centella asiatica in chronic venous hypertension: measurement by laser Doppler, TcPO2-CO2, and leg volumetry. Angiology 2001; 52(Suppl. 2):45-8. 44. Cesarone MR, Belcaro G, De Sanctis MT i wsp. Effects of the total triterpenic fraction of Centella asiatica in venous hypertensive microangiopathy: a prospective, placebo-controlled, randomized trial. Angiology 2001; 52(Suppl. 2):15-8. 45. Cesarone MR, Incandela I, De Sanctis MT i wsp. Evaluation of treatment of diabetic microangiopathy with total triterpenic fraction of Centella asiatica: a clinical prospective randomized trial with microcirculatory model. Angiology 2001; 52(Suppl. 2):49-54. 46. Bylka W, Znajdek-Awiżeń P, Studzińska-Sroka E i wsp. Centella asiatica in cosmetology. Post Dermatol Alergol 2013; 30(1):46-9. 47. Arpaia MR, Ferrone R, Amitrano P. Effect of Centella asiatica extract on mucopolisaccharide metabolism in subjects with varicose veins. Int J Clin Pharmacol Res 1990; 10:229-33. 48. Garcia Hernandez JA, Madera Gonzalez D, Padilla Castillo M. Use of specific anti-stretch mark cream for preventing or reducing the severity of striae gravidarum. Randomized, double-blind controlled trial. Intern J Cosm Sci 2013; 35:233-7. 49. Christopher D, Hashim CP, Ali JM i wsp. Gene expression changes in the human fibroblast induced by Centella asiatica triterpenoids. Planta Med 2003; 69:725-32. 50. Sakina MR, Dandiya PC. A psychoneuropharmacological profile of Centella asiatica extract. Fitoterapia 1990; 61:291-6. 51. Subathra M, Shila S, Devi MA i wsp. Emerging role of Centella asiatica in improving age-related neurological antioxidant status. Exp Gerontol 2005; 40(8-9):707-15. 52. Ramanathan M, Sivakumar S, Anandvijayakumar PR i wsp. Neuroprotective evaluation of standardized extract of Centella asiatica in monosodium glutamate treated rats. Indian J Exp Biol 2007; 45(5):425-31. 53. Lee MK, Kim SR, Sung SH i wsp. Asiatic acid derivatives protect cultured cortical neurons from glutamate-induced excitotoxicity. Res Commun Mol Pathol Pharmacol 2000; 108 (1-2):75-86. 54. Nalini K, Aroor AR, Karanth KS i wsp. Effect on Centella asiatica fresh leaf aqueous extract on learning and memory and biogenic amine turnover in albino rats. Fitoterapia 1992; 3:232-7. 55. Veerendra Kumar MH, Gupta YK. Effect of Centella asiatica on cognition and oxidative stress in an intracerebroventricular streptozotocin model of Alzheimer’s disease in rats: Clin Exper Pharmacol Physiol 2003; 30(5-6):336-42. 56. Veerendra Kumar MH, Gupta YK. Effect of different extracts of Centella asiatica on cognition and markers of oxidative stress in rats. J Etnopharmacol 2002; 79(2):253-60. 57. Mook-Jung I, Shin JE, Yun S i wsp. Protective effects of asiaticoside derivatives against beta-amyloid neurotoxicity. J Neurosci Res 1999; 58(3):417-25. 58. Rao SB, Chetana M, Uma Devi P. Centella asiatica treatment during postnatal period enhances learning and memory in mice. Physiol Behav 2005; 86(4):449-57. 59. Mohandas Rao KG, Muddanna Ra, Gurumadhava Rao S. Centella asiatica (L.) leaf extract treatment during the growth spur period enhances hippocampal CA3 neuronal dendritic arborization in rats. Evid-Based Complement Alternat Med 2006; 3:349-57. 60. Soumyanath A, Zhong YP, Gold SA i wsp. Centella asiatica accelerates nerve regeneration upon oral administration and contains multiple active fractions increasing neurite elongation in vitro. J Pharm Pharmacol 2005; 57:1221-9. 61. Chen Y, Han T, Rui Y i wsp. Effect of total triterpenes from Centella asiatica on the depression behaviour and concentration of amino acids in forced swimming mice. Zhong Yao Cai 2003; 26(12):870-3 (cyt. za 2). 62. Wijeweera P, Armason JT, Koszycki D i wsp. Evaluation of anxiolytic properties of Gotu Kola – (Centella asiatica) extracts and asiaticoside in rat behavioral models. Phytomed 2006; 13(9-10):668-76. 63. Orhan IE, Atasu E, Senol FS i wsp. Comparative studies on Turkish and Indian Centella asiatica (L.) Urban (Gotu kola) samples for their enzyme inhibitory and antioxidant effects and phytochemical characterization. Ind Crops Prod 2013; 47:316-22. 64. Kędzia B, Bobkiewicz-Kozłowska T, Furmanowa M i wsp. Badania nad właściwościami biologicznymi wyciągów z ziela Centella asiatica (L.) Urban. Herba Pol 2007; 53:34-44.



