Stanisław Wroński
Śródmiąższowe zapalenie pęcherza moczowego. Etiologia, diagnostyka, leczenie
Interstitial cystitis. Etiology, diagnosis, treatment – a review
z Oddział Urologii, SPZOZ Szpital Wojewódzki im. dr. J. Biziela w Bydgoszczy
Ordynator Oddziału: dr n. med. P. Jarzemski
Regionalny Bank Tkanek, SPZOZ Szpital Wojewódzki im. dr. J. Biziela w Bydgoszczy

Spośród wielu chorób układu moczowego jednostką o najbardziej niejasnej etiologii i trudną do zdiagnozowania jest śródmiąższowe zapalnie pęcherza moczowego (cystitis interstitialis, interstitial cystitis – IC). Pierwszy opis choroby podał w 1915 roku G. Hunner (11) przedstawiając przypadek 8 kobiet z wieloletnimi dolegliwościami bólowymi w okolicy nadłonowej, uczuciem bolesnego parcia na mocz, częstym oddawaniem moczu w ciągu dnia oraz w nocy. Cystoskopowo zaobserwował u tych pacjentek zmiany błony śluzowej pęcherza o typie linijnych ubytków a nawet głębokich owrzodzeń. Zmiany te nazwane jego imieniem (wrzód Hunnera) uznano za patognomoniczne dla tego schorzenia (6, 8). Obraz kliniczny tworzy przewlekły zespół objawów dolnych dróg moczowych polegających na uczuciu bolesności w okolicy nadłonowej, częstym oddawaniu moczu, parciach naglących (6). Objawy te w ogólnym zarysie przypominają zapalenie pęcherza moczowego wywołane zakażeniem dróg moczowych lub innym czynnikiem uszkadzającym strukturę ściany pęcherza moczowego jak np. naświetlania czy też cytostatyki (głównie cyklofosfamid).
Rutynowo przeprowadzane badania moczu jak ogólne badanie moczu, posiew nie wykazują istnienia czynnika etiologicznego. Badanie cytologiczne nie wykazuje istnienia jakiejkolwiek patologii. Skargi podawane przez pacjentki (gdyż jak się ocenia schorzenie dotyczy w 90% kobiet) sugerują zmiany zapalne (5, 6, 8). Objawy trwają od dłuższego czasu i nie ustępują po stosowanym dotychczas leczeniu. Nie ma chyba urologa, do którego nie zawita od czasu do czasu pacjentka trzymająca w ręku listę wszelkich leków stosowanych w leczeniu bakteryjnego zapalenia pęcherza, plik wyników wykonanych badań, wymieniająca szereg gabinetów, w których dotychczas w swoim mniemaniu była nieskutecznie leczona. Jak należy się obawiać i w naszym przypadku szansa pomocy nie jest zbyt wysoka. Znamienne dla tego schorzenia jest stwierdzenie Bensona: „...wolę mówić pacjentom: wierzę, że masz takie objawy, nie wiem co jest ich przyczyną ale zrobię wszystko, abyś poczuł się lepiej” (8).
Badania epidemiologiczne wskazują, iż schorzenie to jest znacznie częstsze niż rozpoznawane klinicznie. Oravisto (6, 8) badając populację Helsinek stwierdził występowanie schorzenia na 18,1/100 000 kobiet (10,6 w łącznej populacji) i 1,2 nowych przypadków na 100 000 kobiet/rok. Badania przeprowadzone przez Ph. Helda i Ph. Hanno (6, 9) wykazały dwa razy większą częstość występowania śródmiąższowego zapalenia pęcherza w USA. Bezpośrednie i pośrednie koszty związane z leczeniem wynoszą ok. 500 mln dolarów. W oparciu o kwestionariusze pytań badacze ci ocenili podawaną przez pacjentki jakość życia (QoL) jako znacznie niższą niż podawaną przez pacjentki w schyłkowym stadium niewydolności nerek. Być może fakt ten rzuca pewne światło na wpływ czynnika psychicznego na stopień odczuwania objawów IC (6).
W celu opracowania jednolitych kryteriów diagnostycznych pozwalających na rozpoznanie śródmiąższowego zapalenia pęcherza moczowego w roku 1987 w Maryland odbyły się warsztaty przeprowadzone przez National Institute of Artritis, Diabetes, Digestive and Kidney Diseases. Opracowane wytyczne pozwalają na łatwiejszą i skuteczniejszą diagnostykę i wyodrębnienie pacjentów, którzy dotychczas mogli być nieskutecznie leczeni z rozpoznaniem innych chorób o podobnych do IC objawach (5).
Podkreślić należy, iż rozpoznanie śródmiąższowego zapalenia pęcherza opiera się na wykluczeniu innych schorzeń jak: carcinoma in situ, przewlekłego zapalenia pęcherza na tle bakteryjnym, gruźliczego zapalenia pęcherza, czy też rzadko spotykanych zapaleń – alergicznego, eozynofilowego, cystitis cystica, ziarniniakowego (5, 6, 8).
Podstawowym kryterium diagnostycznym (po wykluczeniu ww. schorzeń) jest stwierdzenie tzw. wrzodu Hunnera lub drobnych rozsianych wybroczyn krwawych na powierzchni błony śluzowej pęcherza moczowego występujących po wypełnieniu dwukrotnym pęcherza pod ciśnieniem ok. 100 cmH2O trwającym 2 min. Zabieg należy wykonywać w znieczuleniu ogólnym. Wybroczyny muszą występować w przynajmniej 3 kwadrantach pęcherza w liczbie minimum 10 na kwadrant przy czym nie należy brać pod uwagę zmian położonych wzdłuż drogi wprowadzenia cystoskopu (5, 6, 8). Wrzód Hunnera może przybierać postaci od linijnych ubytków błony śluzowej po nieregularne krwawiące obszary błony śluzowej blednące w miarę wypełniania pęcherza. Może występować w każdym obszarze nie wyłączając trójkąta, najczęściej ma długość do 2 cm i różne zabarwienie od białego po brązowe (6, 12, 22). Zmiana ta stwierdzana jest jedynie w najcięższych postaciach zapalenia, częstość występowania wynosi ok. 5% (6). Stwierdzenie w badaniu cystoskopowym opisywanych zmian (wybroczyny, charakterystyczne owrzodzenie) pozwala na rozpoznanie śródmiąższowego zapalenia pęcherza. Prócz tego wyodrębniono tzw. czynniki pozytywne rozpoznania choroby, obejmujące subiektywne odczucia pacjenta – ból towarzyszący wypełnieniu pęcherza ustępujący natychmiast po mikcji oraz bóle w okolicy nadłonowej, kroczowej, pochwie lub cewce moczowej (6, 8).
Jak wspomniano poprzednio rozpoznanie IC jest oparte głównie na wykluczeniu innych, o znanej etiologii, patologii pęcherza moczowego bądź miednicy mniejszej (tzw. diagnoza z wykluczenia). Rozpoznanie śródmiąższowego zapalenia pęcherza wyklucza stwierdzenie następujących danych (5, 6, 8):
– Wiek pacjenta poniżej 18 lat.
– Pojemność pęcherza większa od 350 ml.
– Brak uczucia parcia na mocz przy wypełnieniu pęcherza 150 ml płynu (szybkość wypełniania 30-100 ml/min) i stwierdzenie mimowolnych skurczów pęcherza w trakcie takiego badania.
– Oddawanie moczu w ciągu dnia mniej niż 5/12 godzin oraz brak nocnego oddawania moczu (lub mniej niż 2x).
– Stwierdzenie zmian popromiennych, gruźliczych, chemicznych pęcherza moczowego.
– Infekcja dolnych dróg moczowych w ciągu ostatnich 3 miesięcy.
– Ustępowanie objawów po leczeniu przeciwbakteryjnym, lekami rozkurczowymi.
– Zmiany nowotworowe pęcherza moczowego, cewki moczowej.
– Nowotwory narządów płciowych.
– Kamica dolnych dróg moczowych.
– Zapalenie narządów płciowych bakteryjne i wirusowe.
– Uchyłki cewki moczowej.
W ciągu ostatnich 10 lat tj. od momentu opracowania wspomnianych kryteriów rozpoznania IC gwałtownie wzrosła liczba nowych przypadków, a co za tym idzie, liczba pacjentów. Osoby leczone z powodu IC od paru lat stanowią pewien lobbing w USA i tworząc Interstitial Cystitis Association (założone m. in. przez lekarza leczonego z powodu rozpoznanego śródmiąższowego zapalenia pęcherza) stanowią grupę nacisku, która wymusiła na FDA podjęcie działań w kierunku poprawy skuteczności leczenia choroby (6, 8).
Za Messingiem (15) śródmiąższowe zapalenie pęcherza można jednym zdaniem opisać jako triadę następujących cech klinicznych: występowanie objawów podrażnieniowych ze strony dolnych dróg moczowych z charakterystycznym obrazem cystoskopowym przy braku obiektywnie stwierdzanych przyczyn. Jedną z charakterystycznych cech klinicznych tego schorzenia jest podawany przez pacjentów nagły początek, spontaniczne remisje trwające średnio ok. 8 miesięcy. Choroba szybko osiąga pewien określony, stały dla danego pacjenta poziom nasilenia dolegliwości, na którym stabilizuje się na długi czas. Bardzo rzadko spotykane jest pogarszanie objawów (8). Chorzy podają częste infekcje dróg moczowych w dzieciństwie (10x częściej niż w grupie kontrolnej). U ponad 40% pacjentów stwierdzane są alergie oraz choroby autoimmunologiczne jak toczeń rumieniowaty (LE) występujący w tej grupie pacjentów 30-50x częściej niż w całej populacji (a chorób zapalnych jelita grubego nawet 100x) czy zespół Sjogrena, którego wszystkie lub część objawów wykazano u 8 z 10 badanych pacjentów (6).
Obraz histopatologiczny
Celem badania mikroskopowego bioptatu błony śluzowej pęcherza moczowego jest wykluczenie śródnabłonkowego raka pęcherza moczowego, gruźliczego zapalenia pęcherza. W mikroskopowym obrazie śródmiąższowego zapalenia pęcherza może nie być żadnych zmian, lecz najczęściej nabłonek urotelialny jest ścieńczały a pod nim widoczne są ogniska krwotoczne (2, 6, 12, 22) (ryc. 1).
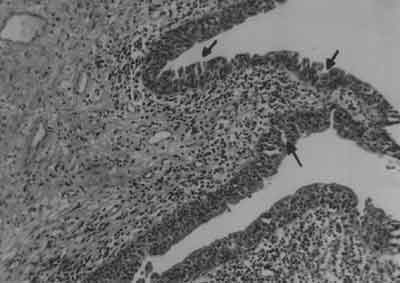
Ryc. 1. Obraz mikroskopowy śródmiąższowego zapalenia pęcherza moczowego. Widoczne miejscowe ubytki nabłonka. Warstwa nabłonka cienka, widoczne miejscowe przerwanie jej ciągłości (czarne strzałki). Pod nabłonkiem nacieki zapalne, poszerzone naczynia krwionośne o pogrubiałej ścianie. Początki procesu włóknienia. (Powiększenie 100x, barwienie H-E).
Stwierdzany jest obrzęk lub zwłóknienie blaszki właściwej błony podstawnej (lamina propria), poszerzenie położonych pod nabłonkiem włosowatych naczyń krwionośnych, których ściana ulega pogrubieniu. W bardziej zaawansowanych stadiach obserwowane jest pojawianie się zmian włóknistych w obrębie błony mięśniowej (czasami prowadzące do jej zwłóknienia). W obrębie lamina propria i w obrębie mięśniówki występują nacieki limfocytarne, komórek plazmatycznych, komórek kwasochłonnych i z komórek tucznych. Obecność tych ostatnich stanowi ważne kryterium diagnostyczne. Wykazanie 20 komórek tucznych na 1 mm2 stanowi czynnik potwierdzający rozpoznanie IC i może stanowić niejako marker tej choroby (22). Cechą charakterystyczną są również nacieki wokół włókien nerwowych występujących w ścianie pęcherza. W najcięższej postaci – wrzodzie Hunnera widoczny jest brak nabłonka, a naciek komórek zapalnych obejmuje wszystkie warstwy ściany pęcherza (pancystitis). Doniesiono o odkładaniu się w błonie śluzowej i podśluzowej cząsteczek immunoglobulin IgA a także wykazano obecność w części przypadków śródmiąższowego zapalenia pęcherza w obrębie błony śluzowej depozytów glikoproteiny Tamm-Horsfalla (4, 16, 22).
Obraz histopatologiczny zbliżony do IC stwierdzić można w owrzodzeniach śluzówki pęcherza oraz w trakcie gojenia np. po biopsji (12).
Etiologia
Charakterystyczne cechy struktury nabłonka pęcherza moczowego
Jak wspomniano do chwili obecnej nie potrafimy wyjaśnić etiologii tego schorzenia. Dane kliniczne i histologiczne wskazują na różne zmiany w obrębie ściany pęcherza moczowego. Nie wiadomo dokładnie które z nich są pierwotnymi, a które wtórnymi. Wielość i niejednoznaczność stwierdzanych zmian patologicznych w obrębie pęcherza moczowego są źródłem wielu teorii mających wyjaśnić przyczynę choroby. Być może przedstawienie budowy i funkcji ściany pęcherza moczowego pomoże w wyjaśnieniu źródła objawów i ewentualnych przyczyn IC.
Wewnętrzną ścianę pęcherza moczowego stanowi błona śluzowa. W pęcherzu nie wypełnionym jest ona silnie pofałdowana dzięki temu, że leży na wiotkiej błonie podśluzowej. W trakcie wypełniania pęcherza fałdy ulegają rozciągnięciu pozwalając na adaptację ściany stosownie do wzrostu pojemności. Najbardziej zewnętrzną warstwą błony śluzowej jest specyficzny nabłonek dróg moczowych (urothelium) zwany nabłonkiem przejściowym. Nazwa wywodzi się stąd, iż morfologicznie stanowi on jakby formę pośrednią między nabłonkiem jednowarstwowym a wielowarstwowym płaskim. Ilość warstw komórek jest zmienna, zależna także od stanu rozciągnięcia pęcherza moczowego, waha się od 3 do 7 warstw komórek. Jak w przypadku innych nabłonków komórki leżą na błonie podstawnej. W obrębie tego nabłonka wyraźnie zaznaczają się trzy strefy. Z błoną podstawną styka się bezpośrednio strefa podstawowa złożona z jednej warstwy małych cylindrycznych komórek (w pęcherzu obkurczonym i płaskich w rozciągniętym), z których po kolejnych podziałach powstają komórki potomne tworzące bardziej powierzchowne warstwy. Warstwa pośrednia złożona jest z 4-5 warstw dużych komórek w pęcherzu rozciągniętym i 6-7 obkurczonym. Komórki te możliwość ślizgania się względem siebie zawdzięczają temu, iż na ich błonie komórkowej występuje cienka warstwa związków zwanych glikozoaminoglikanami tworzącymi jakby film umożliwiający przesuwanie się względem siebie powierzchni sąsiadujących komórek (2, 3, 8, 12, 22) (ryc. 2).

Ryc. 2. Obraz mikroskopowy prawidłowej ściany pęcherza moczowego. Wyraźnie widoczne trzy strefy nabłonka: 1. powierzchowna („umbrella cells”), 2. pośrednia, 3. podstawna. Nabłonek o ciągłej nieuszkodzonej strukturze. (Powiększenie 150x, barwienie H-E).
Najistotniejsza dla prawidłowego funkcjonowania ściany pęcherza jako bariery jest strefa powierzchowna (12, 17, 18, 19). Komórki tworzące tę strefę posiadają kilka unikalnych cech nie spotykanych w innych tkankach i być może dzięki ich wyjątkowości nabłonek urotelialny stanowi tak szczelną granicę dla składników moczu. Mocz docierający do pęcherza ze względu na zawartość wielu substancji m. in. mocznika, soli, białek stanowi roztwór hipertoniczny. Ciśnienie osmotyczne moczu jest – zależnie od stopnia nawodnienia pacjenta – 2 do 4 razy większe od panującego w kapilarach błony podśluzowej pęcherza (8). Gdyby więc nabłonek przejściowy był przepuszczalny dla wody, to dochodziłoby do jej ucieczki z naczyń oraz z drugiej strony przenikania w głąb ściany toksycznych składników moczu. W prawidłowych warunkach nie obserwujemy tego zjawiska. Za szczelność powierzchownej warstwy nabłonka odpowiadają w równym stopniu czynniki fizyczne, chemiczne oraz morfologiczne komórek. Zachwianie jednego z tych czynników może stanowić przyczynę objawów zaliczanych do śródmiąższowego zapalenia pęcherza moczowego (6, 17, 18, 19).
Komórki tworzące warstwę powierzchowną mają strukturę dużych, spłaszczonych, sześciokątów. Najczęściej mają po dwa jądra komórkowe (czasami więcej), gdyż powstają ze zlania sąsiadujących komórek. Twór taki nazywamy syncytium. Nazywane są też komórkami baldaszkowatymi, ponieważ jak baldachim pokrywają komórki głębszej warstwy (2, 3, 12).
Błona komórkowa od strony światła pęcherza moczowego jest grubsza od pokrywającej pozostałą część powierzchni komórki. W jej obrębie wykazano istnienie specyficznych odcinków o miseczkowatym kształcie, wklęsłością skierowanych na zewnątrz, a łącząc się z cieńszymi fragmentami błony powodują jej kątowe, charakterystyczne dla urotelium zagięcie. Segmenty te nazywane są błonami asymetrycznej budowy (AUM – asymetric unit membrane), gdyż część zewnętrzna jest grubsza niż wewnętrzna (2, 3) (ryc. 3).
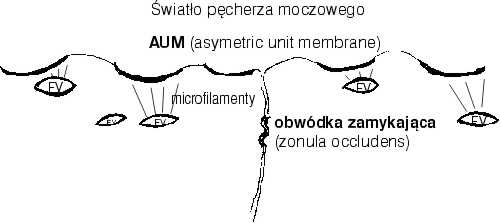
Ryc. 3. Schematyczne przedstawienie skierowanej do światła pęcherza moczowego błony komórkowej komórek warstwy powierzchownej nabłonka przejściowego. AUM – asymetric unit membrane, FV – fusiform vesicles (pęcherzyki w cytoplazmie komórkowej stanowiące prawdopodobnie depozyty podjednostek AUM). (wg. Contran R.S. et al.: Lower urinary tract [W:] Robbins Pathologic Basis of Disease. W.B. Saunders 1989).
Dzięki mikroskopii elektronowej wykazano, że obszary AUM zbudowane są z wielu podjednostek, z których każda jest złożona z 6 mniejszych elementów ułożonych w kształcie gwiazdy (ryc. 4).

Ryc. 4. Schemat przedstawiający budowę segmentu AUM, oraz schematyczne przedstawienie struktury jego podjednostek (heksamerów). (Wg. Fawcett W.: Bloom and Fawcett A textbook of histology, Chapm. & Hall, N.Y., 1994).
Tuż pod błoną komórkową w okolicach AUM występuje gęsta sieć włókien – tzw. mikrofilamentów. Tworzą one wiązki łączące się z segmentami AUM. Końce cytoplazmatyczne mikrofilamentów zbiegają się i łączą z kolejną unikalną strukturą komórki urotelium. Otóż zaobserwowano istnienie w przylegających do omawianej powierzchni błony komórkowej warstwach cytoplazmy dyskoidalnych pęcherzyków (wrzecionowatych na przekroju, FV – fusiforme vesicles). Błona otaczająca te pęcherzyki ma strukturę identyczną jak segmentów AUM (2, 3). Prawdopodobnie pęcherzyki te są plazmatycznymi depozytami zewnętrznej błony komórkowej. Gdy pęcherz ulega obkurczeniu, maleje również powierzchnia urotelium tak poprzez jej sfałdowanie jak i zmniejszenie powierzchni nabłonka. Komórki baldaszkowate zmniejszają swoją powierzchnię skierowaną do światła pęcherza moczowego prawdopodobnie w ten sposób, iż opisane poprzednio mikrofilamenty kurcząc się wciągają do środka komórki segmenty AUM redukując tą drogą chwilowy „nadmiar” błony komórkowej. W miarę wypełniania pęcherza moczowego pęcherzyki te ulegają rozerwaniu i jako płaskie struktury wbudowywane są do zewnętrznej powierzchni błony komórkowej (2, 3). Być może uszkodzenie mechanizmu transportującego segmenty AUM może odpowiadać za rozwój objawów śródmiąższowego zapalenia pęcherza moczowego, gdyż uniemożliwiając odpowiednie pokrycie powierzchni pęcherza doprowadzają do penetracji jego głębszych warstw przez składniki moczu.
Powierzchnia nabłonka przejściowokomórkowego pokryta jest cienką warstwą specyficznych związków organicznych zwanych glikozoaminoglikanami (6, 8, 17-19). Podobna warstwa, nazywana warstwą powierzchniową występuje w strefie pośredniej urotelium. Pokrywa ona poszczególne komórki i umożliwia wzajemne ślizganie się, dzięki czemu mogą one zmieniać swe ułożenie w trakcie wypełniania pęcherza.
Glikozoaminoglikanom przypisywana jest istotna rola w zabezpieczeniu powierzchni ściany pęcherza przed szkodliwym wpływem składników moczu. Uniemożliwiają one przyleganie do komórek nabłonka i infiltrację ściany przez mikrokryształy, białka, bakterie, a nawet komórki nowotworowe. Mają więc działanie przeciwbakteryjne, przeciwnowotworowe i zapobiegają tworzeniu się kamieni moczowych (6, 8, 17-19). Właściwości te zawdzięczają wiązaniu cząsteczek wody na swej powierzchni. Właśnie ta warstewka wody tworzy środowisko rozdzielające komórki od hipertonicznego moczu. Cecha ta jest wynikiem specyficznej budowy tych związków. Glikozoaminoglikany to grupa złożonych związków organicznych grających ważną rolę w budowie i funkcji komórki. Wchodzą one w skład błony komórkowej, pełnią m.in. rolę sygnałową, wchodzą także w skład macierzy zewnątrzkomórkowej (13, 17, 18). Są to długie polianionowe łańcuchy złożone z podjednostek dwucukrowych (jedna z nich jest kwasem heksozouronowym druga heksozoaminą) z przyłączonymi grupami siarczanowymi, którym zawdzięczają ujemny ładunek (możliwość wiązania cząsteczek wody wiązaniem jonowym). Wyróżniane są trzy grupy glikozoaminoglikanów:
1. Poliuronidy: GAG bez reszt siarczanowych – np. kwas hialuronowy.
2. Sulfopoliuronidy: GAG zawierające reszty siarczanowe – np. chondroityno- 4-siarczan i 6-siarczan, siarczan dermatanu, siarczan heparanu oraz heparyna.
3. Polisiarczany; GAG zawierające tylko reszty siarczanowe – np. siarczan keratanu.
Prócz glikozoaminoglikanów z 1 grupy wszystkie występują w postaci związanej z rdzeniem białkowym (protein core) związki te nazywamy proteoglikanami. Syntetyzowane są przez komórki nabłonka dróg moczowych. Duża zawartość grup siarczanowych oraz karboksylowych decyduje o ujemnym ładunku GAG. Właśnie dzięki tym polianionowym właściwościom dochodzi do wiązania wiązaniami jonowymi cząsteczek wody i tworzenia specyficznej bariery na powierzchni urotelium. Prócz tego biorą one udział w proliferacji, różnicowaniu komórek, a także wzajemnym rozpoznawaniu np. w trakcie rozwoju embrionalnego i budowie nowych tkanek (np. cząstki adhezyjne) (13). Proteoglikanami sa także niektóre czynniki wzrostu. W warstwie pokrywającej nabłonek pęcherza moczowego występują przedstawiciele każdej z omawianych grup glikozoaminoglikanów.
Kolejnym bardzo istotnym czynnikiem decydującym o integralności nabłonka dróg moczowych i jego funkcjonowaniu jako szczelnej dla składników moczu i wody bariery są specyficzne połączenia pomiędzy komórkami powierzchownej warstwy – komórkami baldaszkowatymi („umbrella cells”). W każdej tkance, w celu zachowania jej struktury, komórki łączą się przy pomocy pewnych cząsteczek występujących na powierzchni błony komórkowej. Dodatkowo sąsiadujace komórki wytwarzają struktury pełniące funkcje uszczelniające przestrzenie pomiędzy sąsiadami, inne tworzą „bramki” umożliwiające przepływ tylko określonych substancji. Na podstawie obrazu w mikroskopie elektronowym wyróżniono połączenia w których błony komórkowe bezpośrednio stykają się ze sobą – połączenia – połączenia zamykające oraz typ, gdzie przestrzeń wynosi 15-35 nm (połączenia typu przylegania – desmosomy). W niektórych tkankach istnieją połączenia komunikacyjne (gap junctions o szer. 2 nm ) np. synapsy. Pomiędzy sąsiadującymi komórkami powierzchownej warstwy urotelium występuje połączenie zwane obwódką zamykającą (tight junctions, zonula occludens). Jest ono tak szczelne, że pozwala na utrzymanie gradientu stężeń jonów. Otacza wokoło całą komórkę. Zonula occludens powstaje ze zlania się – na kształt zamka błyskawicznego – błon komórkowych stykających się komórek i jak obręcz otacza komórkę tworząc pas szerokości do 500 nm położony blisko zewnętrznej powierzchni komórki. Białka błon komórkowych również łączą się ze sobą uszczelniając połączenie (13, 20). Cała ta struktura uniemożliwia także przechodzenie wody z organizmu do hiperosmotycznego środowiska wewnątrz pęcherza. W zapobieganiu niekontrolowanemu przepływowi jonów i wody uczestniczą także kanały jonowe błony komórkowej.
Jak widać z powyższego opisu istnieje wiele elementów których uszkodzenie może prowadzić do zaburzeń strukturalnych i funkcjonalnych błony śluzowej oraz głębszych warstw ściany pęcherza, czego efektem mogą być objawy związane ze śródmiąższowym zapaleniem pęcherza.
Próby wyjaśnienia etiologii śródmiąższowego zapalenia pęcherza moczowego
Dotychczas powstało wiele teorii próbujących wyjaśnić etiologię tej choroby, dane przytaczane przez różnych autorów czasami wzajemnie się wykluczają. Świadczyć to może, że interstitial cystitis jest niejako wspólnym, końcowym etapem różnych patologii pęcherza moczowego albo że istnieje pierwotny, dotychczas nieznany czynnik wyzwalający różne procesy patologiczne (5, 6, 8).
Wyjaśnienia etiologii IC podjął się już G.L. Hunner (11). Podejrzewał on, że ta postać zapalenia pęcherza jest efektem przewlekłego krwiopochodnego zakażenia jego ściany. Podejrzewano również istnienie mikroorganizmów nie wykrywanych dotychczas stosowanymi testami mikrobiologicznymi. Ponowne zainteresowanie koncepcją infekcji jako czynnika etiologicznego pojawiło się w związku z odkryciem Helicobater pylori jako przyczyny przewlekłego zanikowego nieżytu błony śluzowej żołądka oraz choroby wrzodowej. Jak dotychczas nie wykazano nawet przy pomocy czułych metod inżynierii genetycznej istnienia czynnika infekcyjnego w IC (5, 6, 8).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Chaiken D.C. et al.: Behavioral therapy for the treatment of refractory interstitial cystitis. J. Urol., 1993, vol. 149:1445-1448. 2. Contran R.S. et al.: Lower urinary tract. [W:] Robbins Pathologic Basis of Disease. W.B. Saunders Comp. IV wyd., 1989, 1086-1097. 3. Fawcett W.: The urinary system. [W:] Bloom and Fawcett. A textbook of histology. Fawcett W., Chapmann and Hall, 12 wyd., New York 1994, 759-762. 4. Fowler J.E. et al.: Interstitial cystitis is associated with intraepithelial Tamm-Horsfall protein, J. Urol., 1988, 140:1385-1389. 5. Gillenwater J.Y., Wein A.J.: Summary of the National Institute of Arthritis, Diabetes, Digestive and Kidney Diseases Workshop on interstitial cystitis. J. Urol.,1988, 140:203-206. 6. Hanno Ph.: Interstitial cystitis and related diseases. [W:] Campbell´s Urology. Walsh P.C. et al. 7 wyd., W.B. Saunders Comp., Philadelphia 1998, 631-662. 7. Hanno Ph.: Diagnosis of interstitial cystitis. J. Urol.,1990, 143:278-281. 8. Hanno Ph.: Painful bladder syndrom. [W:] Krane R. et al.: Clinical Urology. J.B. Lippincott, Philadelphia, 1994, 610-617. 9. Held P.J. et al.: Epidemiology of interstitial cystitis. [W:] Interstitial cystitis. Hanno Ph. et al. Springer-Verlag, London 1990, 29-48. 10. Hohenfellner M. et al.: Interstitial cystitis: increased sympathetic innervation and related neuropeptide synthesis. J. Urol., 1992, 147:587-591.




