© Borgis - Postępy Fitoterapii 3/2007, s. 155-167
*Katarzyna Karłowicz-Bodalska1, 2, Tadeusz Bodalski
Znaczenie surowców roślinnych w leczeniu schorzeń wątroby
Role of plant crude drugs in treatment of liver diseases
1Hasco-Lek S.A. we Wrocławiu
Prezes Hasko-Lek: dr n. biol. Stanisław Han
2Zakład Farmacji Przemysłowej Wydziału Farmaceutycznego AM we Wrocławiu
Kierownik Zakładu: dr n. biol. Stanisław Han
Summary
The role of phytotherapy in the contemporary medicine has been commonly known and described in many elaborations. Liver – the main detoxifying organ of our organism – is constantly endangered with a toxic action of various external agents, which may often lead to a persistent damage of hepatocytes. Herbal medicines most frequently used in the treatment of liver impairments are: Fol. Cynarae, Fruct. Schisandrae and Fruct. Silybi mariani. The treatment with these drugs is recognized as safe and well tolerated.
According to some controversial opinion concerning the results of treatment of the liver diseases by means of the above mentioned drugs, the review of some literature positions (71) published mainly after the year 2000, discussing the chemical properties and pharmacological activity of these drugs, was carried out in order to verify their actual role in medicine.
These three herbal drugs – Fol. Cynarae, Fruct. Schisandrae and Fruct. Silybi mariani – have been subsequently studied in phytochemical and pharmacological institutes in many countries. The results of the pharmacological investigations in various experimental animal models have confirmed a broad spectrum of the hepatoprotective activity of these plants as well as their preparations, and in some cases, they have shown new, non traditional uses of these medicinal plant drugs.
Clinical studies have confirmed the therapeutic potential of Cynara scolymus, particularly in the treatmant of hepato-biliary dysfunction, digestive complaints (antispasmodic activity of cynaropicrin), and its choleretic and antioxidant effects. The fruit of Schizandra chinensis increase the capacity to fight various aspects of stress (adaptogen activity). Experimental evidences suggest that Schizandra and its active components (lignans – schizandrin and schizandrols) have hepato-protective abilities. They have been shown to lower SGPT levels in patients with chronic viral hepatotoxicity. Schizandrin B and C have been found to have a strong scavenging effect against active oxygen radicals.
The preparations obtained from Silybum marianum showed the most controversial results of the pharmacological and clinical investigations. Some of the studies (review articles) ensure the hepatoprotective activity of flavonolignans silymarin (mixture) and silybin, the main active substances of Silybum marianum. According to these publications silymarin acts by its antioxidative, anti-lipid peroxidative, antiinflammatory, membrane stabilizing, immunomodulatory and liver regenerating mechanisms, and is used as a cytoprotectant for the treatment of liver disease. Some other reviews and several actual clinical studies are contradictory and do not confirm these results. The obtained data are too limited in order to exclude the benefit or harm of the treatment with the preparations of Silybum marianum.
Present investigations of silymarin/silybin are focused on the new pharmacological activity of these substances (anticancerogen, canceroprotective, chemopreventive hypocholesterolemic and immunostimulant actions). Studies in vitro and in animal models support the possibility that silymarin has anticancerogenic effects for prostate, breast, colon and bladder cancer.
The non traditional applications of silymarin may result in a new approach to protect the other organs in addition to liver.

Znaczenie medycyny naturalnej, w tym szczególnie fitoterapii, we współczesnej medycynie jest powszechnie znane i opisywane w licznych opracowaniach. Równie często publikowane są doniesienia dotyczące stosowania surowców roślinnych w hepatoterapii. Wątroba, główny narząd odtruwający naszego organizmu, jest nieustannie poddawana szkodliwemu działaniu różnych czynników zewnętrznych. Do najbardziej szkodliwych, prowadzących do trwałego uszkodzenia hepatocytów (marskość, żółtaczka, przewlekłe stany zapalne różnego pochodzenia), należy niewątpliwie zaliczyć postępującą chemizację życia codziennego (w tym również przyjmowanie dużych ilości substancji chemicznych w formie leków) oraz alkoholizm. Stąd też schorzenia tego organu zajmują uprzywilejowaną pozycję w szeregu chorób cywilizacyjnych. Bliższe dane, opisujące rolę wątroby w organizmie, leki roślinne (wyciągi, substancje czynne oraz preparaty lecznicze) wykorzystywane w hepatoterapii, zamieszczono w odnośnych opracowaniach (1-4).
Duże znaczenie, poza właściwościami leczniczymi, przypisuje się działaniu ochronnemu preparatów roślinnych podczas terapii lekami uszkadzającymi narządy miąższowe. Większość stosowanych obecnie leków syntetycznych wykazuje działanie nefrotoksyczne i hepatotoksyczne. Jednoczesne podawanie wyciągów roślinnych, zawierających substancje cytoprotekcyjne, może zwiększyć aktywność terapeutyczną tych leków oraz obniżyć szkody polekowe.
Wśród doniesień piśmiennictwa, dotyczących ochronnego i leczniczego działania fitoterapeutyków na różne narządy wewnętrzne, zwłaszcza wątrobę, pojawiają się również publikacje ograniczające lub nie potwierdzające walorów terapeutycznych leku roślinnego (5, 6).
Celem niniejszego opracowania jest przedstawienie danych piśmiennictwa kilku ostatnich lat (2000-2007), weryfikujących działanie farmakologiczne trzech surowców roślinnych, stosowanych głównie jako leki lub środki wspomagające w różnych schorzeniach wątroby. Należą do nich liście karczocha zwyczajnego ( Fol. Cynarae), owoce cytryńca chińskiego ( Fructus Schisandrae) oraz owoce ostropestu plamistego ( Fructus Sylibi mariani).
Karczoch zwyczajny ( Cynara scolymus L. rodz. Asteraceae)
Roślina o nazwie synonimowej – artiszok, pochodzi prawdopodobnie z Etiopii. Jest rośliną wieloletnią, wykształcającą grubą, szaro owłosioną łodygę wysoką do 2 m, zakończoną dużym kwiatostanem (głowiasty koszyczek średnicy ok. 10 cm). Dno koszyczka zmięśniałe. Kwiaty liczne, niebieskawofioletowe. Liście przyziemne (rozetowe) długości do 1 m, w zarysie szeroko-lancetowate, głęboko-ząbkowane; łodygowe stopniowo zmniejszające się ku górze, szczytowe – równowąskie długości 5-6 cm.
Roślina macierzysta występuje w stanie naturalnym w Północnej Afryce, na Wyspach Kanaryjskich, w Południowej Europie. Jest uprawiana w wielu krajach Europy (również w Polsce) i Ameryki jako roślina spożywcza (zmięśniałe kwiatostany) oraz dla potrzeb przemysłu farmaceutycznego (liście i szczytowe pędy). Surowiec leczniczy stanowią świeże lub wysuszone liście karczocha ( Folium Cynarae scolymi) jak również ich przetwory w odpowiednich dawkach (1, 7, 8).
Właściwości lecznicze surowca zostały potwierdzone stosunkowo niedawno, mimo iż karczoch od wieków był stosowany w medycynie ludowej w leczeniu schorzeń wątroby oraz w zaburzeniach czynności wydzielniczej żołądka. Kliniczne i przedkliniczne badania potwierdziły terapeutyczne właściwości rośliny, szczególnie w zakresie działania żółciopędnego i żółciotwórczego ( cholagogum i cholereticum), zaburzeń trawienia, w hipercholesterolemii oraz w zespole drażliwego jelita (5, 9-13).
Obecnie surowiec jest wykorzystywany do produkcji preparatów leczniczych, stosowanych w stanach zapalnych pęcherzyka żółciowego, przewodów żółciowych, w niewydolności wątroby, kamicy żółciowej oraz w zaburzeniach przemiany tłuszczowej (1).
Skład chemiczny (14-18)
W surowcu handlowym występuje mieszanina kwasów mono- i dikawoilochinowych w ilości do 1,4% (w przeliczeniu na kwas chlorogenowy), której podstawowymi składnikami są kwasy: chlorogenowy (ryc. 1), neo- i krypto-chlorogenowy oraz cynaryna (kwas 1,5-dikawoilo-chinowy) (ryc. 2) – uważana za główny związek działający. W grupie laktonów seskwiterpenowych (do 4%), którymi są pochodne gwajanolidowe o silnie gorzkim smaku, zidentyfikowano cynaropikrynę (ryc. 3) jako podstawowy składnik mieszaniny (9). Związki flawonoidowe są reprezentowane głównie przez pochodne flawonu: luteolinę i jej 7-O-glukopiranozyd (cynarozyd) (ryc. 4). Skład chemiczny surowca oparto na publikacjach Shimody i wsp. (14), Schutza i wsp. (15), Rechnera i wsp. (16), Lloracha i wsp. (17) oraz Wanga i wsp. (18).
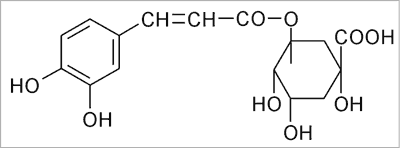
Ryc. 1. Kwas chloro genowy.
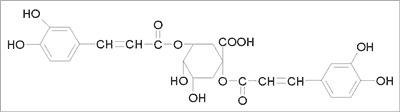
Ryc. 2. Cynaryna.
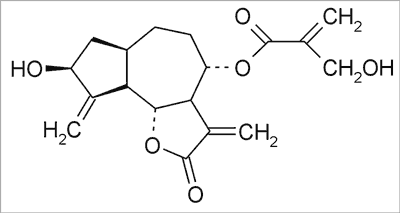
Ryc. 3. Cynaropikryna.
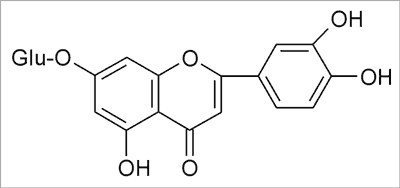
Ryc. 4. Cynarozyd.
Działanie farmakologiczne
Badaniom właściwości farmakologicznych liści karczocha zwyczajnego poświęcono wiele publikacji. We wcześniejszych badaniach na szczurach udowodniono, że alkoholowe wyciągi z liści i ziela karczocha zwiększają wydzielanie żółci o 20-40% i ułatwiają jej przepływ w drogach żółciowych, a także zmniejszają poziom lipidów i cholesterolu we krwi (5, 10, 19). Zaobserwowano przy tym, że objętość wydzielanej żółci wzrasta wraz ze zwiększeniem dawki mieszaniny kwasów kawoilochinowych, głównie izomerów kwasu chlorogenowego.
Właściwości choleretyczne surowca zostały udokumentowane zarówno na zdrowych ochotnikach, jak i na pacjentach skarżących się na niespecyficzne zaburzenia trawienne.
Wyciągi z liści podawane szczurom po częściowej hepatektomii powodowały regenerację wątroby (przyrost wagi oraz podwyższenie biosyntezy białka). Wodno-alkoholowy wyciąg z liści karczocha, zawierający ok. 46% pochodnych kawoilochinowych, podany szczurom dootrzewnowo, powodował obniżenie poziomu glicerydów o 33%, a cholesterolu o 45%.
Gebhardt (5, 13) wykazał, że ekstrakty z surowca hamują biosyntezę cholesterolu wątrobowego u szczurów. Zauważył przy tym, że najwyższą aktywność hamującą wykazuje luteolina i cynarozyd, a nie cynaryna i inne pochodne kwasu chlorogenowego, dotąd uważane za podstawowe substancje działające surowca. Luteolina blokuje ponadto stymulowanie biosyntezy cholesterolu przez insulinę, co według autora wskazuje na pośredni charakter mechanizmu działania hamującego.
Ten sam autor wykazał, że wyciągi wodne z liści karczocha mają właściwości antyoksydacyjne i hepatoochronne. Badania prowadził na hodowlach hepatocytów szczurzych. Stwierdził, że efektywne stężenia wyciągów (poniżej 0,001 mg/ml) były znacznie niższe od stężeń wyciągów wykazujących aktywność cytotoksyczną (powyżej 1 mg/ml). Chociaż zawartość kwasu chlorogenowego w wyciągach z liści karczocha (0,5-1,5%) jest około 4-krotnie wyższa od zawartości flawonoidów (luteoliny i cynarozydu) to, zdaniem autora, właśnie te związki są odpowiedzialne za obserwowane działanie antyoksydacyjne, które nie zmieniało się pod wpływem temperatury, zakwaszenia, ani po trawieniu trypsyną badanych wyciągów.
W podsumowaniu autor stwierdza, że wyciągi z liści karczocha redukują biosyntezę cholesterolu wątrobowego pośrednio, w sposób korzystny fizjologicznie. Przeprowadzone badania potwierdzają zaobserwowane ostatnio u ludzi działanie hipolipemiczne badanych wyciągów (20).
Zapolska-Downar i wsp. (21) wykazali, że wodne i etanolowe wyciągi z liści karczocha hamują stres oksydacyjny, indukowany w hodowlach komórek śródbłonka i monocytach, w sposób zależny od dawki i czasu trwania eksperymentu. W oparciu o wcześniejsze dane piśmiennictwa autorzy wybrali kilka znanych mediatorów stanu zapalnego (jak TNFα, LPS) do stymulowania międzykomórkowego stresu oksydacyjnego oraz utleniony LDL (ox-LDL) do indukowania wolnych rodników tlenowych w komórkach śródbłonka i monocytach. Komórki te odgrywają istotną rolę w patogenezie miażdżycy. Autorzy stwierdzili, że 30-minutowa preinkubacja komórek nabłonka z wodnym lub etanolowym wyciągiem z liści karczocha wystarcza do wytworzenia statystycznie znamiennego efektu hamującego. Stwierdzili również, że badane wyciągi, poza właściwościami „zmiatania” wolnych rodników, wykazują właściwości ochraniające mechanizm działania antyoksydacyjnego. Przeprowadzone badania potwierdziły, że hamowanie tworzenia się wolnych rodników tlenowych nie tylko zapewnia ochronę przed ich toksycznością lecz również przeciwdziała powstawaniu ox-LDL, prawdopodobnie głównego mediatora aterogenezy. Z przeprowadzonych badań wynika, że wyciągi z liści karczocha zmniejszają ryzyko miażdżycy przez zapobieganie utlenianiu LDL oraz przez wcześniej stwierdzone hamowanie biosyntezy cholesterolu w surowicy krwi (5, 13). Według autorów uzyskane wyniki mogą być wykorzystane w badaniach zmierzających do zastosowania liści karczocha w leczeniu miażdżycy i skutków tego schorzenia.
Lupatelli i wsp. (22) badali wpływ suplementacji sokiem ze świeżych liści karczocha na gospodarkę lipidów oraz funkcje śródbłonka u pacjentów hiperlipemicznych. Dysfunkcje śródbłonka, jak wyżej, stanowią pierwsze stadium miażdżycy. U ludzi hipercholesterolemia i hipertriglicerydemia prowadzą do zmniejszenia wazodilatacji i podwyższenia ekspresji rozpuszczalnych cząsteczek adhezyjnych. Autorzy prowadzili badania z udziałem 18 umiarkowanie hiperlipemicznych pacjentów obu płci w wieku od 35-60 lat oraz 10 pacjentów dobranych pod względem wieku, płci i parametrów lipidowych (jako kontrola). Wszyscy pacjenci zostali poddani wstępnym badaniom kontrolnym, które obejmowały oznaczenie w surowicy krwi: poziomu lipidów, adhezji rozpuszczalnych cząsteczek do komórek ścian naczyń (VCAM-1; vascular cell adhesion molecule-1), międzykomórkowej adhezji cząsteczek-1 (ICAM-1; intercellular adhesion molecule-1), selektyny E oraz pomiaru wazodilatacji tętnicy ramieniowej (FMV; flow-mediated vasodilation). Po zakończeniu badań wstępnych 18 badanym pacjentom podawano preparat z karczocha w określonej dawce przez 6 tygodni. Po upływie tego czasu powtórzono te same zestawy badań kontrolnych. Uzyskane wyniki poddano ocenie.
W grupie suplementowanej sokiem z karczocha stwierdzono podwyższenie poziomu triglicerydów, obniżenie cholesterolu całkowitego, cholesterolu LDL, wartości VCAM-1 i ICAM-1 oraz podwyższenie wazodilatacji FMV. U 10 pacjentów kontrolnych wyniki pierwszych dwóch oznaczeń (cholesterol całkowity i LDL) były podobne do wyników w grupie verum.W grupie kontrolnej nie odnotowano natomiast znaczących zmian w wartościach VCAM-1, ICAM-1, selektyny E i FMV. Wykazano, że u pacjentów otrzymujących sok z karczocha, zmiany VCAM-1 i ICAM-1 były znacząco powiązane ze zmianami w FMV. Na tej podstawie autorzy wnioskują, że suplementacja diety preparatem z karczocha moduluje pozytywnie funkcje śródbłonka w hipercholesterolemii.
Li i wsp. (23) badali wpływ trzech preparatów otrzymanych z liści karczocha zwyczajnego: wodnego wyciągu (ALE), frakcji organicznej tego wyciągu (OSF) i pozostałości wodnej (ASF) na syntezę śródbłonkowego NO. Tlenek azotu wytwarzany przez syntezę typu śródbłonkowego (eNOS) (endothelial-type nitric oxide synthase) stanowi ważny czynnik przeciwzakrzepowy i przeciwmiażdżycowy układu naczyniowego; jest silnym wazodilatorem biorącym udział w kontrolowaniu ciśnienia krwi (24). Blokowanie jego syntezy powoduje poważne następstwa w układzie krążenia (zwężenie obwodowych naczyń krwionośnych i podwyższenie ciśnienia krwi).
Przeprowadzone przez wyżej wymienionych autorów badania wykazały, że wyciąg ALE i frakcja OSF stymulują syntezę NO w hodowlach ludzkich komórek śródbłonka naczyniowego oraz zwiększają zależną od śródbłonka wazodilatację w szczurzej aorcie. W obu doświadczeniach frakcja OSF działała silniej niż ALE, natomiast ASF nie wykazała tego działania. W celu wyjaśnienia, która grupa substancji czynnych jest odpowiedzialna za powyższe działanie, autorzy poddali analogicznym badaniom 4 podstawowe związki czynne surowca: cynarynę i kwas chlorogenowy z grupy pochodnych kawoilochinowych oraz luteolinę i jej 7-O-glukopiranozyd (cynarozyd) z grupy pochodnych flawonu. Uzyskane wyniki wykazały, że luteolina i cynarozyd podwyższały aktywność mediatora eNOS, a w konsekwencji syntezę NO, w sposób zależny od stężenia. Oba flawonoidy również podwyższały ekspresję mRNA w komórkach śródbłonka w tym procesie. Związki te występują w dużym stężeniu we frakcji OSF. W przeciwieństwie do luteoliny i cynarozydu, kwas chlorogenowy i cynaryna nie podwyższały syntezy NO, ani ekspresji mRNA, w komórkach śródbłonka w powyższych eksperymentach.
Z przeprowadzonych badań wynika, że flawonoidy liści karczocha przedstawiają grupę związków odpowiedzialnych, przynajmniej częściowo, za regulację e-NOS i właściwości ochronne układu naczyniowego oraz przeciwmiażdżycowe tego surowca.
Emendorfer i wsp. (25) przeprowadzili ( in vitro) badanie działania przeciwskurczowego wyciągów metanolowych (ME) z sześciu roślin brazylijskich (w tym Cynara scolymus L.) na wyizolowanym jelicie cienkim świnki morskiej i dwunastnicy szczura. Uzyskane wyniki sugerują, że z 6 badanych roślin leczniczych jedynie dwie (w tym C. scolymus) wykazały aktywność przeciwskurczową, przy czym ME z liści karczocha okazał się najbardziej aktywnym wyciągiem w tym eksperymencie. W celu określenia substancji odpowiedzialnej za profil przeciwskurczowy ME autorzy przeprowadzili frakcjonowaną ekstrakcję tego wyciągu. Najsilniejszy efekt przeciwskurczowy w badaniach in vitro na wyizolowanym jelicie cienkim świnki morskiej, porównywalny z działaniem papaweryny, wykazała cynaropikryna wydzielona z frakcji dichlorometanu. Autorzy wnioskują, że powyższy efekt przeciwskurczowy jest prawdopodobnie spowodowany obniżeniem stężenia wapnia w mięśniu gładkim podczas działania acetylocholiny w modelowym eksperymencie in vitro (9). Wyniki badań wskazują, że cynaropikryna jest głównym związkiem odpowiedzialnym za działanie relaksacyjne na mięśnie gładkie. Przeprowadzone eksperymenty potwierdzają celowość powszechnego stosowania przetworów z karczocha w zaburzeniach żołądkowo-jelitowych.
Reasumując, wyniki prowadzonych w bieżącym dziesięcioleciu badań dotyczących wartości leczniczej karczocha i jego przetworów, przedstawione zarówno w postaci oryginalnych prac eksperymentalnych, jak i publikacji o charakterze przeglądowym, w pełni potwierdzają wyrażaną powszechnie opinię o dużej przydatności owoców Cynara scolymus w lecznictwie, zwłaszcza w hepatoterapii.
Cytryniec chiński ( Schisandra chinensis (Turcz.) Baill., rodz. Schisandraceae)
Omawiana roślina jest drzewiastym pnączem o długich, wijących się łodygach (10-15 m) i białych lub kremowych kwiatach, zebranych po 2-5 na szypułkach. Surowcem są owoce – czerwone, kuliste jagody o soczystym miąższu i cytrynowym zapachu. Roślina macierzysta występuje w stanie naturalnym i jest uprawiana na Dalekim Wschodzie (Chiny, Korea, Sachalin) oraz w krajach Europy Wschodniej (Ukraina, Bułgaria, Białoruś).
W medycynie ludowej Dalekiego Wschodu owoce cytryńca są używane jako środek wzmacniający i uspokajający od 2000 lat (26-28). W Chinach stanowią składnik preparatu „Shengmai San”, stosowanego w chorobie wieńcowej serca, w Korei są wykorzystywane od dawna w leczeniu objawów sercowo-naczyniowych związanych głównie z okresem menopauzalnym. Współczesne badania Lee i wsp. (29) potwierdziły tradycyjne wskazania. Wykazano, że wyciągi z owoców cytryńca, poza efektem wazodilatacyjnym, działają jak słabe fitoestrogeny.
Aktualnie surowiec jest stosowany zwykle w postaci naparu w stanach zmęczenia fizycznego i psychicznego, depresjach oraz schorzeniach wątroby (27, 28).
Skład chemiczny
Surowcem leczniczym są owoce i nasiona cytryńca. Występują w nich liczne związki typu lignanu, pochodne dibenzo(a,c)cyklooktenu (w nasionach od 7,2% do 19,2%), wśród których na uwagę zasługują schizandrole (A i B) (ryc. 5 i 6) oraz schizandryny (A i B) (ryc. 7 i 8) (30). Głównym związkiem mieszaniny, aktywnym w leczeniu wirusowych i wywołanych stresorami chemicznymi stanów zapalnych wątroby, jest schizandryna B. Związek ten, jak wykazały badania podstawowe, wykazuje zdolność zapobiegania uszkodzeniom wątroby wywołanym działaniem CCl4 (31).
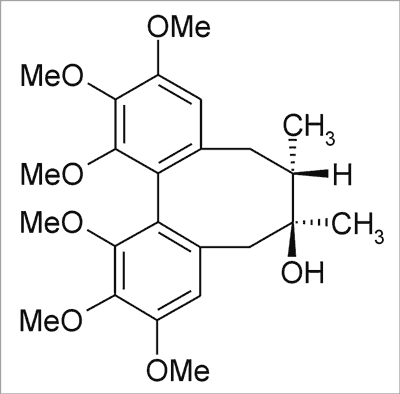
Ryc. 5. Schizandrol A.
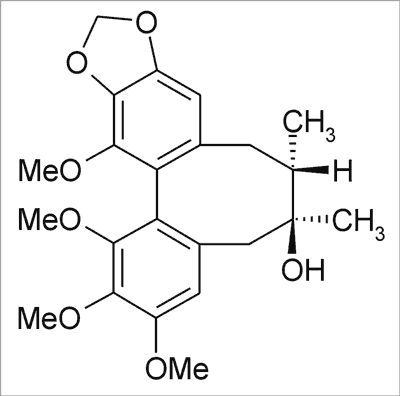
Ryc. 6. Schizandrol B.
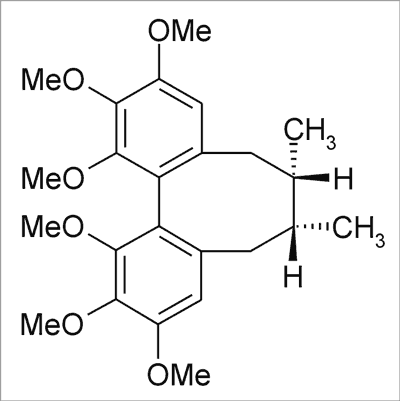
Ryc. 7. Schizandryna A.
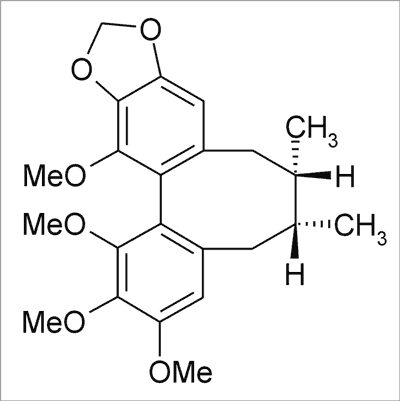
Ryc. 8. Schizandryna B.
W surowcu występują ponadto kwasy organiczne (winowy, jabłkowy i cytrynowy), olejek eteryczny oraz witamina C (ok. 0,03%).
Postępujący rozwój fitochemii, w tym izolacja bioaktywnych składników, ułatwia systematyczne poznawanie właściwości fizjologicznych i terapeutycznych złożonych wyciągów roślinnych.
Działanie farmakologiczne
Sinclair (26) przeprowadził krótki przegląd dotychczasowych farmakologicznych i klinicznych badań trzech roślin leczniczych ( Astragalus membranaceus, Ligusticum wallichii i Schisandra chinensis), wykorzystywanych w tradycyjnej medycynie chińskiej (TCM) od ponad 2 tysięcy lat. Najwięcej uwagi autor poświęcił ocenie aktywności hepatotropowej cytryńca chińskiego. Przetwory z tej rośliny oraz wyizolowane lignany są skuteczne w leczeniu wirusowych i wywołanych stresorami chemicznymi stanów zapalnych wątroby. Substancje te obniżają u zwierząt doświadczalnych hepatotoksyczność wywołaną działaniem CCl4 oraz redukują poziom aminotransferazy alaninowej w surowicy pacjentów z chronicznym wirusowym zapaleniem wątroby.
Badania farmakologiczne wykazały, że bioaktywne lignany cytryńca podwyższają syntezę białka i glikogenu w wątrobie, hamują indukowaną CCl4 peroksydację lipidów oraz stymulują układ enzymatyczny cytochromu P-450. Schizandryny B i C wykazują najsilniejsze działanie przeciwwolnorodnikowe
Autor podkreśla długą historię skuteczności i bezpieczeństwo stosowania wieloskładnikowych leków roślinnych, charakterystycznych dla TCM w różnych schorzeniach.
Celem pracy Lee i wsp. (29) było zbadanie relaksacyjnego wpływu ekstraktów z owoców Schisandra chinensis na naczynia krwionośne oraz mechanizmu tego działania. Wcześniejsze badania wykazały, że estrogen wpływa korzystnie na schorzenia sercowo-naczyniowe przez pobudzenie funkcji komórek śródbłonka, rozwój naczyń krwionośnych i inne. Biorąc powyższe pod uwagę oraz fakt, że surowiec wchodzi w skład znanego w Chinach preparatu stosowanego w leczeniu choroby wieńcowej i innych schorzeń serca w okresie menopauzalnym, autorzy zbadali działanie wyciągów z cytryńca jako fitoestrogenów. Stwierdzili, że surowy ekstrakt wodny z owoców cytryńca (SC-Ex) powoduje krótkotrwały efekt rozkurczający endotelium aorty szczurzej uprzednio poddanej kurczącemu działaniu norepinefryny. W celu zidentyfikowania substancji odpowiedzialnej za właściwości spazmolityczne cytryńca przeprowadzono rozfrakcjonowanie SC-Ex rozpuszczalnikami organicznymi. Silniejszy efekt relaksacyjny odnotowano dla frakcji butanolowej. Dalsze badania dotyczyć będą izolacji i analizy farmakologicznej wydzielonych substancji. Dotychczasowe badania wykazały, że ekstrakty z cytryńca zawierają związki aktywujące receptory estrogenowe.
Nakagiri i wsp. (32) w badaniach in vitro potwierdzili właściwości hepatoprotekcyjne cytryńca chińskiego na modelu acetaminofenu i D-galaktozaminy. W badaniach tych autorzy wykorzystali zmodyfikowaną w skali mikro znaną metodę hodowli szczurzych hepatocytów na płytkach pokrytych matrigelem. Zastosowany przez autorów model hodowli jest odpowiedni do wykazania żywotności hepatocytów poddanych intoksykacji wymienionymi związkami w warunkach doświadczenia i nadaje się do przeprowadzania skriningowych badań substancji o działaniu hepatoprotekcyjnym.
Chiu i wsp. (31) badali mechanizm molekularny leżący u podstawy działania hepatoprotekcyjnego schizandryny B. Autorzy wykazali, że wymienione działanie schizandryny B wiąże się z podwyższeniem w mitochondriach poziomu glutationu, kluczowego antyoksydanta w komórkach parenchymatycznych wątroby, którego zawartość podczas procesu detoksykacji ulega degradacji. Mitochondria regulują funkcje czynnościowe i strukturalne komórki oraz pełnią rolę koordynatora integralności, decydującego o życiu lub śmierci (apoptoza) komórki. Autorzy przeprowadzili badania, czy i w jaki sposób premedykacja zwierząt doświadczalnych (myszy) schizandryną B uwrażliwia przepuszczalność (permeability transition; PT) mitochondriów wyizolowanych z wątrób tych zwierząt. W tym celu autorzy zbadali efekt działania schizandryny B na stymulowaną jonami Ca2+ przepuszczalność badanych mitochondriów w warunkach normalnych oraz w środowisku CCl4. Stwierdzili, że właściwości hepatoprotekcyjne schizandryny B w warunkach intoksykacji CCl4 były równoległe z obniżeniem indukowanej jonami Ca2+przepuszczalności mitochondriów, a także z obniżeniem ilości produkowanych wolnych rodników tlenowych i uwalniania cytochromu C. Zjawisko to potwierdza wcześniej poczynione przez autorów spostrzeżenie, że mitochondria wątrobowe myszy uprzednio premedykowanych schizandryną B, a następnie poddanych działaniu CCl4, zachowują zdolność generowania ATP.
Autorzy wyrażają opinię, że obniżona wrażliwość mitochondriów (wyizolowanych z wątrób myszy wstępnie premedykowanych schizandryną B) do stymulowanej jonami Ca2+ przepuszczalności może odgrywać ważną rolę w ochronie wątroby uszkodzonej działaniem CCl4. W dalszym ciągu jednak mechanizm molekularny dotyczący podwyższania (indukowanej przez schizandrynę B) oporności mitochondriów do PT pozostaje nieznany.
Niektóre wyciągi roślinne, zwłaszcza o działaniu hepatoprotekcyjnym, odtruwającym i antyoksydacyjnym wykazują wpływ na aktywność enzymów cytochromu P450 (CYP) (33).
Hu i wsp. (34) stwierdzili m.in., że zawartość całkowitego CYP i ilość zmetabolizowanej imipraminy została znacznie podwyższona w mikrosomach wątroby szczurów premedykowanych wyciągami z Glycyrrhiza uralensis i Schisandra chinensis.
Mechanizm molekularny, przy pomocy którego niektóre surowce roślinne lub wydzielone z nich substancje regulują ekspresję enzymów wątrobowych i transporterów, badali Mu i wsp. (30). W szeroko zakrojonych badaniach in vivo z zastosowaniem receptora pregnanowego X (PXR) z grupy tak zwanych receptorów-sierot, regulującego ekspresję enzymów ludzkich i zwierzęcych, a także zestawienia skriningu liganda i analizy farmakokinetycznej autorzy wykazali, że wyciągi z Glycyrrhiza glabra Fisch i Schisandra chinensis Baill oraz wyizolowane z cytryńca chińskiego związki czynne aktywują receptor PXR i podwyższają znacznie poziom enzymów wątrobowych P450. Zgodnie z tą obserwacją odnotowali, że wyciągi z obu roślin zwiększają klirens włączonej do badań warfaryny, metabolizowanej w organizmie ludzkim przez izozymy CYP3A i 2C. Najsilniejszymi aktywatorami PXR z badanych substancji okazały się schizandryny A i B. Przeprowadzone badania wyjaśniają w pewnym stopniu działanie hepatoprotekcyjne niektórych roślin. Aktywowanie PXR i konsekwentne indukowanie enzymów odtruwających (metabolizujących substancje toksyczne) może stanowić punkt wyjścia mechanizmu działania substancji czynnych TMS (35-37).
Chan i wsp. (38) badali działanie immunomodulujące CKBM, złożonego leku medycyny chińskiej (5 składników pochodzenia roślinnego), zawierającego m.in. cytryniec chiński ( Schisandra chinensis). Autorzy wykazali w badaniach in vitro, że zespół CKBM uwalnia IL-6 (interleukinę-6) i TNFα (tumor necrosis factor α) z jednojądrzastych ludzkich komórek krwi obwodowej oraz wykazuje efekt przeciwnowotworowy w badaniach in vivo (na myszach z rakiem żołądka). Autorzy wykorzystali w eksperymencie linię THP-1 monocytów jako model komórkowy do zbadania sposobu, w jaki CKBM reguluje międzykomórkowe rozpoznawanie monocytów i uwalnianie wytwarzanych cytokin. Stwierdzili, że preparat CKBM, zawierający składniki o różnych funkcjach: immunomodulującej, przeciwwirusowej i przeciwnowotworowej, może być uważany za terapeutyk pomocny w dolegliwościach zarówno fizjologicznych, jak i mentalnych.
Ostropest plamisty ( Silybum marianum (L.) Gaertn., rodz. Asteraceae)
Jest to jedna z najstarszych roślin stosowanych w hepatoterapii. Występuje rodzimie w krajach nadśródziemnomorskich, obecnie jest uprawiana dla celów leczniczych. Jest to roślina jednoroczna o wysokości 1 m (rzadko 2 m), o pokroju typowym dla astrowatych. Liście szeroko-eliptyczne, zatokowato klapowane o brzegach kolczastych, charakterystycznie biało siatkowane. Pędy rozgałęzione, zakończone okazałymi koszyczkami z purpurowymi kwiatami rurkowymi; łuski okrywy koszyczka opatrzone ciernistym końcem. Surowiec stanowią dojrzałe owoce (niełupki), pozbawione puchu kielichowego (1, 39-41).
Dane piśmiennictwa informują, że ostropest plamisty jest najczęściej stosowanym lekiem roślinnym w chorobach wątroby. Sprzedaż preparatów z tej rośliny wzrosła w USA o 51% w ciągu roku (od 1998 do 1999) (6). W 2000 roku ostropest zajął w USA 10 miejsce w rankingu wszystkich sprzedawanych leków. Sylimaryna jest bardzo często stosowana również w Niemczech, gdzie sprzedaż preparatów produkowanych na bazie tej substancji w latach 1992-1996 zwiększyła się trzykrotnie (41).
Skład chemiczny
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Ożarowski A.: Wątroba - zapobieganie chorobom i leczenie sposobami naturalnymi. Portal Farmaceutyczno-Medyczny PFM.PL S.A. Copyright by PFM PL S.A. Warszawa 2006. 2. Mrozowski T.: Kamica żółciowa i metody jej leczenia. Cz. II. Wiad. Ziel. 2002, 5, 1. 3. Lutomski J., Kędzia B.: Ocena aktywności biologicznej roślin o działaniu adaptogennym. Post. Fitoter. 2000, 2, 38. 4. Ptasznik A.: Rola sylimaryny w zapobieganiu i leczeniu chorób wątroby. Post. Fitoter. 2004, 4, 189. 5. Gebhardt R.: Inhibition of cholesterol biosynthesis in primary cultured rat hepatocytes by artichoke ( Cynara scolymus L.) extracts. J. Pharmacol. Exp. Ther. 1998, 286, 1122. 6. Jacobs B.P., Dennehy C., Ramirez G. i wsp: Milk thistle for the treatment of liver disease: a systematic review and meta-analysis. Am. J. Med. 2002, 113, 506. 7. Burdzenia O.: Karczoch - rośliną leczniczą roku 2000 w Polsce. Wiad. Ziel. 2001, 3, 3. 8 Monografia: Cynarae Folium (liść karczocha). Rośliny Lecznicze w Fitoterapii. IRIPZ. Poznań 1994, 312.. 9. Emendörfer F., Emendörfer F., Bellato F. i wsp.: Antispasmodic activity of fractions and cynaropicrin from Cynara scolymus on guinea-pig ileum. Biol. Pharm. Bull. 2005, 28, 902. 10. Speroni E., Cervelatti R. i wsp.: Efficacy of different Cynara scolymus preparations on liver complaints. J. Ethnopharmacol. 2003, 86, 203. 11. Englisch W., Beckers C., Unkauf M. i wsp: Efficacy of artichoke dry extract in patients with hyperlipoproteinemia. Arzneim. Forsch. 2000, 50, 260. 12. Holtmann G., Adam B., Haag S. i wsp: Efficacy of artichoke leaf extract in the treatment of patients with functional dyspepsia: a six- week placebo-controlled, double-blind, multicentre trial. Aliment. Pharmacol. Ther. 2003, 18, Nr 11-12, 1099. 13. Gebhardt R.: Inhibition of cholesterol biosynthesis in HepG2 cells by artichoke extracts is reinforced by glucosidase pretreatment. Phytoter. Res. 2002, 16, 368. 14. Shimoda H., Ninomiya K., Nishida N. i wsp: Anti-hyperlipidemic sesquiterpenes and new sesquiterpene glycosides from the leaves of artichoke ( Cynara scolymus L.); structure requirement and mode of action. Bioorg. Med. Chem. Lett. 2003, 13, 223. 15. Schutz K., Kammerer D., Carle R., Schieber A.: Identification and quantification of caffeoylquinic acids and flavonoids from artichoke ( Cynara scolymus L.) heads, juice and pomace by HPLC-DAD-ESI/MS. J. Agric. Food Chem. 2004, 52, 4090. 16. Rechner A.S., Pannala A.S., Rice-Evans C.A.: Caffeic acid derivatives in artichoke extract are metabolised to phenolic acids in vivo. Free Radic. Res. 2001, 35, 195. 17. Llorach R., Espin J.C., Tomas-Barberan F.A., Ferreres F.: Artichoke ( Cynara scolymus L.) byproducts as a potential source of health-promoting antioxidant phenolics. J. Agric. Food Chem. 2002, 50, 3458. 18. Wang M., Simon J.E., Aviles J.F. i wsp.: Analysis of antioxidative phenolic compounds in artichoke ( Cynara scolymus L.). J. Agric. Food Chem. 2003, 51, 601. 19. Saenz-Rodriguez T., Garcia-Gimenez D., de la Puerta Vasquez R.: Choleretic activity and biliary elimination of lipids and bile acids induced by an artichoke leaf extract in rats. Phytomed. 2002, 9, 687. 20. Pittler M.H., Thompson C.O., Ernst E.: Artichoke leaf extract for treating hypercholesterolemia. Cochrane Database System Review 3, 2002, CD003335. 21. Zapolska-Downar D., Zapolski-Downar A., Naruszewicz M. i wsp: Protective properties of artichoke ( Cynara scolymus) against oxidative stress induced in cultured endothelial cells and monocytes. Life Sci. 2002, 71, 2808. 22. Lupattelli G., Marchesi S., Lombardini R. i wsp: Artichoke juice improves endothelial function in hyperlipemia. Life Sci. 2004, 76, 775. 23. Li H., Xia N., Brausch I. i wsp: Flavonoids from artichoke ( Cynara scolymus L.) up-regulate endothelial-type nitric-oxide synthase gene expression in human endothelial cells. J. Pharmacol. Exp. Ther. 2004, 310, 926. 24. Li H., Forstermann U.: Nitric oxide in the pathogenesis of vascular disease. J. Pathol. 2000, 190, 244. 25. Emendörfer F., Emendörfer F., Bellato F. i wsp: Evaluation of the relaxant action of some Brazilian medicinal plants in isolated guinea-pig ileum and rat duodenum. J. Pharm. Pharm. Sci. 2005, 8, 63. 26. Sinclair S.: Chinese Herbs: A clinical review of Astragalus, Ligusticum and Schizandra. Altern. Med. Rev. 1998, 3, 338. 27. Kędzia B.: Właściwości biologiczne i lecznicze owocu Schisandra chinensis. Herba Pol. 2002, 48, 146. 28. Lamer-Zarawska E.: Cytryniec chiński - wartościowa roślina lecznicza. Wiad. Ziel. 2001, 2, 18. 29. Lee Y.J., Cho J.Y., Kim J-H. i wsp: Extracts from Schizandra chinensis fruit activate estrogen receptors: a possible clue to its effects on nitric oxide-mediated vasorelaxation. Biol. Pharm. Bull. 2004, 27, 1066. 30. Mu Y., Zhang J., Zhang S. i wsp.: Traditional chinese medicines wu wei zi ( Schisandra chinensis Baill) and gan cao ( Glycrrhiza uralensis Fisch) activate pregnane X receptor and increase warfarin clearance in rats. J. Pharmacol. Exp. Ther. 2006, 316, 1369. 31. Chiu P.Y., Leung H.Y., Siu A.H.L. i wsp.: Schisandrin B decreases the sensitivity of mitochondria to calcium ion-induced permeability transition and protects against carbon tetrachloride toxicity in mouse livers. Biol. Pharm. Bull. 2007, 30, 1108. 32. Nakagiri R., Oda H., Kamiya T.: Small scale rat hepatocyte primary culture with applications for screening hepatoprotective substances. Biosci. Biotechnol. Biochem. 2003, 67, 1629. 33. Zhu M., Yeung R.Y., Lin K.F., Li R.C.: Improvement of phase I drug metabolism with Schisandra chinensis against CCl4 hepatotoxicity in a rat model. Planta Med. 2000, 66, 521. 34. Hu W.Y., Li Y.W., Hou Y.N. i wsp.: The induction of liver microsomal cytochrom P450 by Glycyrrhiza uralensis and glycyrrhetinic acid in mice. J. Biomed. Environ. Sci. 1999, 12, 10. 35. Lin G., Nnane I.P., Cheng T.Y.: The effects of pretreatment with glycyrrhizin and glycyrrhetinic acid on the retrorsine-induced hepatotoxicity in rats. J. Toxicon. 1999, 37, 1259. 36. Xie W., Radominska-Pandya A., Shi Y. i wsp: An essential role for nuclear receptors SXR/PXR in detoxication of cholestatic bile acids. Proc. Natl. Acad. Sci. USA 2001, 98, 3375. 37. Xie W., Uppal H., Saini S.P. i wsp.: Orphan nuclear receptor-mediated xenobiotic regulation in drug metabolism. Drug Discov. Today 2004, 9, 442. 38. Chan A.S., Yip E. C.-H., Yung L.Y. i wsp.: Immuno-regulatory effects n CKBM on the activities of mitogen-activated protein kinases and the release of cytokines in THP-1 monocytic cells. Biol. Pharm. Bull. 2005, 28, 1645. 39. Silybum marianum (Milk Thistle) Monograph. Altern. Med. Rev. 1999, 4, 272. 40. Burgess C.A.: Silybum marianum (Milk Thistle). J. Pharm. Soc. Wisconsin 2003, Mar/Apr, 38. 41. Pradhan S.C., Girish C.: Hepatoprotective herbal drug, silymarin from experimental pharmacology to clinical medicine. Review article. Ind. J. Med. Res. 2006, 124, 491. 42. Lee D.Y., Jiu Y.: Molecular structure and stereochemistry of silybin A, silybin B, isosilybin A and isosilybin B, isolated from Silybum marianum (milk thistle). J. Nat. Prod. 2003, 66, 1171. 43. Rainone F.: Milk Thistle. Am. Fam. Phys. 2005, 72, 1285. 44. Lieber Ch., Lec M.: Nowości ze świata leków: Wpływ sylimaryny na przebieg alkoholowej choroby wątroby. Lek w Polsce 2005, 15, 8. 45. Enjalbert F., Rapior S., Nouguier-Soule J. i wsp.: Treatment of amatoxin poisoning: 20-year retrospective analysis. J. Toxicol. Clin. Toxicol. 2002, 40, 715. 46. Kidd P., Head K.: A review of the bioavailability and clinical efficacy of milk thistle phytosome: a silybin-phosphatidylcholine complex (Siliphos). Alternat. Med. Rev. 2005, 10, 193. 47. Skottova N., Krecman V.: Silymarin as a potential hypocholesterolaemic drug. Physiol. Res. 1998, 47, 1. 48. Krauze-Baranowska M.: Źródło surowca leczniczego o wielokierunkowej aktywności. Farm. Pol. 2004, 60, 717. 49. Kren V., Walterova D.: Silybin and silymarin - new effects and applications. Biomed. Papers 2005, 149, 29. 50. Dorai T., Aggarval B.B.: Role of chemopreventive agents in cancer therapy. Cancer Lett. 2004, 215, 129. 51. Zi X., Agarval R.: Modulation of mitogen-activated protein kinase activation and cell cycle regulators by the potent skin cancer preventive agent silymarin. Biochem. Biophys. Res. Commun. 1999, 263, 528. 52. Singh R.P., Tyangi A.K., Zhao J. i wsp.: Silymarin inhibits growth and causes regression of established skin tumors in SENCAR mice via modulation of mitogen-activated protein kinases and induction of apoptosis. Carcinogenesis 2002, 23, 499. 53. Singh R.P., Agarval R.: Flavonoid antioxidant silymarin and skin cancer. Antiox. Redox Signal 2002, 4, 655. 54. Zi X., Agarval R.: Silybinin decrease prostate-specific antigen with cell growth inhibition via G1 arrest, leading to differentiation of prostate carcinoma cells: implications for prostate cancer intervention. Proc. Natl. Acad. Sci. USA 1999, 96, 7490. 55. Zi X., Zhang J., Agarval R. i wsp.: Sylibinin up-regulates insulin-like growth factor-binding protein 3 expression and inhibits proliferation of androgen-independent prostate cancer cells. Cancer. Res. 2000, 60, 5617. 56. Zhu W., Zhang J.S., Young Y.F.: Silymarin inhibits function of the androgen receptor by reducing nuclear localization of the receptor in the human prostate cancer cell line LNCaP. Carcinogenesis 2001, 22, 1399. 57. Thelen P., Jarry H., Ringert R.H. i wsp.: Silybinin down-regulates prostate epithelium-derived Ets transcription factor in LNCaP prostate cancer cells. Planta Med. 2004, 70, 397. 58. Jiang C., Agarwal R., Lu J.X.: Anti-angiogenic potential of a cancer chemopreventive flavonoid antioxidant silymarin; Inhibition of key attributes of vascular endothelial cells and angiogenic cytokine secretion by cancer epithelial cells. Biochem. Biophys. Res. Commun. 2000, 276, 371. 59. Gallo D., Giacomelli S., Ferlini C. i wsp.: Antitumor activity of the silybin-phosphatidylcholine complex IdB 1016 against human ovarian cancer. Eur. J. Cancer. 2003, 39, 2403. 60. Sharma G., Singh R.P., Chan D.C. i wsp.: Silybinin induces growth inhibition and apoptotic cell death in human lung carcinoma cells. Anticancer Res. 2003, 23, 2649. 61. Wellington K., Jarwis B.: Silymarin - a review of its clinical properties in the management of hepatic disorders. Bio. Drugs 2001, 15, 465. 62. Saller R., Meier R., Brignoli R.: The use of silymarin in the treatment of liver diseases. Drugs 2001, 61, 2035. 63. Venkataramanan R., Ramachandran V., Komoroski B.J. i wsp.: Milk Thistle a herbal supplement decreases the activity of CYP3A4 and uridine diphosphoglucuronosyl transferase in human hepatocyte cultures. Drug Metab. Dispos. 2000, 28, 1270. 64. Giacomelli S., Gallo D., Apollonio P. i wsp.: Sylibin and its bioavailable complex (IdB 1016) potentiate in vitro and in vivo the activity of cisplatin. Life Sci. 2002, 70, 1447. 65. Tyagi A.K., Agarwal C., Chan D.C.F., Agarval R.: Synergistic anti-cancer effects of silibinin with conventional cytotoxic agents doxorubicin, cisplatin and carboplatin against human breast carcinoma MCF-7 and MDA-MB468 cells. Oncol. Rep. 2003, 11, 493. 66. Singh R.P., Dhanalakshmi S., Tyagi A.K. i iwsp.: Dietary feeding of silibinin inhibits advance human prostate carcinoma growth in athymic nude mice and increases plasma insulin-like growth factor-binding protein-3 levels. Cancer Res. 2002, 62, 3063. 67. Singh R.P., Agarwal R.: Prostate cancer prevention by silibinin; Curr. Cancer Drug Targets 2004, 4, 1. 68. Dhanalakshmi S., Singh R.P., Agarwal C. i wsp.: Silibinin inhibits constitutive and TNF alpha-induced activation of NF-alpha B and sensitizes human prostate carcinoma DU 145 cells to TNF alpha-induced apoptosis. Oncogene 2002, 21, 1759. 69. Lahiri-Chatterjee M., Katiyar S.K., Mohan R.R., Agarwal R.: A flavonoid antioxidant, silymarin, affords exceptionally high protection against tumor promotion in the SENCAR mouse skin tumorigenesis model. Cancer. Res. 1999, 59, 622. 70. Singh R.P., Mallikarjuna G.U., Sharma G. i wsp.: Oral silibinin inhibits lung tumor growth in athymic nude mice and forms a novel chemocombination with doxorubicin targeting nuclear factor κB-mediated inducible chemoresistance. Clin. Cancer Res. 2004, 10, 8641. 71. Wilasrusmee C., Kittur S., Shah G. i wsp.: Immunostimulatory effect of Silybum marianum (milk thistle) extract. Med. Sci. Monit. 2002, 8, BR439.








