© Borgis - Postępy Nauk Medycznych 6/2010, s. 503-508
*Bogusława Baranowska, Wojciech Bik
Fizjologiczna rola adiponektyny
The physiological role of adiponectin
Zakład Neuroendokrynologii Klinicznej Centrum Medycznego Kształcenia Podyplomowego
p.o. Kierownika Zakładu: dr med. Wojciech Bik
Streszczenie
Adiponektyna – peptyd wydzielany przez komórki tłuszczowe, występuje we krwi w postaci trzech frakcji – izomerów różniących się masą cząsteczkową jako: frakcja niskocząsteczkowa (trimer) – LMW (low molecular weight), średniocząsteczkowa – heksamer MMW (middle molecular weight) oraz wysokocząsteczkowa – 12, 14 merów HMW (high molecular weight).
Adiponektyna wywiera nie tylko korzystny wpływ na metabolizm glukozy i tłuszczów, ale również ma bezpośrednie wazoprotekcyjne, antymiażdżycowe działanie na śródbłonek naczyń.
Obniżenie stężenia adiponektyny w surowicy obserwowano w otyłości, cukrzycy typu 2, nadciśnieniu tętniczym, chorobie wieńcowej, udarze mózgowym, a wysokie wartości adiponektyny notowano u ludzi długowiecznych. Wysokie wartości adiponektyny w tej grupie korelowały ze zmniejszonym występowaniem nadciśnienia tętniczego, cukrzycy, choroby wieńcowej i dyslipidemii.
W ostatnich latach opublikowano zaskakujące, kontrowersyjne wyniki badań wskazujące na to, że wysokie wartości adiponektyny mogą wiązać się z ryzykiem wyższej śmiertelności u ludzi starszych z chorobami układu krążenia. Jak można wyjaśnić te rozbieżności w wynikach badań, gdzie z jednej strony hiperadiponektynemia koreluje z długowiecznością, a z drugiej strony jest prognostycznym wskaźnikiem zwiększonej śmiertelności.
Wiele czynników może odgrywać rolę w mechanizmie podwyższenia stężenia adiponektyny u pacjentów z niewydolnością krążenia, między innymi zwiększona sekrecja adiponektyny przez kardiomiocyty, stymulowane przez BNP (brain natriuretic peptide), zaburzenia metabolizmu adiponektyny występujące u ludzi starszych oraz zaburzenia procesu multimeryzacji adiponektyny prowadzące do deficytu powstawania kardioprotekcyjnych form tego peptydu.
Adiponektyna wysokocząsteczkowa (HMW – high molecular weight) wywiera silniejsze działanie metaboliczne, kardioprotekcyjne i antymiażdżycowe niż całkowita adiponektyna (total adiponectin).
Tak więc HMW jest markerem stanu metabolicznego, a całkowita adiponektyna może być wskaźnikiem prognostycznym wyższej śmiertelności u ludzi starszych z chorobami układu krążenia.
Summary
Adiponectin is a peptide secreted by adipocytes.
Adiponectin circulates in three isoforms: a trimer (low molecular weight – LMW), a hexamer (middle molecular weight – MMW) and a multimeric high molecular weight (HMW).
In addition to the metabolic influence on metabolism of glucose and lipids, adiponectin reveals direct vasoprotective and antiatherogenic effects on endothelial cells.
It has been reported that in patients with obesity, diabetes, hypertension, stroke, coronary disease serum adiponectin concentrations were decreased. On the other hand, adiponectin levels were found to be increased in centenarians. High adiponectin levels in this group correlated with lower incidence of hypertension, diabetes, coronary disease and dyslipidemia.
The recent prospective studies concerning correlation between adiponectin and cardiovascular disease (CVD) mortality have demonstrated controversial results.
Some authors reported that adiponectin was not independently associated with future development of CVD, whereas others showed that high adiponectin levels were correlated with an increased risk of CVD and/or mortality. These results rise a question how it could be explained that there is a discrepancy in findings that hyperadiponectinemia correlates with longevity and on the contrary, is associated with higher mortality in patients with CVD.
Interestingly, many factors may be involved in the mechanism of an increase of adiponectin levels, eg. enhanced secretion of adiponectin by cardiomyocytes that is stimulated by BNP (brain natriuretic peptide), disturbed metabolism of adiponectin in older patients with CVD as well as changes in multimerization of adiponectin.
It has been reported that isomer of adiponectin, HMW, has more potent metabolic, insulin sensitizing and cardioprotective effects than LMW, MMW and total adiponectin.
It could be suggested that in CVD patients alterations in the process of adiponectin multimerization may lead to the deficiency of cardioprotective isoforms of adiponectin. Moreover, HMW isomer of adiponectin is a good marker of metabolic status, however total adiponectin is more useful to assess mortality risk in patients with CVD.

Adiponektyna – budowa, mechanizm działania
Adiponektyna jest peptydem wydzielanym przez komórki tkanki tłuszczowej, kodowanym przez gen ACDC (nazywanym APM1) umiejscowionym na długim ramieniu chromosomu 3, w locus 3q27 (1, 2).
Gen ACDC ulega ekspresji wyłącznie w tkance tłuszczowej, której ilość może ulegać zmianie w zależności od zmian w stanie energetycznym ustroju (3).
W regulacji ekspresji genu ACDC bierze udział szereg czynników jak insulina, chociaż jej rola nie jest w pełni wyjaśniona, IGF1, TNFα, glikokortykoidy, aktywacja układu β-adrenergicznego oraz aktywacja receptorów PPARγ (4, 5, 6, 7).
Adiponektyna została odkryta niezależnie przez 4 grupy badawcze i w związku z tym nosi również inne nazwy jak Acrp30, Adipo9, GBP28 (3, 8, 9, 10).
Adiponektyna jest syntetyzowanym w adipocytach białkiem złożonym z 244 aminokwasów. Po odcięciu części sygnałowej (17 aminokwasów) powstaje dojrzałe białko o masie 28kDa. Struktura białkowa składa się z dwóch części: domeny globularnej, której sekwencja jest podobna do sekwencji składowej dopełniacza – C1q, oraz domeny włóknistej – kolagenowej, która podobna jest do kolagenu typu VIII i X (3).
Budowa cząsteczki adiponektyny umożliwia dalszą multimeryzację. W adipocytach powstają trimery, które są wydzielane przez komórki adipocyta do krwiobiegu i ulegają dalszej multimeryzacji (3, 11, 12).
We krwi krążą 3 frakcje adiponektyny, różniące się masą cząsteczkową: niskocząsteczkowa frakcja – LMW (low molecular weight) – trimer, średniocząsteczkowa frakcja – MMW (middle molecular weight) – heksamer, wysokocząsteczkowa frakcja – HMW (high molecular weight) – 12-14 merów (12).
Mutacje w genie ACDC prowadzą do zmian w procesie multimeryzacji i mogą być przyczyną insulinooporności (13).
Adiponektyna wywiera swoje działanie poprzez receptor błonowy. Dwie isoformy receptora Adipo R1 i Adipo R2 różnią się umiejscowieniem genów i lokalizacją narządową (14). Gen Adipo R1 umiejscowiony jest na chromosomie 1 (1q32.1) i receptor AdipoR1 występuje głównie w mięśniach szkieletowych, w mniejszych ilościach w mózgu, sercu, nerce, wątrobie, łożysku, komórkach β trzustki, makrofagach. Gen Adipo R2 znajduje się na chromosomie 12 (12p13.33) a receptor AdipoR2 występuje głównie w wątrobie oraz w mięśniach szkieletowych.
Przekazywanie sygnału odbywa się głównie poprzez fosforylację kinaz: MAPK (kinazę białkową aktywowaną przez mitogeny), AMPK (kinazę białkową zależną od AMP) oraz aktywację jądrowego receptora PPARα (14).
Receptor Adipo R1 wykazuje większe powinowactwo do LMW adiponektyny, a Adipo R2 do MMW i HMW (14).
Fizjologiczna rola adiponektyny
Adiponektyna odgrywa istotną rolę w regulacji metabolizmu glukozy, lipidów, wpływa na kontrolę łaknienia, a ponadto wywiera silne działanie wazoprotekcyjne działając bezpośrednio na śródbłonek naczyń.
W mięśniach szkieletowych trimery i heksamery adiponektyny za pośrednictwem Adipo R1 stymulując aktywność AMPK i PPARα zwiększają wychwyt i utlenianie glukozy, a obniżenie aktywności acetylo-CoA (ACC) prowadzi do zwiększenia β-oksydacji kwasów tłuszczowych (14, 15, 16).
W wątrobie multimery adiponektyny (HMW) za pośrednictwem Adipo R2 zwiększając aktywność AMPK i PPARα obniżają glukoneogenezę, zmniejszają syntezę glukozy i zwiększają β-oksydację kwasów tłuszczowych (14, 15, 16).
Konsekwencją tego działania jest obniżenie zawartości triglicerydów w wątrobie i mięśniach szkieletowych oraz zwiększenie insulinowrażliwości.
Adiponektyna może odgrywać rolę w centralnej regulacji łaknienia. Wskazywać na to może wykrycie jej receptorów w podwzgórzu (17). Stymulacja Adipo R1 w podwzgórzu prowadzi do stymulacji łaknienia, ale podanie jednak dokomorowe adiponektyny u myszy powodowało spadek masy ciała w wyniku zwiększenia termogenezy (17).
Oprócz korzystnych efektów metabolicznych adiponektyna wywiera wazoprotekcyjne działanie bezpośrednio na śródbłonek naczyń.
Mechanizm wazoprotekcyjnego działania jest złożony (18). Adiponektyna prowadzi do wazodilatacji, hamowania ekspresji molekuł adhezyjnych, hamowania zapalnego działania cytokin prozapalnych (TNFα), zwiększenia produkcji tlenku azotu (NO), stymulacji angiogenezy, hamowania proliferacji i migracji komórek śródbłonka i komórek mięśni gładkich (18).
Adiponektyna, głównie jej frakcja HMW, wpływa protekcyjnie na wszystkie stadia rozwoju miażdżycy, a więc na czynność śródbłonka, tworzenie blaszki miażdżycowej pękanie blaszki i procesy zakrzepowe (19). Na rycinie 1 przedstawiono szczegółowy mechanizm antymiażdżycowego działania adiponektyny.
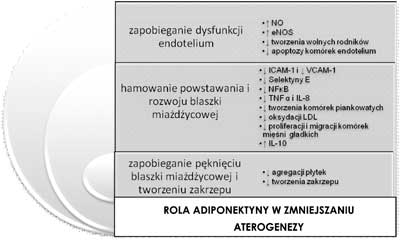
Ryc. 1. Wybrane mechanizmy antyaterogennego działania adiponektyny.
(Na podstawie Paul E. Szmitko et al.: AJP-Heart Circ Physiol. APRIL 2007 VOL 292: H1659 – modyfikacja własna).
Zmiany stężenia adiponektyny w surowicy
W licznych pracach wykazano ujemną korelację między stężeniem adiponektyny w surowicy a BMI (body mass index), insuliną, wskaźnikiem insulinooporności (HOMA), stężeniem triglicerydów, ciśnieniem tętniczym, a dodatnią korelację z wiekiem, oraz HDL (20, 21, 22, 23, 24, 25).
Obniżenie stężenia adiponektyny w surowicy obserwowano w otyłości, cukrzycy typu 2-go, nadciśnieniu tętniczym, chorobie wieńcowej, udarze mózgowym (26, 27, 28, 29, 30, 31).
Wzrost stężenia adiponektyny zanotowano w chorobach przebiegających ze spadkiem ciężaru ciała między innymi w anorexia nervosa, po leczeniu lekami z grupy agonistów PPARγ – (tiazolinedionów), w starszym wieku, u osób z niewydolnością nerek oraz u pacjentów z niewydolnością krążenia (32, 33, 34, 35).
Wielu autorów zwraca uwagę, że niskie stężenie adiponektyny w chorobach metabolicznych może stanowić zwiększone ryzyko wystąpienia ostrych zdarzeń sercowych lub udaru mózgowego (28, 36, 37, 38).
Mechanizm obniżonej sekrecji adiponektyny w nadciśnieniu tętniczym może wynikać z dysfunkcji śródbłonka i hamującego działania CRP na wydzielanie adiponektyny, zwiększonej aktywności układu sympatycznego i zwiększonej aktywności układu renina – angiotensyna – aldosteron (RAA) (27, 39, 40).
W badaniach genetycznych wykazano, że u pacjentów z genotypem TC polimorfizmu I164T genu adiponektyny występowały niższe stężenia adiponektyny w surowicy oraz częściej stwierdzano nadciśnienie tętnicze.
Adiponektyna – kontrowersje
Nasze poprzednie badania wykazały, że u ludzi długowiecznych – stulatków, stężenia adiponektyny w surowicy były wyższe niż w grupie ludzi poniżej 70. roku życia (41, 42). W grupie stulatków obserwowano rzadsze występowanie nadciśnienia tętniczego, cukrzycy, dyslipidemii czy insulinooporności. Arai i wsp. (43) stwierdzili, że wysokie wartości adiponektyny u stulatków korelowały ujemnie ze stężeniem CRP i selektyny w surowicy.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Maeda N, Takahashi M, Funahashi T et al.: PPARγ ligands increase expression and plasma concentrations of adiponectin, an adipose-derived protein. Diabetes 2001; 50: 2094-2099.
2. Saito K, Tobe T, Minoshima S et al.: Organization of the gene for gelatin-binding protein (GBP28) Gene 1999; 229: 67-73.
3. Maeda K, Okubo K, Shimomura I et al.: cDNA cloning and expression of a novel adipose specific collagen-like factor, apM1 (adipose most abundant gene transcript 1) Biochem Biophys Res. Commun 1996; 221: 286-289.
4. Fasshauer M, Klein J, Neumann S et al.: Adiponectin gene expression is inhibited by beta-adrenergic stimulation via protein kinase A in 3T3-L1 adipocytes. FEBS Lett 2001; 507: 142-146.
5. Halleux CM, Takahashi M, Delporte ML et al.: Secretion of adiponectin and regulation of apM1 gene expression in human visceral adipose tissue. Biochem. Biophys. Res Commun 2001; 288: 1102-1107.
6. Fasshauer M, Klein J, Neumann S et al.: Hormonal regulation of adiponectin gene expression in 3T3-L1 adipocytes. Biochem. Biophys. Res Commun 2002; 290: 1084-1089.
7. Spiegelman BM: PPAR-γ adipogenic regulator and thiazolinedione receptor. Diabetes 1998; 47: 507-514.
8. Hu E, Liang P, Spiegelman BM: AdipoQ is a novel adipose-specific gene dysregulation in obesity. J Biol Chem 1996; 271: 10697-10703.
9. Nakano Y, Tobe T, Choi-Miura NH et al.: Isolation and characterization of GBP28, a novel gelatin-binding protein purified from human plasma. J Biochem 1996; 120: 803-812.
10. Scherer PE, Williams S, Fogliano M et al.: A novel serum protein similar to C1q, produced exclusively in adipocytes. J Biol Chem 1995; 270: 26746-26749.
11. Tsao TS, Tomas E, Murrey HE et al.: Role of disulfide bonds in Acrp30/adiponectin structure and signaling specificity. Different oligomers activate different signal transduction pathways. J Biol Chem 2003; 278: 50810-50817.
12. Waki H, Yamauchi T, Kamon J et al.: Impaired multimerization of human adiponectin mutants associated with diabetes. Molecular structure and multimer formation of adiponectin. J Biol Ciol Chem 2003; 278: 40352-40363.
13. Karbowska J, Warczak E, Kochan Z: Adiponectin gene polymorphism and protein dysfunction In the development of insulin resistance. Postępy Hig Med Dośw 2004; 58: 449-457.
14. Yamauchi T, Kamon J, Ito Y et al.: Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature 2003; 423: 762-769.
15. Yamauchi T, Kamon J, Minokoshi Y Ito Y et al.: Adiponectin stimulates glucose utilization and fatty acid oxidation by activating AMP-activated protein kinase. Nat Med 2002; 8: 1288-1295.
16. Kadowaki T, Yamauchi T: Adiponectin and adponectin receptors. Endocrine Reviews 2005; 26: 439-451.
17. Qi Y, Takahashi N, Hileman SM et al.: Adiponectin acts in the brain to decrease body weight. Nat Med 2004; 10: 524-529.
18. Goldstein BJ, Scalia R: Adiponectin: A novel adipokine linking adipocytes and vascular function. J Clin Endocrinol Metab 2004; 89: 2563-8.
19. Szmitko PE, Teoh H, Stewart D, Verma S: Adiponectin and cardiovascular disease: state of the art? Am J Physiol Heart Circ Physiol 2007; 292: H1655-H1663.
20. Matsubara M, Maruoka S, Katayose S: Decreased plasma adiponectin concentrations in with dyslipidemia. J Clin Endocrinol Metab 2002; 87: 2764-2769.
21. Hotta K, Funahashi T, Bodkin NL et al.: Circulating concentrations of the adipocyte protein adiponectin are decreased in parallel with reduced insulin sensitivity during the progression to type 2 diabetes in rhesus monkeys. Diabetes 2001; 50: 1126-1133.
22. Diez JJ, Igiesias P: The role of the novel adipocyte-derived hormone adiponectin in human disease. Eur J Endocrinol 2003; 148: 293-300.
23. Ouchi N, Ohishi M, Kihara S et al.: Association of hypoadiponectinemia with impaired vasoreactivity. Hypertension 2003; 42: 231-234.
24.Yamamoto Y, Hirose H, Saito I et al.: Correlation of the adipocyte-derived protein adiponectin with insulin resistance index and serum high-density lipoprotein-cholesterol, independent of body mass index, in the Japanese population. Clin Sci 2002; 103: 137-142.
25. Baratta R, Amato S, Degano C et al.: Adiponectin relationship with lipid metabolism is independent of body fat mass: evidence from both cross-sectional and intervention studies. J Clin Endocrinol Metab 2004; 89: 2665-2671.
26. Daimon M, Oizumi T, Saitoh T et al.: Funagata study. Decreased serum levels of adiponectin are a risk factor for the progression to type 2 diabetes in the Japanese Population: the funagata study. Diabetes Care 2003; 26: 2015-20.
27. Iwashima Y, Katsuya T, Ishikawa K et al.: Hypoadiponectinemia is an independent risk factor for hypertension. Hypertension 2004; 43: 1318-23.
28. Chen MP, Tsai JC, Chung FM et al.: Hypoadiponectinemia is associated with ischemic cerebrovascular disease. Arterioscler Thromb Vasc Biol 2005; 25: 821-6.
29. Sakuta H, Suzuki T, Yasuda H, Ito T: Adiponectin levels and cardiovascular risk factors in Japanese men with type 2 diabetes. Endocr J 2005; 52: 241-4.
30. Rabin KR, Kamari Y, Avni I et al.: Adiponectin: linking the metabolic syndrome to its cardiovascular consequences. Expert Rev Cardiovasc Ther 2005; 3: 465-71.
31. Adamczak M, Wiecek A, Funahashi T et al.: Decreased plasma adiponectin concentration In patients with essential hypertension. Am J Hypertens 2003; 16: 72-5.
32. Banga A, Unal R, Tripathi P et al.: Adiponectin translation is increased by the PPARgamma agonists pioglitazone and omega-3 fatty acids. Am J Physiol Endocrinol Metab 2009; 296: E480-9.
33. Shen YY, Peake PW, Charlesworth JA: Review article: Adiponectin: its role in kidney disease. Nephrology 2008; 13: 528-34.
34. Isobe T, Saitoh S, Takagi S et al.: Influence of gender, age and renal function on plasma adiponectin level: the Tanno and Sobetsu study. Eur J Endocrinol 2005; 153: 91-98.
35. Tsutamoto T, Tanaka T, Sakai H et al.: Total and high molecular weight adiponectin, haemodynamics, and mortality in patients with chronic heart failure. Eur Heart J 2007; 28: 1723-1730.
36. Kumada M, Kihara S, Sumitsuji S et al.: Association of hypoadiponectinemia with coronary artery disease in men. Arterioscler Thromb Vasc Biol 2003; 23: 85-89.
37. Pischon T, Girman CJ, Hotamisligil GS et al.: Plasma adiponectin levels and risk of myocardial infarction in men. JAMA 2004; 291: 1730-1737.
38. Efstathiou SP, Tsioulos DI, Tsiakou AG et al.: Plasma adiponectin levels and five – year survival after first-ever ischemic stroke. Stroke 2005; 36: 1915-1918.
39. Vita JA, Keaney JF Jr: Endothelial function: a barometer for cardiovascular risk? Circulation 2002; 106: 640-642.
40. Massiera F, Bloch-Faure M, Ceiler D et al.: Adipose angiotensinogen is involved in adipose tissue growth and blood pressure regulation. FASEB J 2001; 15: 2727-2729.
41. Baranowska B, Bik W, Baranowska-Bik A et al.: Neuroendocrine control of metabolic homeostasis in Polish centenarians. J Physiol Pharmacol 2006; 6: 55-61.
42. Bik W, Baranowska-Bik A, Wolinska-Witort E et al.: The relationship between adiponectin levels and metabolic status in centenarian, Early elderly, young and obese women. Neuro Endocrinol Lett 2006; 27: 493-500.
43. Arai Y, Nakazawa S, Kojima T et al.: High adiponectin concentration and its role for longevity in female centenarians. Geriatr Gerontol Int 2006; 6: 32-39.
44. Dekker JM, Funahashi T, Nijpels G et al.: Prognostic value of adiponectin for cardiovascular disease and mortality. J Clin Endocrinol Metab 2008; 93: 1489-96.
45. Sattar N, Wannamethee G, Sarwar N et al.: Adiponectin and coronary heart disease: a prospective study and meta-analysis. Circulation 2006; 114: 623-9. Epub 2006 Aug 7. Erratum in: Circulation 2007; 115: e325.
46. Koenig W, Khuseyinova N, Baumert J et al.: Serum concentrations of adiponectin and risk of type 2 diabetes mellitus and coronary heart disease in apparently healthy middle-aged men: results from the 18-year follow-up of a large cohort from southern Germany. A Am Coll Cardiol 2006; 48: 1369-77.
47. Wolk R, Berger P, Lennon RJ et al.: Association between plasma adiponectin levels and unstable coronary syndromes. Eur Heart J 2007; 28: 292-8.
48. Cavusoglu E, Ruwende C, Chopra V et al.: Adiponectin is an independent predictor of all-cause mortality, cardiac mortality, and myocardial infarction in patients presenting with chest pain. Eur Heart J 2006; 27: 2300-9.
49. Laughlin GA, Barrett-Connor E, May S, Langenberg C: Association of adiponectin with coronary heart disease and mortality: the Rancho Bernardo study. Am J Epidemiol 2007; 165: 164-74.
50. Kistorp C, Faber J, Galatius S et al.: Plasma adiponectin, body mass index, and mortality in patients with chronic heart failure. Circulation 2005; 112: 1756-62.
51. Bik W, Baranowska B: Adiponectin – a predictor of higher mortality in cardiovascular disease or a factor contributing to longer life? Neuro Endocrinol Lett 2009; 30: 180-4.
52. Pineiro R, Iglesias MJ, Gallego R et al.: Adiponectin is synthesized and secreted by human and murine cardiomyocytes. FEBS Lett 2005; 576: 5163-9.
53. Ohara T, Kim J, Asakura M et al.: Plasma adiponectin is associated with plasma brain natriuretic peptide and cardiac function in healthy subjects. Hypertens Res 2008; 31: 825-31.
54. Pajvani UB, Du X, Combs TP et al.: Structure-function studies of the adipocyte-secreted hormone Acrp30/adiponectin. Implications for metabolic regulation and bioactivity. J Biol Chem 2003; 278: 9073-85.
55. Kissebah AH, Sonnenberg GE, Myklebust J et al.: Quantitative trait loci on chromosomes 3 and 17 influence phenotypes of the metabolic syndrome. Proc Natl Acad Sci USA 2000; 97: 14478-14483.
56. Hara K, Boutin P, Mori Y et al.: Genetic variation in the gene encoding adiponectin is associated with an increased risk of type 2 diabetes in the Japanese population. Diabetes 2002; 51: 536-540.
57. Sattar N, Nelson S: Adiponectin diabetes and coronary heart disease in older persons: unraveling the paradox. J Clin Endocrinol Metab 2008; 93: 3299-3301.
58. Kadowaki T, Yamauchi T, Kubota N et al.: Adiponectin and adiponectin receptors in insulin resistance, diabetes and the metabolic syndrome. J Clin Invest 2006; 116: 1784-92.
59. Kozakova M, Muscelli E, Flyvbjerg A et al.: Adiponectin and left ventricular structure and function in healthy adults. J Clin Endocrinol Metab 2008; 93: 2811-2818.
60. Seino Y, Hirose H, Saito I, Itoh H: High-molecular-weight adiponectin is a predictor of progression to metabolic syndrome: a population-based 6-year follow-up study in Japanese men. Metabolism Clin Exp 2009; 58: 355-360.
61. Kizer JR, Barzilay JI, Kuller LH, Gottdiener JS: Adiponectin and risk of coronary heart disease in older men and women. J Clin Endocrinol Metab 2008; 93: 3357-64.
62. Liang KW, Lee WJ, Lee WL et al.: Decreased ratio of high-molecular-weight to total adiponectin is associated with angiographic coronary atherosclerosis severity but not restenosis. Clin Chim Act 2009; 405: 114-118.
63. Baumann M, von Eynatten M, Dan L et al.: Altered molecular weight forms of adiponectin in hypertension. J Clin Hypertens 2009; 11: 11-6.
64. Kaser S, Tatarczyk T, Stadlmayr A et al.: Effect of obesity and insulin sensitivity on adiponectin isoform distribution. Eur J Clin Invest 2008; 38: 827-34.
65. Aguilar-Salinas CA, Garcia Garcia E, Roblem L et al.: High adiponectin concentrations are associated with the metabolically healthy obese phenotype. J Clin Endocrinol Metab 2008; 93: 4075-4079.

