© Borgis - Postępy Fitoterapii 1/2010, s. 23-29
Elżbieta Studzińska-Sroka, *Wiesława Bylka
Aktywność przeciwdrobnoustrojowa metabolitów wtórnych porostów
The antimicroorganisms activity of secondary lichen metabolites
Katedra i Zakład Farmakognozji, Uniwersytet Medyczny im. Karola Marcinkowskiego w Poznaniu
Kierownik Zakładu: prof. dr hab. Irena Matławska
Summary
Lichens grow in many different environments. Used by human beings for a long time, they produce chemical compounds of various structures and a multidirectional biological activity. The following study constitutes a literature review on antibacterial and antimycotic activities of the following substances produced by lichens: usnic acid, depsides, depsidones, antraquinones, vulpinic acid and protolichesterinic acid. Experiments have been carried out on standard strains as well as microorganisms isolated in clinical conditions frequently resistant to the normally administered antibiotics. In some cases the dependence between the compound structure and the type of the demonstrated activity has been taken into account. Compounds isolated from lichens have not found wider application in medical practice so far, yet the appearance of pathogens resistant to the medicine used induces the search for new substances of an antimicrobial activity.

Wstęp
Grzyby lichenizowane, gdyż tak nazywa się porosty w związku z rosnącą na ich temat wiedzą, to organizmy, których rozwój jest możliwy dzięki spotkaniu przez komórki grzyba odpowiedniego partnera glonowego. Wytwarzająca się w konsekwencji więź między dwoma komponentami jest splotem różnorodnych zależności, umożliwiających organizmowi przetrwanie. Uznawana obecnie definicja głosi, że porosty to stabilna samowystarczalna asocjacja mikobionta i fotobionta, w której mikobiont traktowany jest jako partner zewnętrzny (1).
Porosty zasiedlają niemal każde miejsce na Ziemi. Zamieszkując tereny trudno dostępne dla roślin, rozpoczynają „pochód przyrody” i dlatego mają znaczenie w procesie sukcesji. Liczbę występujących w przyrodzie gatunków określa się obecnie na około 20 tys. (2).
Walory porostów są cenione od dawna. W historii istnieją wzmianki o stosowaniu tych niewielkich organizmów jako pokarmu, leków na różne choroby czy barwników do barwienia tkanin (3). Wraz z rozwojem nauki odkryto, że właściwości porostów związane są z obecnością w ich plechach specyficznych związków chemicznych. Jedną z pierwszych otrzymanych substancji porostowych był kwas fumaroprotocetrarowy (rok 1826). Nieco później (rok 1844), miała miejsce izolacja kwasu usninowego. Na początku wieku XX znano już około 150 porostowych metabolitów wtórnych (4). Obecnie, dzięki wprowadzeniu nowych metod analitycznych, podnoszących jakość prac fitochemicznych, ich liczbę określa się na ponad 800 (5, 6).
Substancje porostowe charakteryzuje biogenetyczna różnorodność i niejednolita struktura. Determinuje to ich wielokierunkowe działanie biologicznie. Piśmiennictwo donosi o właściwościach: przeciwbakteryjnych, przeciwgrzybiczych, przeciwwirusowych, hamujących enzymy, przeciwnowotworowych, ale także niekorzystnych z punktu widzenia stosowania porostów w terapii, ich cechach alergogennych (7, 8).
Najwcześniej zainteresowano się przeciwdrobnoustrojową aktywnością porostów. Prowadzone eksperymenty potwierdziły biologiczną aktywność przygotowywanych z porostów wyciągów oraz pozyskiwanych z nich związków. Prawdopodobnie około 50% znanych gatunków zawiera substancje o działaniu przeciwbakteryjnym (6). Interesujące rezultaty badań zachęciły do podjęcia próby zebrania danych na temat właściwości przeciwdrobnoustrojowych porostowych metabolitów wtórnych. Zagadnienie to zostało przedstawione w poniższej pracy.
Kwas usninowy
Kwas usninowy to jeden z częstych metabolitów wtórnych porostów (9). Jest to żółty barwnik o strukturze dibenzofuranu, występujący w postaci dwóch enancjomerów różniących się usytuowaniem grupy metylowej w pozycji 9b (10) (ryc. 1). Rozpowszechnienie kwasu usninowego w wielu gatunkach porostów sprawiło, że stał się on przedmiotem licznych badań biologicznych, w tym również dotyczących aktywności przeciwdrobnoustrojowej (11).
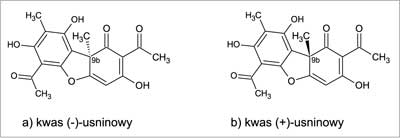
Ryc. 1. Kwas usninowy.
Jako jeden z pierwszych aktywność kwasu usninowego określił w 1946 roku Bargellini (4). W prowadzonych badaniach udowodnił, że związek ten hamował rozwój Staphylococcus aureus, Corynebacterium diphtheriae i Bacillus subtilis. Powyższa pochodna dibenzofuranu nie działała na bakterie Gram-ujemne. Kolejne prace na temat kwasu usninowego pojawiły się w roku 1947. Wyizolowany z Ramalina reticulata kwas (+)-usninowy, hamował wzrost bakterii z rodzajów Pneumococcus sp., Streptococcus sp., Staphylococcus sp., Mycobacterium tuberculosis. Okazało się, że M. tuberculosis hominis jest bardziej wrażliwy na działanie kwasu usninowego niż M. tuberculosis avium. W 1948 roku zainteresowanie rodziną Usneaceae zaowocowało izolacją tzw. ewozyny (ang. evosin), zidentyfikowanej później jako mieszanina kwasu ewerniowego i usninowego oraz dwóch nieznanych substancji. Ta kompozycja metabolitów porostowych wykazywała wysoką aktywność przeciwbakteryjną wobec Streptococcus sp., Staphylococcus sp., jak również M. tuberculosis. Ewozyna stosowana była lokalnie w Niemczech w chorobach skóry, m.in.: liszaju, czyrakach, czy gruźlicy skóry. Istnieją dane mówiące o jej skuteczności nie tylko w bakteryjnych problemach dermatologicznych przebiegających z udziałem bakterii, ale również w infekcjach wywołanych dermatofitami (np. Trichophyton). Do badań realizowanych w Europie i Stanach Zjednoczonych dołączyć trzeba prace naukowców japońskich. Shibata i wsp. (12) skupił się na aktywności biologicznej obu izomerycznych form kwasu usninowego: (+) i (-) oraz jego półsyntetycznych dihydro- i acetylopochodnych. Zauważył on właściwości przeciwbakteryjne związków mających w cząsteczce podwójne wiązanie, a także wolne grupy hydroksylowe.
Pojawienie się antybiotyków syntetycznych, które okazały się skutecznym lekiem na nękające ludność infekcje spowodowało, że zrezygnowano z prowadzonych w latach 50. prac. Z uwagi na niegasnący problem zakażeń bakteryjnych do badań powrócono później. Pod koniec lat 80. testowano aktywność kwasu usninowego na szczepach Streptococcus mutans, bakterii odpowiedzialnej za rozwój próchnicy. Wyniki badań wskazywały, że kwas (+)-usninowy, w 1% roztworze płynu do płukania ust, chronił przed rozwojem próchnicy i tworzeniem się kamienia nazębnego (9, 11). W innym eksperymencie zauważono, że kwas usninowy hamował rozwój Staphylococcus sp., Enterococcus sp. oraz niektórych bakterii beztlenowych. Okazało się, że wykazywał on aktywność nie tylko wobec zastosowanych szczepów wzorcowych, ale również w stosunku do S. aureus, E. faecalis, E. faecium wyizolowanych z materiału klinicznego (13). Prowadzono również badania sprawdzające aktywność kwasu usninowego na Mycobacterium sp. Uzyskane rezultaty świadczyły o hamującym wpływie in vitro obu enancjomerów na M. tuberculosis i M. tufu (11, 14, 15).
W roku 1998 Ingólfsdóttir i wsp. (16) opublikowała wyniki wskazujące na przeciwbakteryjne działanie kwasu (+)-usninowego wobec M. aurum, w stężeniu MIC = 32 ?g/ml. Kwas usninowy działał silniej od stosowanych w lecznictwie standardów (izoniazydu, rifampicyny, streptomycyny). Perry i wsp. (17) podjął próbę określenia aktywności biologicznej 69 rosnących w Nowej Zelandii gatunków porostów oraz 6-ciu wyizolowanych z nich czystych substancji, w tym kwasu usninowego. Testy przeprowadzone metodą dyfuzyjno-krążkową sugerowały działanie kwasu usninowego na B. subtilis, Candida albicans, Trichophyton mentagrophytes. Przy zastosowaniu niższych stężeń wrażliwy na działanie omawianego związku był tylko B. subtilis.
Kilka lat później podjęto badania, których wyniki wskazywały na skuteczność kwasu (+)-usninowego i jego soli sodowej wobec otrzymanych z fińskich szpitali opornych na metycylinę szczepów S. aureus (MRSA) oraz opornych na wankomycynę Enterococcus sp. (VRE) (18). Zauważono, że aktywność soli sodowej była wyższa niż wolnego kwasu, co według autorów miało prawdopodobnie związek z jego niższą rozpuszczalnością w użytym do eksperymentu DMSO. Wyniki badań na szczurach wykazały, że kwas (+)-usninowy jest dobrze absorbowany po podaniu doustnym. Dobra biodostępność oraz niskie wartości MIC czynią ten związek interesującym do testów, w których poszukuje się substancji skutecznych w leczeniu zagrażających życiu infekcji VRE. Stosowanie kwasu usninowego ogranicza jednak jego toksyczność (szczególnie hepatotoksyczność), której przypadki odnotowano podczas podawania go zwierzętom. Kwas usninowy powodował także utratę masy ciała oraz alergie.
Depsydy i depsydony
Wartościową grupą wtórnych metabolitów porostowych są depsydy i depsydony. Ich główny szkielet stanowią dwie lub więcej cząsteczki kwasów hydroksybenzoesowych połączone wiązaniem estrowym. Depsydony, występujące prawie wyłącznie w porostach, oprócz estrowego mają także eterowe wiązanie. Jego obecność zamyka otwartą strukturę depsydu, co stanowi różnicę między omawianymi grupami związków.
Substancją o strukturze depsydu, często obecną w plechach porostów, jest atranoryna (ryc. 2). Na przestrzeni lat wielokrotnie podejmowano temat jej antybiotycznych właściwości. Yilmaz i wsp. (19) zajął się badaniem przeciwbakteryjnej i przeciwgrzybiczej aktywności atranoryny wyizolowanej z Cladonia foliacea. Eksperyment przeprowadzono metodą krążkową, określając minimalne stężenie hamujące (MIC) wobec 107 komórek drobnoustrojów. Otrzymane wartości MIC wahały się w zależności od użytego szczepu od 15 do 500 ?g/krążek. Związek ten działał stosunkowo silnie na B. cereus, B. subtilis, Listeria monocytogenes, a także na Aeromonas hydrophila. Inne testowane szczepy cechowała słaba wrażliwość na zastosowane stężenia badanej substancji. Aktywność atranoryny wobec laseczek Gram-dodatnich z rodzaju Bacillus potwierdzili Rancović i wsp. (20). MIC określone podczas badań wynosiło 31 ?g/ml, podczas gdy dla stosowanej jako wzorzec streptomycyny było ono równe 7,81 ?g/ml. W tym samym eksperymencie badany depsyd wykazywał aktywność w stosunku do Escherichia coli, Klebsiella pneumoniae i S. aureus (MIC = 31 ?g/ml). W roku 1998 prowadzono prace wskazujące na brak istotnej aktywności atranoryny wobec M. aurum (MIC = 250 ?g/ml) (16). Aktywność na M. tuberculosis określona została dopiero niedawno i kształtowała się na podobnym poziomie (21).

Ryc. 2. Wzory strukturalne depsydów.
Interesujące jest działanie kwasu difraktowego na M. tuberculosis (ryc. 2). Depsyd, pomimo dużego podobieństwa w budowie do atranoryny, wykazywał znacznie wyższą od niej aktywność przeciwprątkową. Dla atranoryny wartość MIC wynosiła 250 ?g/ml, natomiast dla kwasu difraktowego była ona kilka razy niższa (MIC = 15,6 ?g/ml). Inny depsyd – kwas lekanorowy, różniący się od atranoryny brakiem grupy CHO- w pozycji 3 i CH3- w pozycji 3', okazał się mało aktywny (MIC = 250 ?g/ml) (21) (ryc. 2).
Ważne wydają się być wyniki prac Türk'a i wsp. (22), ukazujące różnice w działaniu atranoryny i jej chlorowej pochodnej (ryc. 2). Chloratranoryna, zawierająca w cząsteczce atom chloru, oprócz aktywności przeciwbakteryjnej wykazywała właściwości przeciwgrzybicze (drożdżaki i grzyby pleśniowe). Działania na komórki grzybów pleśniowych nie zaobserwowano w przypadku atranoryny. Różnica w aktywności przeciwdrobnoustrojowej obu związków wynikała prawdopodobnie z obecności atomu chloru w cząsteczce.
W tym samym eksperymencie przetestowano działanie innego depsydu, kwasu oliwetorowego (ryc. 2). Wykazywał on silniejsze właściwości antybiotyczne niż stosowana równolegle atranoryna. Szersze było również spektrum jego działania w porównaniu z chloratranoryną (aktywność wobec 12 w porównaniu z 9 wrażliwymi na chloratranorynę szczepami). Bakteriami o największej wrażliwości były B. subtilis, B. cereus, S. aureus, Yersinia enterocolitica. Kwas oliwetorowy działał najsłabiej na Salmonella typhimurium i E. coli. Jego aktywność wobec użytych w badaniach grzybów pleśniowych była niższa od aktywności chloratranoryny (22).
Kwas fyzodowy to depsydon, który od kwasu oliwetorowego różni się obecnością wiązania eterowego (ryc. 3). Związek ten nie wykazywał działania na stosowane w testach grzyby pleśniowe. Znacznie słabsze były też przeciwbakteryjne właściwości tej substancji. Sugerowano, że niższa aktywność miała związek z zamkniętą strukturą depsydonu. „Sztywność” kwasu fyzodowego, w odróżnieniu od zdolnej do rotacji wokół wiązania estrowego cząsteczki kwasu oliwetorowego, nie pozwalała cząsteczce wbudować się w specjalne „centrum inhibicji” zlokalizowane w komórkach grzybów (22).

Ryc. 3. Wzory depsydonów
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Czarnota P. Symbiozy porostowe w świetle interakcji pomiędzy grzybami i fotobiontami. Kosmos. Probl Nauk Biol 2009; 58:229-48. 2. Kozik R. To i owo o życiu porostów. Konspekt 2006; 26. http://www.wsp.krakow.pl/konspekt/26/index.php?i=010 3. Studzińska E, Witkowska-Banaszczak E, Bylka W. Związki biologicznie aktywne porostów. Herba Pol 2008; 54(1):80-8. 4. Ahmadijian VH, Hale ME. The Lichens. Academic Press, New York, 1977; 549. 5. Boustie J, Grube M. Lichens, a promising source of bioactive secondary metabolites. Plant Gen Res 2005; 3:273-87. 6. Candan M, Yilmaz M, Tay T i wsp. Antimicrobial activity of extracts of the lichen Parmelia sulcata and its salazinic acid constituent. Z Naturforsch C 2007; 62(7-8):619-21. 7. Müller K. Pharmaceutically relevant metabolites from lichens. Apll Microbiol Biotechnol 2001; 56:9-16. 8. Huneck S. The significance of lichens and their metabolites. Naturwiss 1999; 86:559-70. 9. Ingólfsdóttir K. Usnic acid. Phytochem 2002; 61:729-36. 10. De Carvalho EAB, Andrade PP, Silva NH i wsp. Effect of usnic acid from the lichen Cladonia substellata on Trypanosoma cruzi in vitro: an ultrastructural study. Micron 2006; 36:155-61. 11. Cocchietto M, Skert N, Nimis PL i wsp. A review on usnic acid, an interesting natural compound. Naturwiss 2002; 89:137-46. 12. Bustinza F. Antibacterial substances from lichens. Econ Bot 1952; 6:402-6. 13. Lauterwein M, Oethinger M, Belsner K i wsp. In vitro of the secondary metabolites: vulpinic acid, (+)-usnic acid, and (-)-usnic acid against Aerobic and Anaerobic microorganisms. Antimicrob Agents Chemother 1995; 39:2541-3. 14. Krishna DR, Venkataramana D. Pharmacokinetics of D-(+)-usnic acid in rabbits after intravenous and oral administration. Drug Metab Dispos 1992; 20:909-11. 15. Tay T, Türk AÖ, Yilmaz M i wsp. Evaluation of the antimicrobial activity of the acetone extract of the lichen Ramalina farinacea and its (+)-usnic acid, norstictic acid, and protocetraric acid constituents. Z Naturforsch C 2004; 59c:384-8. 16. Ingólfsdóttir K, Chung GAC, Skúlason VG i wsp. Antimycobacterial activity of lichen metabolites in vitro. Eur J Pharm Sci 1998; 6:141-4. 17. Perry NB, Benn MH, Brennan NJ i wsp. Antimicrobial, antiviral and cytotoxic activity of New Zealand lichens. Lichenologist 1999; 31(6):627-36. 18. Elo H, Matikaincn J, Pelttari E. Potent activity of the lichen antibiotic (+)-usnic acid against clinical isolates of vancomycin-resistant enterococci and methicillin-resistant Staphylococcus aureus. Naturwiss 2007; 94:465-8. 19. Yilmaz M, Türk A, Tay T i wsp. The antimicrobial activity of extracts of the lichen Cladonia foliacea and its (-)-usnic acid, atranorin, and fumarprotocetraric acid constituents. Z Naturfosch C 2004; 59c:249-54. 20. Rancović B, Mišić M, Sukdolak S. The antimicrobial activity of substances derived from the lichens Physcia aipola, Umbilicaria polyphylla, Parmelia caperata and Hypogymnia physodes. World J Microbiol Biotechnol 2008; 24:1239-42. 21. Honda NK, Pavan FR, Coelho RG i wsp. Antimycobacterial activity of lichen substances. Phytomed 2009; 13. 22. Türk H, Yilmaz M, Tay T i wsp. Antimicrobial activity of extracts of chemical races of thelichen Pseudevernia furfuracea and their physodic acid, chloroatranorin, atranorin and olivetoric acid constituents. Z Naturfosch C 2006; 61c:499-507. 23. Kohlmünzer S. Farmakognozja. Podręcznik dla studentów farmacji. PZWL, Warszawa 2007; 257. 24. Manojlović N, Solujić S, Sukdolak S. Antimicrobial activity of an extract and anraquinones from Caloplaca schaereri. Lichenologist 2002; 34(1):83-5. 25. Manojlović N, Solujić S, Sukdolak S i wsp. Isolation and antimicrobial activity of antraquinones from some species of the lichen genus Xanthoria. J Serb. Chem Soc 2000; 65(8):555-60. 26. Türk AÖ, Yimaz M, Kivanç M iwsp. The antimicrobial activity of extracts of the lichen Cetraria aculeata and its protolichesterinic acid constituent. Z Naturforsch C 2003; 58c:850-4. 27. Ingólfsdóttir K, Hjalmarsdottir M, Sigurdsson A i wsp. In vitro susceptilibility of Helicobacter pylori to protolichesterinic acid from the lichen Cetraria islandica. Antimicrob Agents Chemother 1997; 41(1):215-7.



