© Borgis - Nowa Medycyna 3/2013, s. 130-134
*Katarzyna Drabczyk, Mirosława Püsküllüo?lu
Advexin – przykład zastosowania terapii genowej w onkologii
Advexin – an example of gene therapy application in oncology
Klinika Onkologii, Szpital Uniwersytecki, Kraków
Kierownik Kliniki: dr hab. n. med. Krzysztof Krzemieniecki
Summary
Advexin is a vaccine containing a copy of wild-type p53 gene. This gene codes p53 protein, which leads cells with defective genome to apoptosis. Advexin was devised to treat people suffering from a rare Li-Fraumeni syndrome. The disease is caused by gene p53 mutation and for that reason people suffering from this syndrome have 25 times higher risk of neoplasms. By 2008, 14 experiments have been conducted with the use of Advexin: 11 with monotherapy and remaining 3 with chemiotherapy, or radiotherapy. However, due to numerous objections, mainly relating to the lack of evidence for therapy’s effectiveness, drug was approved only in China.
A role of p53 in carcinogenesis and using it for gene therapy purposes are current topics among scientists dealing with human cancers’ treatment. On one hand, new discoveries bring us closer to create both effective and selective treatment methods. On the other hand, they help us realize how unbelievable complicated the cancer transformation is. The gene therapy develops very quickly and undoubtedly it becomes a part of future cancer-treating strategy. The therapy that would direct cancer cells to apoptotic pathway could stop, or at least reduce, the growth of almost all types of cancers.
The role of p53 protein as well as the action, therapeutic potential, clinical trials’ data concerning Advexin and potential directions for its future use are presented.

Czym jest Advexin i co zawiera?
Advexin jest szczepionką w postaci zawiesiny, zawierającą contusugene ladenovec. Jest to genetycznie zmodyfikowany, nienamnażający się adenowirus typu 5, który służy za wektor dostarczający do komórek rakowych prawidłową kopię genu p53. Adenowirusy znalazły zastosowanie w terapii genowej ze względu na swoje liczne zalety. Temat dotyczący nośników adenowirusowych został dokładniej omówiony poniżej.
W skład kasety ekspresyjnej zawartej w Advexinie wchodzą:
– „dzika”, prawidłowa kopia genu p53,
– kierujący transkrypcją transgenu wczesny promotor cytomegalowirusa, który został umieszczony w miejscu usuniętego wcześniej regionu E1,
– sygnał poliadenylacji, warunkujący powstanie tzw. „ogonka poliA”, będącego ciągiem reszt adeninowych, który chroni powstały transkrypt przed degradacją (1-4).
Ochronna rola białka p53
Funkcja białka p53 od ponad 30 lat pozostaje przedmiotem zainteresowania naukowców zajmujących się problematyką chorób nowotworowych (5). Pierwszych odkryć dokonano podczas badań na zwierzęcych nowotworach wywołanych przez wirusy. Zauważono wtedy, że w komórkach nowotworowych jest znacznie więcej białka p53 niż w prawidłowej hodowli oraz że komórki transformowane wytwarzały przeciwciała przeciwko p53 (6). Początkowo powyższe spostrzeżenia doprowadziły do postawienia tezy, że gen p53 jest onkogenem. Wraz z upływem czasu pojawiały się jednak kolejne odkrycia, które zaprzeczały początkowej hipotezie i dostarczały dowodów na ochronną funkcję omawianego białka (7).
Gen kodujący białko p53 zlokalizowany jest na krótkim ramieniu chromosomu 17 (17p13) (8). Białko p53 charakteryzuje się złożoną budową, co w pewien sposób odzwierciedla zawiłość ścieżek sygnalizacyjnych zależnych od tego białka. Ludzkie białko p53 zawiera 7 domen (9). Funkcje poszczególnych domen oraz ich lokalizacja zostały przedstawione w tabeli 1. P53 należy do małej rodziny powiązanych ze sobą białek obejmującej także p63 i p73 (10). Wyróżniamy dwie formy białka p53. Jedną z nich jest fizjologiczne, niezmienione białko, określane jako „zdrowe” lub „dzikie”. Drugi typ natomiast reprezentowany jest przez białko powstające na drodze mutacji genu p53 i jest to tzw. białko „zmutowane”, pozbawione właściwości supresorowych (11). Białko p53 znajduje się w jądrze komórki, gdzie wiążąc się z kwasem deoksyrybonukleinowym, kontroluje transkrypcję różnych genów, ma wpływ na apoptozę, syntezę kwasu
deoksyrybonukleinowego (ang. deoxyribonucleic acid – DNA), a także poprzez regulację procesu duplikacji centrosomów ma znaczenie w utrzymaniu diploidalnego genomu komórek (12). Aktywacja p53 zachodzi pod wpływem wielu różnych czynników, takich jak promieniowanie UV (Ultraviolet), X, gamma, hipoksja, zmiany temperatury i potencjału redoks, delecja nukleotydu, a także zmiana w budowie czynników wzrostowych oraz mikrotubul (13, 14). Białko p53, które w normalnych warunkach ma bardzo krótki okres półtrwania (około 20 minut), w odpowiedzi na uszkodzenie DNA ulega stabilizacji. W wyniku tego następuje wzrost ilości białka p53, a następnie, w zależności od miejsca wiązania do DNA, pobudzenie ekspresji docelowych genów (12). Powstałe białka wywołują odpowiedzi adekwatne do sytuacji w komórce. Może to być indukcja procesu apoptozy, zatrzymanie cyklu komórkowego i naprawa błędu lub naprawa uszkodzonego DNA. To właśnie p53 decyduje, jak znaczne są zmiany w komórce, czy komórka jest w stanie naprawić te zmiany, czy też jedynym wyjściem jest apoptoza.
Tabela 1. Funkcja i lokalizacja poszczególnych domen białka p53 (9).
| Domena | Funkcja | Reszty aminokwasowe |
| AD1 (ang. activation domain 1) | aktywacja transkrypcji | 1-42 (N-koniec) |
| AD2 (ang. activation domain 2) | aktywność apoptyczna białka p53 | 43-63 |
| PRD (ang. proline rich domain) | aktywność apoptyczna białka p53 | 64-91 |
| DBD (ang. DNA binding domain) | powinowactwo do konsensusowych sekwencji DNA | 100-300 |
| Domena sygnalizacyjna | warunkuje jądrową lokalizację białka p53 | 316-325 |
| TD (ang. tetramerization domain) | tetrameryzacja białka p53 niezbędna do aktywności in vivo | 334-356 |
| BD (ang. basic domain) | regulacja wiązania przez domenę centralną p53 | 364-393 (C-koniec) |
Badania wykazały, że w większości komórek nowotworowych p53 jest nieaktywne, co powoduje zaburzenie homeostazy w organizmie i skutkuje możliwością progresji nowotworu (3). Istnieje kilka sposobów na dezaktywację białka p53 w komórkach. Mechanizm ten został w skrócie przedstawiony na rycinie 1.
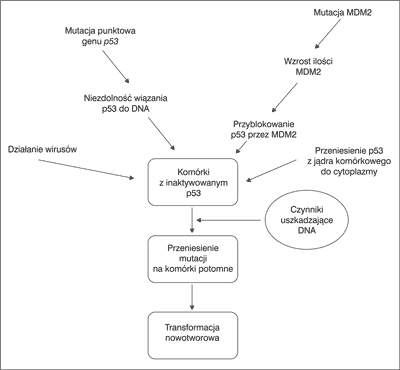
Ryc. 1. Mechanizmy inaktywacji białka p53 w komórce (10, 12).
Zastosowanie adenowirusów
w preparacie Advexin
DNA sam nie wnika do komórek. Wynika to z faktu, że jest naładowany ujemnie, podobnie jak powierzchnia błony komórkowej. Z tego powodu, aby wprowadzić DNA do komórki, trzeba zastosować techniki wprowadzania kwasów nukleinowych, które można podzielić na trzy grupy:
– techniki elektryczne,
– techniki mechaniczne,
– techniki z użyciem odpowiednich wektorów (15).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Chada S, Menander KB, Bocangel D et al.: Cancer targeting using tumor suppressor genes. Front Biosci 2008; 13: 1959-1967. 2. Senzer N, Nemunaitis J: A review of contusugene ladenovec (Advexin) p53 therapy. Curr Opin Mol Ther 2009; 11: 54-61. 3. Senzer N, Nemunaitis J, Nemunaitis M et al.: p53 therapy in a patient with Li-Fraumeni syndrome. Mol Cancer Ther 2007; 6: 1478-1482. 4. Nemunaitis JM, Nemunaitis J: Potential of Advexin: a p53 gene-replacement therapy in Li-Fraumeni syndrome. Future Oncol 2008; 4: 759-768. 5. Cahilly-Snyder L, Yang-Feng T, Francke U, George DL: Molecular analysis and chromosomal mapping of amplified genes isolated from a transformed mouse 3T3 cell line. Somat Cell Mol Genet 1987; 13: 235-244. 6. Lane DP, Crawford LV: T antigen is bound to a host protein in SV40-transformed cells. Nature 1979; 278: 261-263. 7. Finlay CA, Hinds PW, Levine AJ: The p53 proto-oncogene can act as a suppressor of transformation. Cell 1989; 57: 1083-1093. 8. Ara S, Lee PSY, Hansen MF, Saya H: Codon 72 polymorphism of the TP53 gene. Nucleic Acids Res 1990; 18: 4961. 9. Harms KL, Chen X: The C terminus of p53 family proteins is a cell fate determinant. Mol Cell Biol 2005; 25: 2014-2030. 10. Vousden KH, Lu X: Live or let die: the cell’s response to p53. Nature Reviews Cancer 2002; 2: 594-604. 11. Prives C, Hall PA: The p53 pathway. J Pathol 1999; 187: 112-126. 12. Stachura J, Domagała W: Nowotwory. [W:] Michalewicz M: Patologia znaczy słowo o chorobie. Polska Akademia Umiejętności, Kraków 2008: 209-211. 13. Zeng X, Keller D, Wu L, Lu H: UV but not gamma irradiation accelerates p53-induced apopotosis in teratocarcinoma cells by repressing MDM2 transcription. Cancer Res 2000; 60: 6184-6188. 14. Bálint EE, Vousden KH: Activation and activities of the p53 tumour suppressor protein. Br J Cancer 2001; 85: 1813-1823. 15. Patil SD, Rhodes DG, Burgess DJ: DNA-based Therapeutics and DNA Delivery Systems: A Comprehensive Review. The AAPS Journal 2005; 7: 61-77. 16. Amalfitano A: Utilization of adenovirus vectors for multiple gene transfer applications. Methods 2004; 33: 173-178. 17. Russell WC: Update on adenovirus and its vectors. J Gen Virol 2000; 81: 2573-2604. 18. Yeh P, Perricaudet M: Advances in adenoviral vectors: from genetic engineering to their biology. FASEB J 1997; 11: 615-623. 19. Amalfitano A, Parks RJ: Separating fact from fiction: assessing the potential of modified adenovirus vectors for use in human gene therapy. Curr Gene Ther 2002; 2: 111-133. 20. Chuah MK, Collen D, Vanden-Driessche T: Biosafety of adenoviral vectors. Curr Gene Ther 2003; 3: 527-543. 21. Yang Y, Nunes FA, Berencsi K et al.: Cellular immunity to viral antigens limits E1-deleted adenoviruses for gene therapy. Proc Natl Acad Sci USA 1994; 91: 4407-4411. 22. Wilson RF: The death of Jesse Gelsinger: new evidence of the influence of money and prestige in human research. Am J Law Med 2010; 36: 295-325. 23. Brower V: Cancer gene therapy steadily advances. J Natl Cancer Inst 2008; 100: 1276-1278. 24. Upton B, Chu Q, Li BD: Li-Fraumeni syndrome: the genetics and treatment considerations for the sarcoma and associated neoplasms. Surg Oncol Clin N Am 2009; 18: 145-156. 25. Guangyu M, Shimada H, Hiroshima K et al.: Gene medicine for cancer treatment: Commercially available medicine and accumulated clinical data in China. Drug Des Devel Ther 2008; 2: 115-122. 26. INGN 201: Ad-p53, Ad5CMV-p53, Adenoviral p53, p53 gene therapy – Introgen, RPR/INGN 201. Drugs RD 2007; 8: 176-187. 27. Yoo GH, Moon J, Leblanc M et al.: A phase 2 trial of surgery with perioperative INGN 201 (Ad5CMV-p53) gene therapy followed by chemoradiotherapy for advanced, resectable squamous cell carcinoma of the oral cavity, oropharynx, hypopharynx, and larynx: report of the Southwest Oncology Group. Arch Otolaryngol Head Neck Surg 2009; 135: 869-874. 28. Shimada H, Matsubara H, Shiratori T et al.: Phase I/II adenoviral p53 gene therapy for chemoradiation resistant advanced esophageal squamous cell carcinoma. Cancer Sci 2006; 97: 554-561. 29. Wolf JK, Bodurka DC, Gano JB et al.: A phase I study of Adp53 (INGN 201; ADVEXIN) for patients with platinum – and paclitaxel-resistant epithelial ovarian cancer. Gynecol Oncol 2004; 94: 442-448. 30. Withdrawal assessment report for Advexin inn: contusugene ladenovec Procedure No. EMEA/H/C/919. Doc. Ref: EMEA/692328/2008. 31. Sakai R, Kagawa S, Yamasaki Y et al.: Preclinical evaluation of Differentially Targeting Dual Virotherapy for Human Solid Cancer. Mol Cancer Ther 2010; 9: 1884-1893. 32. Huang PI, Chang JF, David H et al.: Targeted genetic and viral therapy for advanced head and neck cancers. Drug Discov Today 2009; 14: 570-578. 33. INGN 201: Ad-p53, Ad5CMV-p53, Adenoviral p53,INGN 101, p53 gene therapy – Introgen, RPR/INGN 201. Biodrugs 2003; 17: 216-222. 34. Peng Z, Yu Q, Bao L: The application of gene therapy in China. Drugs 2008; 11: 346-350. 35. Shi J, Zheng D: An update on gene therapy in China. Curr Opin Mol Ther 2009; 11: 547-553. 36. Wallraven G, Nemunaitis JJ, Maples PB: Compassionate approval process for experimental gene-based products. J Clin Oncol 2008; 26: 1899-1900.


