© Borgis - Nowa Pediatria 4/2014, s. 145-149
*Agata Bojdo1, Anna Tarasiuk1, 2, Paweł Łaguna3, Monika Pohorecka4, Jacek Witwicki1, Marzena Dębska2
Leczenie małopłytkowości w okresie noworodkowym – fakty i wątpliwości
Treatment of thrombocytopenia in the neonatal period – the facts and doubts
1Oddział Neonatologii, Samodzielny Publiczny Zakład Opieki Zdrowotnej, Szpital Bielański, Warszawa
Kierownik Oddziału: dr n. med. Jacek Witwicki
2II Klinika Ginekologii i Położnictwa, Centrum Medyczne Kształcenia Podyplomowego, Warszawa
Kierownik Kliniki: prof. Romuald Dębski
3Klinika Pediatrii, Hematologii i Onkologii, Warszawski Uniwersytet Medyczny
Kierownik Kliniki: prof. Michał Matysiak
4Oddział Chorób Dziecięcych i Noworodkowych, Centralny Szpital Kliniczny MSW, Warszawa
Kierownik Oddziału: dr n. med. Adam Sybilski
Summary
The authors present the current state of knowledge on the causes, consequences and treatment of thrombocytopenia in the neonatal period. They show the relationship causes of thrombocytopenia with time of its occurrence and maturity of the afflicted newborn child. They also discussed the possibilities and limitations of thrombocytopenia therapy. The essence, quiddity of this publication is to show the difficulty in qualifying for supplementary transfusion of platelets in the absence of evidence of its effectiveness and reports of possible complications.
A preventive and symptomatic transfusion was distinguished, emphasizing the lack of evidence to the causality of the platelet count with the appearing of actual clinical bleeding. The authors noted changes in recommendations designed to reduce the number of platelets as an indication for the adjuvant therapy. They presented and discussed recommendations developed by BCSH (British Committees for Standards in Haematology) in 2004. It was stressed that most of these recommendations were based on the experience and opinions of the experts.

Wstęp
Zaburzenia krzepnięcia mogą wynikać z upośledzonej hemostazy pierwotnej (zaburzenia liczby i/lub funkcji płytek krwi i/lub budowy i funkcji naczyń krwionośnych) lub wtórnej (niedoboru lub nieprawidłowej czynności czynników krzepnięcia).
W okresie noworodkowym na zaburzenia krzepnięcia dodatkowo ma wpływ przemijający deficyt czynników zależnych od witaminy K, tj. II, VII, IX, X oraz białek C i S. U wszystkich pacjentów niekorzystny wpływ na stężenie czynników krzepnięcia może mieć zarówno choroba (infekcja, wstrząs, patologie wątroby), jak i prowadzone leczenie (żywienie parenteralne, antybiotykoterapia, leczenie fenobarbitalem, cewniki umieszczone w dużych naczyniach, ECMO).
Konsekwencją zaburzeń krzepnięcia może być krwawienie o różnym nasileniu i lokalizacji. Jednym z najczęściej występujących zaburzeń w hemostazie w okresie noworodkowym jest obniżenie liczby płytek, czyli małopłytkowość (trombocytopenia).
Epidemiologia, klasyfikacja i etiologia
Małopłytkowość występuje u 1-5% noworodków, a wśród pacjentów oddziałów intensywnej terapii noworodka dotyczy nawet 22-35% przypadków. Częstość występowania jest odwrotnie proporcjonalna do wieku ciążowego. Rozpoznaje się ją, gdy liczba płytek krwi jest mniejsza od 100 tys. w ul. W większości przypadków ma przebieg łagodny lub umiarkowany, jednak u 5-10% rozwija się ciężka postać małopłytkowości, gdy liczba płytek krwi jest mniejsza niż 50 tys. w ul.
Klasyfikacja małopłytkowości według czasu jej wystąpienia wydaje się znacznie bardziej naturalna i pomocna dla ustalenia etiologii niż wcześniej proponowany podział, którego kryterium porządkującym była przyczyna małopłytkowości. W nowej klasyfikacji wyróżnia się małopłytkowość płodu, wczesną, występującą przed 72. godziną życia, i późną, stwierdzaną po 72. godzinie życia (1-4).
Wczesna małopłytkowość najczęściej ma przebieg łagodny lub umiarkowany, jest samoograniczająca się i ustępuje zwykle w ciągu 10 dni. Najczęściej jest ona spowodowana czynnikami prenatalnymi i matczynymi, np. przewlekłą hipoksją wewnątrzmaciczną ograniczającą megakariopoezę (niewydolność łożyska, nadciśnienie indukowane ciążą, cukrzyca ciężarnych), niedotlenieniem okołoporodowym, infekcją wewnątrzmaciczną i okołoporodową. Do małopłytkowości mogą prowadzić infekcje zarówno wirusowe, np. cytomegalia, wirusy Coxsackie, HIV, jak i bakteryjne, m.in. bakteryjne zakażenia o wczesnym początku.
Rzadziej występujące małopłytkowości wczesne to allo- i autoimmunologiczne, uwarunkowane genetycznie zespoły, np. Wiskotta-Aldricha, anemia Fanconiego, zespół TAR, aneuploidie (trisomia 13,18 czy 21 pary chromosomów) oraz kwasice metaboliczne w okresie dekompensacji, tj. propionowa czy metylomalonowa.
Małopłytkowość u noworodków urodzonych o czasie rozpoznawana jest rzadziej niż u noworodków urodzonych przedwcześnie i najczęściej ma charakter immunologiczny (1, 3, 4) (ryc. 1). W małopłytkowości immunologicznej przeciwciała z krwiobiegu matki przechodzą przez barierę łożyskową i niszczą płytki krwi płodu oraz hamują ich produkcję w szpiku kostnym. Alloimmunologiczna małopłytkowość płodu (AIMP) jest spowodowana niezgodnością w zakresie swoistych antygenów płytkowych krwi (ang. Human Platelet Antigen – HPA) między ciężarną kobietą i jej dzieckiem. Konsekwencją różnicy antygenowej jest wytwarzanie przez matkę przeciwciał w klasie IgG skierowanych przeciwko HPA, które płód odziedziczył po ojcu (5). Konflikt płytkowy może wystąpić już w pierwszej ciąży (5, 6). Swoiste antygeny płytkowe są zlokalizowane na glikoproteinach błony komórkowej krwinek płytkowych i około 16. tygodnia ciąży osiągają dojrzałość oraz zdolność prezentacji (5, 7, 8). W efekcie dochodzi do aktywacji odpowiedzi immunologicznej matki i produkcji przeciwciał przeciwpłytkowych. Konsekwencją tego procesu jest niszczenie krwinek płytkowych płodu i około 24. tygodnia ciąży wystąpienie małopłytkowości (5). W kolejnych ciążach powikłanych konfliktem płytkowym należy spodziewać się wcześniejszej immunizacji oraz podobnego lub większego nasilenia objawów choroby, szczególnie wtedy, gdy u starszego rodzeństwa występowała ciężka małopłytkowość, powikłana wylewem wewnątrzczaszkowym (ang. intracranial haemorrhage – ICH) (6-8). ICH występuje w około 20% przypadków AIMP/N (alloimmunologiczna małopłytkowość płodu/noworodka) i aż w 80% dochodzi do niego wewnątrzmacicznie (5-7). Krwawienie ma charakter wylewu do miąższu mózgu, w przeciwieństwie do nieimmunologicznych małopłytkowości, gdzie obserwowane są wylewy okołodokomorowe (7). Typowym obrazem ultrasonograficznym w AIMP/N jest porencefalia. Po urodzeniu, największe ryzyko krwawień występuje w ciągu pierwszych 96 godzin życia i związane jest z postępującym zmniejszaniem liczby płytek. Różna jest manifestacja objawów klinicznych małopłytkowości u noworodka. Najczęściej obserwowane są: wybroczyny i wylewy podskórne, krwiaki, krwawienia z przewodu pokarmowego, wylewy do innych narządów, jak również przypadki bez objawów. Stopniowa i samoistna normalizacja liczby płytek u noworodka następuje w ciągu pierwszych 2-3 tygodni życia (6, 8). W małopłytkowości autoimmunologicznej przeciwciała z krwiobiegu matki są skierowane przeciwko antygenom płytkowym matki i dziecka. Choroba może objawiać się małopłytkowością zarówno u matki, jak i u dziecka. Takie przeciwciała przeciwpłytkowe występują w samoistnej, autoimmunologicznej małopłytkowości matki (ITP), w zespole antyfosfolipidowym, w toczniu układowym, kolagenozach, w chorobach tarczycy, jak również w ciąży powikłanej cukrzycą, nadciśnieniem tętniczym, stanem przedrzucawkowym (9, 10). Objawy autoimmunologicznej małopłytkowości są łagodniej wyrażone w porównaniu z AIMP/N. Ciężka małopłytkowość u noworodka występuje w około 10% przypadków, a ICH w 0-1,5%. Najwięcej krwawień dokonuje się w pierwszych 24-48 godzinach życia (9, 10). Małopłytkowość późna, występująca po trzeciej dobie życia, w 80% jest spowodowana infekcjami bakteryjnymi i/lub obumierającym zapaleniem jelit (ryc. 2). Wśród innych przyczyn wymienia się: choroby metaboliczne, zespoły (TAR, Kasabacha-Merritt), małopłytkowość autoimmunologiczną. Rozwija się szybko, zwykle jest to postać ciężka i trwa nawet kilka tygodni. Może być następstwem zahamowania produkcji płytek przez wyrzut cytokin prozapalnych i zwiększonym ich zużyciem w przebiegu wykrzepiania wewnątrznaczyniowego (DIC). Istotą DIC jest uogólniona aktywacja krzepnięcia krwi z wytworzeniem dużej ilości fibryny, która wiąże płytki krwi i formuje zakrzepy blokujące przepływ krwi w drobnych naczyniach krwionośnych, prowadząc do niedokrwiennego uszkodzenia wielu narządów (11).
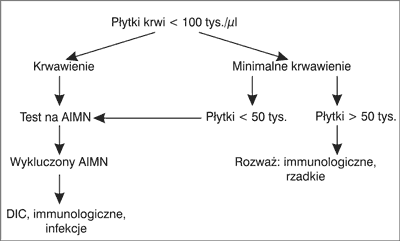
Ryc. 1. Algorytm diagnostyczny małopłytkowości u noworodków donoszonych (4).
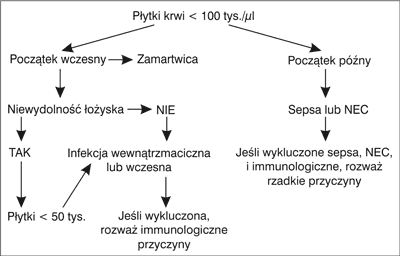
Ryc. 2. Algorytm diagnostyczny małopłytkowości u noworodków urodzonych przedwcześnie (4).
U chorych dzieci urodzonych przedwcześnie małopłytkowość może współistnieć z chorobami wątroby lub zapalnymi zmianami w śródbłonku, co dodatkowo zaburza hemostazę (1, 3, 4).
Leczenie małopłytkowości
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Roberts I, Stanworth S, Murray NA: Thrombocytopenia in the neonate. Blood Review 2008; 22: 173-186. 2. Murray NA, Roberts IAG: Neonatal transfusion practice Arch Dis Child Fetal Neonatal Ed 2004; 89: 101-107. 3. Stanworth SJ: Thrombocytopenia, bleeding, and use of platelet transfusions in sick neonates. ASH Education Book 2012; 1: 512-516. 4. Chakravorty S, Roberts I: How I manage neonatal thrombocytopenia. British Journal of Hematology 2012; 156: 155-162. 5. Mcquilten ZK, Wood EM, Savoia H, Cole S: A review of pathophysiology and current treatment for neonatal alloimmune thrombocytopenia (NAIT) and introducing the Australian NAIT registry. Australian and New Zealand Journal of Obstetrics and Gynaecology 2011; 51: 191-198. 6. Peterson JA, McFarland JG, Curtis BR, Aster RH: Neonatal alloimmune thrombocytopenia: pathogenesis, diagnosis and management. Br J Haematol 2013; 161(1): 3-14. 7. Espinoze JP, Caradeux J, Norwitz ER, Manes SE: Fetal and neonatal alloimmune thrombocytopenia. Rev Obstet Gynecol 2013; 6(1): 15-21. 8. Risson DC, Davies MW, Willians BA: Review of neonatal alloimmune thrombocytopenia. Journal of Paediatrics and Child Health 2012; 48: 816-822. 9. Gernsheimer T, James AH, Stasi R: How I treat trombocytopenia in pregnancy. Blood 2013; 121(1): 38-47. 10. Gernsheimer TB: Thrombocytopenia in pregnancy: is this immune thrombocytopenia? Hematology Am Soc Hematol Educ Program 2012; 2012: 198-202. 11. Andrew M, Vegh P, Caco C, Kirpalani H et al.: A randomized, controlled trial of platelet transfusions in thrombocytopenic premature infants. J Pediatr 1993; 123(2): 285-291. 12. Lindern JS, Hulzebos ChV, Bos AF et al.: Thrombocytopaenia and intraventricular haemorrhage in very premature infants: a tale of two cities. Arch Dis Chid Fetal Neonatal Ed 2012; 97: F348-352. 13. Venkatesh V, Curley AE, Clarke P et al.: Do we know when to treat neonatal thrombocytopaenia? Arch Dis Child Fetal Neonatal Ed 2013 98; 380-F382. 14. Baer VL, Lambert DL, Henry E et al.: Do platelet transfusions in the NICU adversely affect survival? Analysis of 1600 thrombocytopenic neonates in a multihospital healthcare system. Journal of Perinatology 2007; 27: 790-796. 15. Kenton AB, Hegemier S, Smith EO et al.: Platelet Transfusions In Infants With Necrotizing Enterocolitis Do Not Lower Mortality But May Increase Morbidity. Journal Of Perinatology 2005; 25; 173-177. 16. Kelly AM, Williamson LM: Neonatal Transfusion; Early Human Development 2013; 89: 855-860.


