Beata Kucińska, *Bożena Werner
Twory w sercu – struktury anatomiczne i struktury patologiczne
Anatomical and pathological structures in the heart
Klinika Kardiologii Wieku Dziecięcego i Pediatrii Ogólnej, Warszawski Uniwersytet Medyczny
Kierownik Kliniki: prof. dr hab. n. med. Bożena Werner
Summary
The increase in the availability of transthoracic echocardiography allows the diagnosis of not only congenital heart defects, which are the most common congenital defects in children, but also detection of cardiac masses such as thrombi, vegetations or heart tumors. Performing transthoracic echocardiography one should remember about normal anatomical structures in the atria and ventricles. The presence of central catheters and intracardiac leads favors the formation of thrombi in the heart. The vegetations which are characteristic for infective endocarditis mostly occur on the aortic and/or mitral valve. Primary cardiac tumors in children are very rare (approximately 0.2% of the population) and are usually oligosymptomatic. About 90% of them are benign tumors. The most common is the rhabdomyoma, which often coexists with tuberous sclerosis. The second most frequent tumor in children is a fibroma. Less common primary tumors in children are: teratomas, hemangiomas, lipomas, papillary fibroelastomas.
In the differential diagnosis of cardiac masses comprehensive assessment and analysis of both imaging results, as well as medical history, physical examination, laboratory tests and other additional tests are extremely important.

Dynamiczny rozwój technik obrazowania anatomii i funkcji serca, coraz lepsze możliwości obrazowania nawet małych struktur anatomicznych z wykorzystaniem wiązki ultradźwiękowej, popularyzacja oraz wzrost dostępności przezklatkowego badania echokardiograficznego pozwalają na wykrycie nie tylko wrodzonych wad serca, będących najczęstszymi wrodzonymi wadami u dzieci, ale także rzadziej występujących tworów w sercu, takich jak: guzy serca, wegetacje, skrzepliny.
Struktury anatomiczne
Wykonując przezklatkowe badanie echokardiograficzne, które aktualnie jest podstawową metodą diagnostyczną u dzieci, należy pamiętać o anatomicznych strukturach prawidłowego serca, które nieraz mogą powodować niepokój i niepewność badającego. Dotyczy to zwłaszcza prawego przedsionka, który jest znacznie „bogatszy”, jeśli chodzi o prawidłowe anatomiczne struktury, w porównaniu z „biedniejszym” lewym przedsionkiem. W prawym przedsionku występują zastawka żyły głównej dolnej – zastawka Eustachiusza, zastawka zatoki wieńcowej – zastawka Tabezjusza, siatka Chiariego, które w niektórych sytuacjach z powodu nadmiernych rozmiarów balotują w świetle prawego przedsionka (ryc. 1).
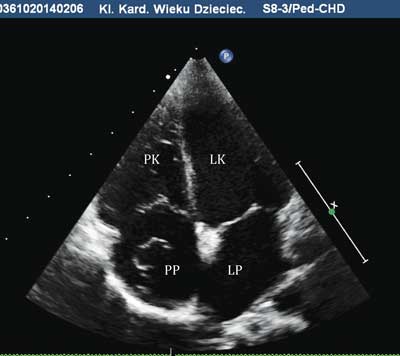
Ryc. 1. Przezklatkowe badanie echokardiograficzne, projekcja czterojamowa koniuszkowa, w świetle prawego przedsionka balotująca siatka Chiariego
PK – prawa komora, PP – prawy przedsionek, LK – lewa komora, LP – lewy przedsionek
Anatomicznymi strukturami prawego przedsionka są uszko o szerokiej podstawie, grzebień graniczny (łac. crista terminalis), mięśnie grzebieniaste. Niepokój może budzić nadmiernie rozwinięta tkanka tłuszczowa, najczęściej widoczna od strony pierścienia zastawki trójdzielnej, lub przerost tłuszczowy (lipomatoza) przegrody międzyprzedsionkowej. U dzieci po zamknięciu ubytku w przegrodzie międzyprzedsionkowej widoczne mogą być pozostałości założonych szwów powodujące pogrubienie przegrody lub uwypuklanie się do światła prawego przedsionka w postaci linijnego tworu.
W lewym przedsionku uszko posiada mniejszą podstawę, ale jest dłuższe i węższe w porównaniu z uszkiem prawego przedsionka. W świetle lewego przedsionka można zobaczyć długą linijną strukturę, którą jest ściana pomiędzy uszkiem lewego przedsionka a ujściem lewej górnej żyły płucnej. W świetle lewego przedsionka widoczna jest także ściana zatoki wieńcowej, znacznie poszerzona w przypadku ujścia do niej przetrwałej lewej żyły głównej górnej. W okolicy pierścienia mitralnego mogą wystąpić zwapnienia. W lewej komorze prawidłowo widoczne są dwa mięśnie brodawkowate, mogą też występować liczne dodatkowe wiązki mięśniowe i struny rzekome powodujące zwiększone beleczkowanie. Dla komory prawej typowe są belka przegrodowo-brzeżna widoczna w jej świetle oraz obfite beleczkowanie (1).
U dzieci rzadziej niż u dorosłych można zobrazować wyrośla Lambla na zastawce aortalnej. Są to cienkie, mobilne, nitkowate włókniste pasma, w miejscu koaptacji płatków, które spotyka się u zdrowych osób, ale mogą być one potencjalnym źródłem udaru.
Struktury patologiczne
U dzieci hospitalizowanych na oddziałach intensywnej terapii można zobrazować końcówki cewników centralnych. U dzieci po elektroterapii stwierdza się obecność endokawitarnych elektrod w prawym przedsionku i/lub w prawej komorze serca, z widocznymi ich osłonkami – „mufkami”.
Obecność cewników centralnych oraz elektrod wewnątrzsercowych sprzyja tworzeniu się skrzeplin w jamach serca, zwłaszcza u dzieci z wrodzonymi lub nabytymi czynnikami ryzyka sprzyjającymi tworzeniu się skrzeplin (2).
Duże skrzepliny (ryc. 2) wymagają różnicowania z guzami serca, a mniejsze – z wegetacjami występującymi w przebiegu infekcyjnego zapalenia wsierdzia. Wegetacje najczęściej występują na zastawce aortalnej i/lub dwudzielnej. Niezwykle istotne, poza zobrazowaniem tych patologicznych struktur w badaniu echokardiograficznym, są: analiza wywiadu, badanie przedmiotowe pacjenta, wyniki badań laboratoryjnych i innych badań dodatkowych (3-5). Wegetację na zastawce aortalnej w przebiegu infekcyjnego zapalenia wsierdzia przedstawia rycina 3.
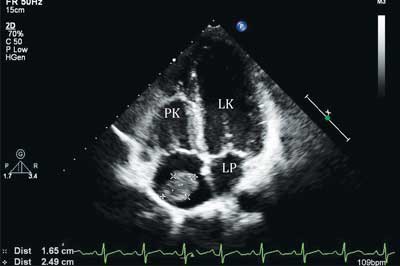
Ryc. 2. Przezklatkowe badanie echokardiograficzne, projekcja czterojamowa koniuszkowa, w świetle prawego przedsionka skrzeplina o wymiarach 2,49 x 1,65 cm
PK – prawa komora, LK – lewa komora, LP – lewy przedsionek
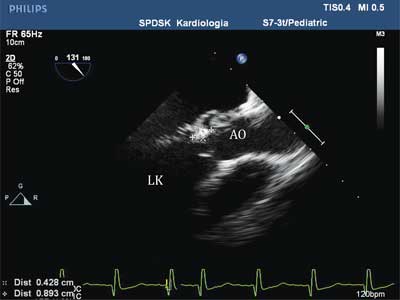
Ryc. 3. Przezprzełykowe badanie echokardiograficzne, wegetacja o wymiarach 8,9 x 4,28 mm na zastawce aortalnej u dziecka z infekcyjnym zapaleniem wsierdzia
LK – lewa komora, AO – aorta wstępująca
Pierwotne nowotwory serca u dzieci występują bardzo rzadko (ok. 0,2% populacji) i zwykle są skąpoobjawowe.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Gittenberger-de Groot AC, Poelmann RE: Cardiac morphogenesis. [In:] Yagel S, Silverman NH, Gembruch U (eds.): Fetal Cardiology: Embryology, Genetics, Physiology, Echocardiographic Evaluation, Diagnosis and Perinatal Management of Cardiac Diseases. 2nd ed. Informa Healthcare Inc. 2009: 9-17.
2. Monagle P, Chan AKC, Goldenberg NA et al.: Antithrombotic Therapy in Neonates and Children: Antithrombotic Therapy and Prevention of Thrombosis. 9th ed. American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012; 141: e737S-e801S.
3. Renk JS, Webb CL, Shulman ST, Anderson EJ: Echocardiography in pediatric infective endocarditis. Pediatr Infect Dis J 2011; 30: 1109.
4. Sun LC, Lai CC, Wang CY et al.: Risk factors for infective endocarditis in children with congenital heart diseases – A nationwide population based case control study. Int J Cardiol 2017; 248: 126.
5. https://www.uptodate.com/contents/infective-endocarditis-in-children.
6. Thomas-de-Montpreville V, Nottin R, Dulmet E, Serraf A: Heart tumors in children and adults: clinicopathological study of 59 patients from a surgical center. Cardiovasc Pathol 2007; 16: 22-28.
7. Beroukhim RS, Cava JR, Krishnamurrthy R et al.: Characterization of Cardiac Tumors in Children by Cardiovascular Magnetic Resonance Imaging. JACC 2011; 58: 1044-1054.
8. Padalino MA, Basso C, Milanesi O et al.: Surgically treated primary cardiac tumors in early infancy and childhood. J Thorac Cardiovasc Surg 2005; 129: 1358-1363.
9. Ganame J, D’hooge J, Mertens L: Different deformation patterns in intracardiac tumors. Eur J Echocardiogr 2005; 6: 461-464.
10. Tollens T, Casselman F, Devlieger H et al.: Fetal cardiac tamponade due to an intrapericardial teratoma. Ann Thorac Surg 1998; 66: 559-560.
11. Durairaj M, Mangotra K, Makhale CN et al.: Cardiac rhabdomyoma in neonate: application of serial echocardiography. Echocardiography 2006; 23: 510-512.
12. Kokabas A, Ekici F, Cetin I et al.: Cardiac rhabdomyomas associated with tuberous sclerosis complex in 11 children: presentation to outcome. Pediatr Hematol Oncol 2013; 30: 71.
13. Verhaaren HA, Vanakker O, De Wolf D et al.: Left ventricular outflow obstruction in rhabdomyoma of infancy: meta-analysis of the literature. J Pediatr 2003; 143: 258-263.
14. Freedom RM, Lee KJ, MacDonald C, Taylor G: Selected aspects of cardiac tumors in infancy and childhood. Pediatr Cardiol 2000; 21: 299-316.
15. Hinton RB, Prakash A, Romp RL et al.: Cardiovascular manifestations of tuberous sclerosis complex and summary of the revised diagnostic criteria and surveillance and management recommendations from the International Tuberous Sclerosis Consensus Group. J Am Heart Assoc 2014; 3: e001493.
16. Józwiak S, Kotulska K, Kasprzyk-Obara J et al.: Clinical and genotype studies of cardiac tumors in 154 patients with tuberous sclerosis complex. Pediatrics 2006; 118: 1146-1151.
17. Hirakubo Y, Ichihashi K, Shiraishi H, Mamoi MY: Ventricular tachycardia in a neonate with prenatally diagnosed cardiac tumor: a case with tuberous sclerosis. Pediatr Cardiol 2005; 26: 655-657.
18. Cho JM, Danielson GK, Puga FJ et al.: Surgical resection of ventricular cardiac fibromas: early and late results. Ann Thorac Surg 2003; 76: 1929-1934.
19. Agarwala BN, Starr JP, Walker E, Bacha AE: Surgical issues in giant right ventricular fibroma. Ann Thorac Surg 2004; 78: 328-330.
20. Tian JT, Cheng LC, Yung TC: Multiple cardiac inflammatory myofibroblastic tumors in the right ventricle in infant. Ann Thorac Surg 2006; 82: 1531-1535.
21. Burke AP, Rosado-de-Christenson M, Templeton PA, Virmani R: Cardiac fibroma: clinicopathologic correlates and surgical treatment. J Thorac Cardiovasc Surg 1994; 108: 862-870.
22. Sugiyama H, Naito H, Tsukano S et al.: Evaluation of Cardiac tumor In children by electron- beam computed tomography, rhabdomyoma and fibroma. Circ J 2005; 69: 1352-1356.
23. Hoffman U, Globits S, Schima W et al.: Usefulness of magnetic resonance imaging of cardiac and pericardiac masses. Am J Cardiol 2003; 92: 890-895.
24. Laga S, Gewillig MH, Van Schoubroeck D, Daenen W: Imminent fetal cardiac tamponade by right atrial hemangioma. Pediatr Cardiol 2006; 27: 633-635.
25. Al-Mateen M, Hood M, Trippel D et al.: Cerebral embolism from atrial myxoma in pediatric patients. Pediatrics 2003; 112: 162-167.
26. Akyildiz EU, Tolgay E, Oz B et al.: Cardiac myxoma: an anusual cause of sudden death in childhood. Turk J Pediatr 2006; 48: 172-174.



