*Bogdan Kędzia Elżbieta Hołderna-Kędzia
Immunostymulujące działanie propolisu
Immunostimulatory activity of propolis
Instytut Włókien Naturalnych i Roślin Zielarskich
Dyrektor Instytutu: dr hab. inż. Małgorzata Zimniewska, prof. IWNiRZ
Streszczenie
Badania na zwierzętach doświadczalnych prowadzone od blisko 30 lat wskazują jednoznacznie, że etanolowe i wodne ekstrakty z propolisu podawane pozajelitowo odznaczają się działaniem immunostymulującym. Ponadto wykazano, że u zwierząt doświadczalnych uodparnianych za pomocą swoistych antygenów ekstrakty propolisowe oraz ich składniki podwyższały miano aglutynacji, fagocytozę oraz wytwarzanie przeciwciał w porównaniu do samych antygenów. Współczesne badania nad immunostymulującymi właściwościami ekstraktów propolisowych wyraźnie wskazują na aktywację makrofagów i wzrost odporności przeciwdrobnoustrojowej oraz stymulowanie wytwarzania przeciwciał (immunoglobulin) pod wpływem ekstraktów etanolowych i wodnych z propolisu oraz ich składników. Do najważniejszych immunostymulujących składników propolisu zalicza się kwas kawowy, kwasy dikawoilochinowe oraz ester fenyloetylowy kwasu kawowego (CAPE). Przedstawione w opracowaniu badania stwarzają możliwości wykorzystania ekstraktów z propolisu i ich składników w praktyce do wytwarzania surowic odpornościowych na skalę przemysłową.
Summary
Research on experimental animals conducted for nearly 30 years clearly prove that the ethanol and water extracts of propolis provided parenterally have an immunostimulatory effect. In addition, it was revealed that in case of experimental animals immunized with specific antigens, the influence of propolis extracts and their components increased the agglutination titre, phagocytosis and antibody production compared to the antigens themselves. Contemporary research on immunostimulatory properties of propolis extracts clearly indicate the activation of macrophages and the increase of antimicroorganisms immunity, as well as stimulation of the antibody production under the influence of ethanol and water extracts from propolis and their components (immunoadjuvants).The most important immunostimulatory components of propolis include caffeic acid, dicaffeoylquinic acids and caffeic phenylethyl ester (CAPE). The research presented in this study creates the possibility of applying propolis extracts and their components in practice for the production of immune serum on an industrial scale.

Początkowy okres badań
Jako okres początkowy przyjęto umownie badania prowadzone w latach 1970-1990. Kiwalkina (1) stwierdziła, że miano aglutynacji, fagocytoza i wytwarzanie przeciwciał u świnek morskich uodparnianych za pomocą pełnego antygenu otrzymanego z Salmonella enteritidis w obecności propolisu podawanego drogą pozajelitową było znacznie wyższe niż w przypadku samego antygenu.
Szewczenko i wsp. (2) zaobserwowali, że 5% ekstrakt etanolowy z propolisu całkowicie hamował rozwój wirusa grypy u myszy, jeśli podawano go w postaci aerozolu do nosa lub górnych dróg oddechowych na 2 godziny przed zakażeniem tym wirusem. Ekstrakt nie wykazywał działania, jeśli podawano go myszom już zakażonym wirusem grypy.
Teterew (3) odnotował, że dodatek propolisu do szczepionki paradurowej wzmagał tworzenie się aglutyniny w surowicy krwi cieląt. Po 120 dniach od podania szczepionki i propolisu poziom O- i N-aglutynin w surowicy krwi zwierząt był znacznie wyższy niż po podaniu samej szczepionki.
Aleksandrowicz i Daniłow (4) wykazali, że ekstrakt etanolowy z propolisu podawany pozajelitowo myszom powodował stymulację makrofagów, co objawiało się znacznie szybszym eliminowaniem gronkowców złocistych (Staphylococcus aureus) z ich organizmu w porównaniu z myszami kontrolnymi.
Budrakowa (5) stwierdziła, że podawanie ekstraktu etanolowego z propolisu w ilości 5 mg oraz 20 j. toksyny tężcowej hiperimmunizowanym królikom 1 raz w tygodniu przez okres 63 dni spowodowało podwyższenie wytwarzania anatoksyny tężcowej u zwierząt w granicach od 20 do 240 j.
W innym doświadczeniu Budrakowa (6) dowiodła, że podanie 60 j. toksyny tężcowej hiperimmunizowanym królikom wraz z 5 mg ekstraktu etanolowego z propolisu już po 7 dniach spowodowało znaczny wzrost plazmocytów w węzłach chłonnych. Poziom plazmocytów w węzłach był wielokrotnie wyższy w porównaniu do zwierząt nieotrzymujących tego ekstraktu. Poza tym zaobserwowała ona, że średnia liczba plazmocytów w węzłach chłonnych blisko miejsca podania toksyny wynosiła początkowo 11 komórek, a po 4, 7 i 35 dniach doświadczenia ich liczba kształtowała się u zwierząt kontrolnych na poziomie średnio 16, 28 i 13 komórek. Natomiast u zwierząt otrzymujących toksynę tężcową wraz z ekstraktem propolisowym liczba plazmocytów w węzłach chłonnych wynosiła odpowiednio 21, 66 i 17 komórek w polu widzenia preparatu mikroskopowego.
Crisan i wsp. (7) badali wpływ ekstraktu wodnego z propolisu na wchłanialność oczyszczonego antygenu powierzchniowego zapalenia wątroby HBsAg. Stwierdzono znaczne zwolnienie wchłaniania badanego antygenu pod wpływem ekstraktu propolisowego, co spowodowało wyraźne przedłużenie jego działania i lepsze uodpornienie zwierząt doświadczalnych na zakażenie wirusem zapalenia wątroby. A zatem ekstrakt wodny z propolisu okazał się adjuwantem, tzn. substancją, która wzmaga immunogenność antygenu.
Według Esanu i wsp. (8) podawanie wodnego ekstraktu z propolisu donosowo myszom po zakażeniu ich wirusem grypy obniżało o około 45% poziom hemaglutynin w płucach i stopień śmiertelności zwierząt.
Badania Olinescu i wsp. (9) wykazały, że ekstrakt etanolowy z propolisu dodany do surowicy krwi ludzkiej zwiększał liczbę wolnych grup SH oraz powodował wzrost aktywności ceruloplazminy – glukoproteiny charakteryzującej się wyraźnymi właściwościami przeciwutleniającymi.
Podobnie Król i wsp. (10) zauważyli, że ekstrakt etanolowy z propolisu działa przeciwutleniająco w odniesieniu do neutrofili ludzkich i zwiększa fagocytozę obsonizowanego zymosanu przez te komórki żerne organizmu. Świadczy to o immunostymulujących właściwościach ekstraktów propolisowych.
Wyniki badań przeprowadzonych przez Kiwalkinę i wsp. (11) wskazują, że ekstrakt etanolowy z propolisu podany szczurom wraz z kompleksem glucydoproteinowym wyizolowanym z pałeczek Salmonella enteritidis warunkował znacznie intensywniejszą reakcję plazmocytarną i stymulował powstawanie przeciwciał w węzłach chłonnych, zarówno regionalnych, jak i oddalonych od miejsca podania antygenu. Antygen podawano jednorazowo i obserwacje prowadzono przez 90 dni. Okazało się, że po podaniu antygenu z propolisem już po 3 dniach obserwowano narastanie liczby plazmocytów i po 6 dniach ich liczba wynosiła 146 w polu widzenia preparatu mikroskopowego w porównaniu do 91 plazmocytów obecnych w węzłach chłonnych po podaniu samego antygenu (ryc. 1). Przeciwciała u szczurów immunizowanych antygenem z dodatkiem propolisu zaczęły pojawiać się w surowicy tych zwierząt już po 3 dniach. Ich maksymalne miano stwierdzono po 27 dniach i wynosiło ono 1:10 400. Natomiast w grupie kontrolnej zwierząt maksymalne miano przeciwciał odnotowano dopiero po 44 dniach i wynosiło ono 1:3460. Ponadto stwierdzono, że po podaniu antygenu z propolisem proliferacja (namnażanie) plazmocytów w regionalnych węzłach chłonnych była 3,7-6 razy bardziej intensywna niż po immunizacji samym antygenem. Miano aglutynin w surowicy krwi po podaniu antygenu z propolisem było także 3,7-4 razy wyższe w porównaniu do samego antygenu.
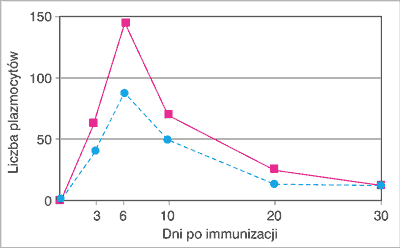
Ryc. 1. Wpływ immunizacji szczurów antygenem otrzymanym z Salmonella enteritidis i propolisem na liczbę plazmocytów w węzłach chłonnych (wg 11). Linia ciągła – antygen + propolis, linia przerywana – sam antygen
W późniejszej pracy Kiwalkina i wsp. (12) badali wpływ uodparniania za pomocą szczepionki z wirusa choroby Aujeszky’ego (występującej u wszystkich gatunków zwierząt domowych i hodowlanych) z dodatkiem propolisu na oddziaływanie układu immunologicznego u białych szczurów i świń. Wyniki badań oceniano na podstawie aktywności unieczynniania wirusa, komplementarnej aktywności surowicy krwi, reakcji plazmocytarnej i przebiegu procesu zakażenia. U szczurów stwierdzono unieczynnianie wirusów pod wpływem przeciwciał po 3 dniach. Maksymalne wytwarzanie przeciwciał stwierdzono po 7 dniach od podania szczepionki. Miano przeciwciał w surowicy krwi zwierząt, którym podano szczepionkę i propolis, było wyższe od 5 do 8 razy w porównaniu do zwierząt kontrolnych, które otrzymały samą szczepionkę. Reakcja plazmocytarna u szczurów uodparnianych w obecności propolisu była wcześniejsza i bardziej wyraźna, a także utrzymywała się dłużej w porównaniu do zwierząt kontrolnych. Z kolei u świń uodparnianych z udziałem propolisu obserwowano 4-5-krotnie silniejsze unieczynnianie wirusów niż w przypadku zwierząt kontrolnych. Reakcja plazmocytarna i aktywność komplementarna surowicy krwi były wyższe po podaniu szczepionki i propolisu i trwały przez cały okres prowadzonych doświadczeń.
Na podstawie powyższych badań można stwierdzić, że propolis jest silnym adjuwantem i podawanie go wraz z antygenami prowadzi do znacznej stymulacji układu odpornościowego.
Na zakończenie tej części opracowania należy również wspomnieć o badaniach Neycheva i wsp. (13) dotyczących immunostymulującego działania ekstraktu wodnego z propolisu po doświadczalnym zakażeniu myszy wirusem grypy. W tym kontekście autorzy publikacji nakreślili mechanizmy działania układu odpornościowego w zakresie fagocytozy, poziomu komplementarnego surowicy krwi i powstawania komórek gwiaździstych. Na rycinie 2 przedstawiono przeżywalność myszy po 5 dniach od momentu ich donosowego zakażenia wirusem grypy. Stwierdzono, że po leczeniu zwierząt za pomocą ekstraktu wodnego z propolisu w ilości 150 mg/kg m.c. ich przeżywalność znacznie wzrosła. Zwierzęta leczone ekstraktem drogą pokarmową przeżywały o 40% częściej, a leczone drogą iniekcyjną o 57% częściej.
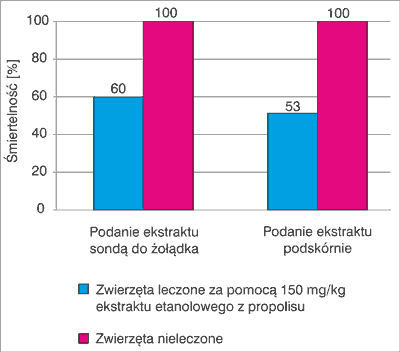
Ryc. 2. Przeżywalność myszy po 5 dniach od momentu zakażenia ich donosowo wirusem grypy (wg 12)
Rycina 3 przedstawia natomiast wpływ ekstraktu wodnego z propolisu na zdolność fagocytozy przez makrofagi komórek bakteryjnych Yersinia pseudotuberculosis. Badania prowadzone in vitro wykazały, że makrofagi stymulowane ekstraktem propolisowym w stężeniu 100 μg/ml pochłaniały ponad dwukrotnie więcej wymienionych bakterii w porównaniu do makrofagów niestymulowanych. Ponadto ekstrakt propolisowy podwyższał komplementarność surowicy krwi, indeks śledzionowy oraz indeks odpornościowych komórek gwiaździstych w porównaniu do zwierząt nieleczonych.
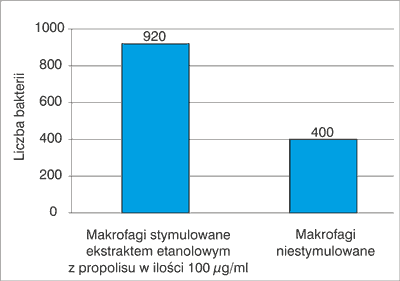
Ryc. 3. Liczba bakterii Yersinia pseudotuberculosis pochłonięta przez makrofagi w teście in vitro (wg 12)
Powyższe badania potwierdzają immunostymulującą aktywność ekstraktów propolisowych, stwarzającą możliwość praktycznego wykorzystania tego produktu w terapii.
Współczesny etap badań
Można przyjąć, że współczesne badania nad immunostymulującymi właściwościami ekstraktów propolisowych zapoczątkowane zostały w latach 90. Koncentrowały się one głównie na zagadnieniach aktywacji makrofagów i wzrostu ich aktywności przeciwdrobnoustrojowej oraz stymulowaniu wytwarzania przeciwciał (immunoglobulin) pod wpływem ekstraktów otrzymanych z propolisu i ich składników.
Stymulowanie makrofagów przez ekstrakty propolisowe i ich składniki
Dimov i wsp. (14) stwierdzili, że myszy zakażone dootrzewnowo drobnoustrojami chorobotwórczymi i leczone następnie za pomocą ekstraktu wodnego z propolisu na drodze codziennego dootrzewnowego podawania tego ekstraktu w ilości 150 mg/kg m.c. zwierząt przez 30 dni, przeżywały dłużej w porównaniu do myszy kontrolnych (nieleczonych). Z tabeli 1 wynika, że myszy zakażone gronkowcem złocistym (Staphylococcus aureus) i leczone ekstraktem propolisowym przeżywały średnio 1,2 dnia dłużej, myszy zakażone pałeczką zapalenia płuc (Klebsiella pneumoniae) – średnio 2,2 dnia dłużej, a zakażone grzybami drożdżoidalnymi (Candida albicans) – średnio 17,0 dni dłużej w porównaniu do zwierząt nieleczonych.
Tab. 1. Wpływ ekstraktu wodnego z propolisu na przeżywalność myszy zakażonych drobnoustrojami chorobotwórczymi (wg 14)
| Drobnoustroje użyte do zakażenia zwierząt | Dawka ekstraktu i droga podania | Średni czas przeżycia myszy w porównaniu do kontroli (dni) |
Staphylococcus aureus
Klebsiella pneumoniae
Candida albicans | 150 mg, dootrzewnowo
150 mg, dootrzewnowo
150 mg, dootrzewnowo | 1,2
2,2
17,0 |
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Kiwalkina WP. Effect of propolis on immunological reactivity. Apicult Abstr 1970; 21:127-8.
2. Szewczenko LF, Czasowodzewa DA, Pieszczanskij AN. Inhibiting activity of propolis on the influenza virus. Chem Abstr 1975; 82:68322e.
3. Teterew JJ. Effect of propolis on synthesis of specific agglutinins. Veterinarija (Moskwa) 1972; (3):41-2.
4. Aleksandrowicz JS, Daniłow LN. Baktericidnyje swojstwa propolisa. Pczełowodstwo 1974; (6):28.
5. Budrakowa EL. Effect of propolis on immunological indexes in tests of hiperimmunization with tetanus anatoxin. Apicult Abstr 1974; 25:164-5.
6. Budrakowa EL. Cellular and humoral reactions to tetanus toxoid plus propolis. Uczen Zap Kazansk Gosudarstw Weterin Inst 1976; 117:148-51.
7. Crisan I, Cioca V, Morffi A i wsp. Effect of propolis extract on surface antigen B of hepatitis compared to some chemical agents. III Int Symp Apither, Portoroż (Słowenia) 1978; 17.
8. Esanu V, Prakoreanu E, Crisan J i wsp. The effect of aqueous propolis extract or rutin and of a rutin-quercetin mixture on experimental influenza virus infection in mice. Rev Roum Med Virol 1981; 32:213-5.
9. Olinescu R, Gidoin T, Softa T i wsp. Biochemical mechanisms induced in the pharmacodynamic effect of propolis. I. In vitro effect on albumin and serum proteins. Stud Cercet Biochim 1982; 25:158-64.
10. Król W, Czuba ZP, Scheller S. Działanie etanolowego ekstraktu propolisu (EEP) i flawonoli na chemiluminiscencję (CL) ludzkich neutrofili. Immunol Pol 1986; 11:292-7.
11. Kiwalkina WP, Bałałykina AI, Piontkowskij WI. Plazmocitarnaja reakcija u biełych krys immunizirowannych antigenom s propolisom. W: Cennyj produkt pczełowodstwa – propolis (red. V Harnaj). Izd Apimondija, Bucharest 1987; 106-10.
12. Kiwalkina WP, Biełozierowa GA, Kamałow GH. Stimulacija immunogeneza propolisom pri immunizacji żiwotnych protiw bolezni Aujeski. W: Cennyj produkt pczełowodstwa – propolis (red.V Harnaj). Izd Apimondija, Bucharest 1987; 110-4.
13. Neychev H, Dimov V, Vuleva V i wsp. Immunomodulatory action of propolis. II. Effect of water-soluble fraction on influenza infection in mice. Acta Microbiol Bulg 1988; 23:58-62.
14. Dimov V, Ivanovska N, Manolova N i wsp. Immunomodulatory action of propolis. Influence on anti-infections protection and macrophage function. Apidologie 1991; 22:155-62.
15. Murad JM, Calvi SA, Soares AMVC i wsp. Effect of propolis from Brazil and Bulgaria on fungicidal activity of macrophages against Paracoccidioides brasiliensis. J Ethnopharmacol 2002; 79:331-4.
16. Orsi RO, Sforcin JM, Funari SRC i wsp. Effects of Brazilian and Bulgarian propolis on bactericidal activity of macrophages against Salmonella typhimurium. Int Immunopharmacol 2005; 5:359-68.
17. Syamsudin TV, Dewi RM, Kusmardi AC. Immunomodulatory and in vivo antiplasmodial activities of propolis extracts. Am J Pharm Toxicol 2009; 4:75-9.
18. Tatefuji T, Izumi N, Ohta T i wsp. Isolation and identification of compounds from Brazilian propolis which enhance macrophage spreading and mobility. Biol Pharm Bull 1996; 19:966-70.
19. Markonius M. Use of propolis components as an immunoadjuvant; US Patent Nr 5, 591, 771. Chem Abstr 1997;126:148485c.
20. Park JH, Lee JK, Kim HS i wsp. Immunomodulatory effect of caffeic acid phenetyl ester in Balb/c mice. Int Immunopharmacol 2004; 4:429-36.
21. Sforcin JM, Orsi RO, Bankova V. Effect of propolis, some isolated compounds and its source plant on antibody production. J Ethnopharmacol 2005; 98:301-5.
22. Chu W-H. Adjuvant effect of propolis on immunisation by inactivated Aeromonas hydrophila in carp (Carassius auratus gibelio). Fish Shelfish Immunol 2006; 21:113-7.



