Bogdan Kędzia, *Elżbieta Hołderna-Kędzia
Przeciwnowotworowe działanie składników propolisu. Cz. 1. Ester fenyloetylowy kwasu kawowego (CAPE)
Anticancerogenic activity of some components of propolis. Part 1. Caffeic acid phenethyl ester (CAPE)
Instytut Włókien Naturalnych i Roślin Zielarskich w Poznaniu
Dyrektor Instytutu: dr hab. inż. Małgorzata Zimniewska, prof. IWNiRZ
Streszczenie
W opracowaniu przedstawiono przegląd publikacji dotyczących przeciwnowotworowego działania biologicznie aktywnego składnika propolisu – estru fenyloetylowego kwasu kawowego (CAPE). Dane piśmiennictwa wskazują na jego liczne właściwości biologiczne: przeciwutleniające, przeciwzapalne, przeciwwirusowe, immunostymulujące, przeciwangiogenne i inne. W wielu testach, zarówno in vitro, jak i in vivo, potwierdzono silne działanie CAPE, m.in. wobec komórek ludzkiego gruczolaka okrężnicy HT-29, pięciu hodowli komórkowych nowotworów ludzkich, mysich i innych. Autorzy zwracają także uwagę na wspomaganie przez CAPE przeciwnowotworowego działania leków, w tym doksorubicyny, cisplatyny na podstawie obniżenia przeżywalności komórek nowotworowych odpowiednio o 45 i 34% w porównaniu z wymienionymi lekami stosowanymi samodzielnie. Przeprowadzone badania wskazują, że wśród głównych mechanizmów przeciwnowotworowego działania CAPE można wymienić wywoływanie w komórkach apoptozy, czyli zaprogramowanej śmierci komórki.
Summary
The paper presents a review of the publications on the anticancerogenic activity of the biologically active component of propolis – caffeic acid phenethyl ester (CAPE). Literature data indicate numerous biological properties of CAPE, namely: antioxidant, anti-inflammatory, antiviral, immunostimulatory, anti-angiogenic and others. In numerous tests, both in vitro and in vivo, the significant activity of CAPE has been confirmed, including an action against HT-29 human colon adenoma cells, and five: human, murine and other tumor cell cultures. The authors also emphasize that CAPE supports the anticancerogenic effect of drugs, including doxorubicin and cisplatin, due to the reduction of cancer cell survival by 45% and 34%, respectively, compared to the above-mentioned drugs used alone. The conducted research indicates that the induction of apoptosis in cells, i.e. programmed cell death, can be mentioned among the main mechanisms of the anticancerogenic activity of CAPE.

Wstęp
Ester fenyloetylowy kwasu kawowego (ang. caffeic acid phenethyl ester – CAPE) jest biologicznie aktywnym składnikiem propolisu. Z danych piśmiennictwa wynika, że wykazuje on wiele interesujących właściwości, a mianowicie działa przeciwutleniająco, przeciwzapalnie, przeciwbakteryjnie, przeciwwirusowo, immunostymulująco, przeciwangiogennie. Ponadto hamuje podziały komórkowe i działa cytotoksycznie na komórki nowotworowe, a także powoduje apoptozę (zaprogramowaną śmierć) komórek nowotworowych.
W niniejszym opracowaniu postanowiono dokonać przeglądu publikacji dotyczących przeciwnowotworowego działania CAPE.
Grunberger i wsp. (1) jako pierwsi zwrócili uwagę na to, że ester fenyloetylowy kwasu kawowego (CAPE) (ryc. 1) (2) wywiera działanie przeciwnowotworowe. Wymienieni autorzy stwierdzili, że CAPE w stężeniu 0,035 μmol/ml całkowicie hamuje wbudowywanie 3H-tymidyny do DNA ludzkiego nowotworu sutka MCF-7. Jeszcze lepsze efekty odnotowano w przypadku działania CAPE na komórki takich nowotworów, jak czerniak złośliwy, rak okrężnicy i rak nerek. Na tej podstawie uznano, że CAPE jest jednym z najważniejszych związków odpowiedzialnych za przeciwnowotworowe działanie ekstraktów propolisowych.

Ryc. 1. Budowa chemiczna estru fenyloetylowego kwasu kawowego (CAPE)
Rao i wsp. (3) przebadali działanie cytotoksyczne CAPE wobec komórek ludzkiego gruczolakoraka okrężnicy HT-29 i wykazali jego dużą aktywność. CAPE hamował rozwój komórek wymienionego nowotworu w stężeniu 30 μmol/ml.
W innym eksperymencie Rao i wsp. (2) karmili szczury paszą standardową z dodatkiem 500 μg/g CAPE przez 2 tygodnie, a następnie podawali im karcynogenny azoksymetan (AOM) raz w tygodniu przez 2 kolejne tygodnie w ilości 15 mg/kg. Po kolejnych 5 tyg. karmienia zwierząt paszą z dodatkiem CAPE oceniano liczbę powstałych nadżerek okrężnicy o charakterze nowotworowym. Wyniki badań przedstawione w tabeli 1 wskazują, że podawanie szczurom paszy z dodatkiem CAPE zabezpieczało je przed rozwojem nowotworu okrężnicy. W obecności CAPE liczba nadżerek okrężnicy o charakterze nowotworowym zmniejszyła się o 56,9%, w porównaniu z kontrolą (AOM).
Tab. 1. Wpływ CAPE na powstawanie nadżerek okrężnicy typu nowotworowego wywoływanych azoksymetanem (wg 2)
| Grupy zwierząt doświadczalnych | Liczba nadżerek okrężnicy o charakterze nowotworowym |
AOM (kontrola)
AOM + CAPE | 123 (0)*
53 (56,9) |
*W nawiasach podano obniżenie liczby nadżerek okrężnicy w porównaniu z kontrolą
Dalsze badania Rao i wsp. (4) wykazały, że podawanie szczurom CAPE w paszy w ilości 750 μg/g zabezpieczało jelito cienkie i okrężnicę tych zwierząt przed powstaniem nowotworu w 57,4% w porównaniu ze zwierzętami kontrolnymi, którym podawano tylko związek karcynogenny – azoksymetan.
Huang i wsp. (5) wywoływali u myszy nowotwory skóry za pomocą karcynogenów: DMBA (7,12-dimetylobenz(a)antracenu) i TPA (octanu 12-O-tetradekano-13-forbolu) stosowanych zewnętrznie, a następnie miejscowo stosowali CAPE w stężeniu 0,01-3,0 μmol/dawkę przez 8 tygodni. Dane zebrane w tabeli 2 wskazują, że efekt leczniczy wzrastał w miarę zwiększania dawki CAPE. Po miejscowym stosowaniu tego związku w stężeniu 3,0 μmol/dawkę liczba myszy z nowotworami skóry zmniejszyła się o 53,4%, liczba zmian nowotworowych na skórze – o 89,4%, a stopień zahamowania rozwoju procesu nowotworowego wzrósł o 90% w porównaniu ze zwierzętami nieleczonymi (kontrola).
Tab. 2. Działanie przeciwnowotworowe CAPE w odniesieniu do nowotworów skóry wywoływanych karcynogenami (wg 5)
| Dawka CAPE (μmol/dawkę) | Liczba myszy z nowotworami skóry (%) | Liczba nowotworów/mysz | Hamowanie rozwoju nowotworu (%) |
Kontrola
0,01
0,1
3,0 | 63
47
43
30 | 4,7
3,8
2,5
0,5 | 0
19
47
90 |
Banskota i wsp. (6) oceniali cytotoksyczne działanie CAPE na komórki nowotworowe ludzkie i mysie. Stwierdzili oni, że związek ten odznaczał się wysoką aktywnością cytotoksyczną (tab. 3). Szczególnie silne działanie CAPE wywierał na komórki nowotworów mysich 26-L5 i B16-BL6 (EC50 odpowiednio 1,8 i 3,2 μmol/ml).
Tab. 3. Cytotoksyczne działanie CAPE na komórki nowotworów ludzkich i mysich (wg 6)
| Badany związek | Aktywność cytotoksyczna (EC50, μmol/ml) |
| Nowotwory ludzkie | Nowotwory mysie |
| HT-1080 | A-549 | 26-L5 | B16-BL6 |
| Ester fenetylowy kwasu kawowego (CAPE) | 13,7 | 44,0 | 1,8 | 3,2 |
Badania Usia i wsp. (7) dotyczyły aktywności cytotoksycznej CAPE (tab. 4). Jako kontroli użyto 5-fluorouracylu. Odnotowano, że CAPE odznaczał się wysoką aktywnością cytotoksyczną wobec 5 hodowli komórkowych nowotworów ludzkich i mysich (EC50 w granicach 0,3-27,9 μmol/ml).
Tab. 4. Działanie przeciwnowotworowe CAPE na komórki nowotworów ludzkich i mysich (wg 7)
| Badane związki | Aktywność cytotoksyczna (EC50, μmol/ml) |
| Nowotwory ludzkie | Nowotwory mysie |
| HT-1080 | A-549 | HeLa | 26-L5 | B16-BL6 |
5-Fluorouracyl (kontrola)
CAPE | 1,4
9,5 | 3,6
27,9 | 0,2
2,4 | 0,3
0,3 | 1,2
6,8 |
Borelli i wsp. (8) określali wpływ CAPE na tworzenie się nadżerek okrężnicy na skutek działania substancji karcynogennej – azoksymetanu (AOM). Wyniki badań ujęte w tabeli 5 wskazują na ochronne działanie CAPE wobec substancji karcynogennej. CAPE podawano zwierzętom dożołądkowo w dawce 50 mg/kg m.c. 5 razy tygodniowo. W 15. i 20. dniu doświadczenia podano AOM dootrzewnowo w dawce 15 mg/kg m.c. Po 11 tygodniach podawania CAPE zwierzęta usypiano i oceniano w okrężnicy liczbę nadżerek nowotworowych oraz w pełni rozwiniętą chorobę nowotworową. Zaobserwowano, że podawanie CAPE zmniejszyło o ok. 40% liczbę nadżerek nowotworowych okrężnicy i całkowicie zabezpieczało zwierzęta przed powstaniem w pełni objawowego nowotworu tego narządu.
Tab. 5. Wpływ CAPE na tworzenie się nadżerek okrężnicy u szczurów traktowanych azoksymetanem (AOM) (wg 8)
| Podawane substancje | Liczba zwierząt | Liczba nadżerek okrężnicy/szczura | Liczba zwierząt z nowotworem okrężnicy |
AOM
AOM + CAPE | 8
8 | 114,7
71,5 | 2
0 |
Również Liao i wsp. (9) stwierdzili, że CAPE w stężeniu 0,2 μmol/ml hamuje w 47,8% proliferację komórek mięsakoraka okrężnicy CT26. Ponadto dootrzewnowe podanie myszom CAPE w dawce 10 mg/kg/dzień wyraźnie zmniejsza przerzuty tego nowotworu do płuc i przedłuża życie zwierząt.
Wpływ stężenia CAPE na przeżywalność komórek glejaka szczurzego C6 badali Lee i wsp. (10). Z danych przedstawionych na rycinie 2 wynika, że CAPE w ilości 50 μmol/ml obniżał liczbę żywych komórek tego nowotworu o 56%, a w ilości 100 μmol/ml o 78%. Świadczy to o wysokiej aktywności CAPE wobec badanych komórek nowotworowych.
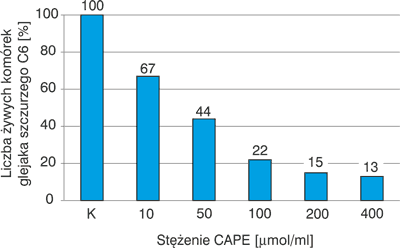
Ryc. 2. Wpływ stężenia CAPE na przeżywalność komórek glejaka szczurzego C6 (wg 10)
Chung i wsp. (11) określili wpływ CAPE na rozwój nowotworu ludzkiego wątroby HepG2 w organizmie myszy. Po podskórnym wszczepieniu komórek nowotworowych podjęto podawanie CAPE dwiema drogami: podskórną w dawce 5 mg/kg m.c. 3 razy w tygodniu oraz pokarmową w dawce 20 mg/kg m.c. 6 razy w tygodniu. Doświadczenie prowadzono przez 6 tygodni. Badania wykazały (tab. 6), że po podawaniu CAPE drogą podskórną objętość nowotworu u myszy zmniejszyła się o 56,7%, a po podawaniu drogą pokarmową o 47,1% w porównaniu ze zwierzętami nieleczonymi (kontrola).
Tab. 6. Wpływ CAPE na rozwój nowotworu ludzkiego wątroby HepG2 w organizmie myszy (wg 11)
| Droga podania CAPE i dawka | Liczba zwierząt | Objętość nowotworu (ml) |
| wartość | procent |
Podskórna, 5 mg/kg m.c.
Kontrola
CAPE |
7
7 |
3,30
1,43 |
100,0
43,3 |
Pokarmowa, 20 mg/kg m.c.
Kontrola
CAPE |
11
7 |
3,31
1,75 |
100,0
52,9 |
W badaniach Chen i wsp. (12) aktywność cytotoksyczna CAPE (IC50) wobec komórek czerniaka ludzkiego wynosiła 0,03 μmol/ml.
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Grunberger D, Banerjee R, Eisinger K i wsp. Preferential cytotoxicity on tumor cells by caffeic acid phenethyl ester isolated from propolis. Experientia 1988; 44:230-2.
2. Rao CV, Desai D, Simi B i wsp. Inhibitory effect of caffeic acid esters on azoxymethane-induced biochemical changes and aberrant crypt faci formation in rat colon. Cancer Res 1993; 53:4182-8.
3. Rao CV, Desai D, Kaul B i wsp. Effect of caffeic acid esters on carcinogen- induced mutagenicity and human colon adenocarcinoma cell growth. Chem Biol Interact 1992; 84:277-90.
4. Rao CV, Desai D, Rivenson A i wsp. Chemoprevention of colon carcinogenesis by phenylethyl-3-methylcaffeate. Cancer Res 1995; 55:2310-5.
5. Huang M-T, MaW, Yen P i wsp. Inhibitory effects of caffeic acid phenethyl ester (CAPE) on 12-O-tetradecanoylphorbol-13-acetate-induced tumor promotion in mouse skin and the synthesis of DNA, RNA and protein in Hela cells. Carcinogenesis 1996; 17:761-5.
6. Banskota AH, Nagaoka T, Sumioka LY i wsp. Antiproliferative activity of the Netherlands propolis and its active principles in cancer cell Lines. J. Ethnopharmacol 2002; 80:67-73.
7. Usia T, Banskota AH, Tezuka Y i wsp. Constituents of Chinese Propolis and their antiproliferative activities. J Nat Prod 2002; 65:673-6.
8. Borelli F, Izzo AA, Di Carlo G i wsp. Effect of a propolis extract and caffeic acid phenethyl ester on formation of aberrant crypt foci and tumors in the rat colon. Fitoterapia 2002; 73(supl. 1):S38-S43.
9. Liao HF, Chen YY, Liu JJ i wsp. Inhibitory effect of caffeic acid phenethyl ester on angiogenesis, tumor invasion, and metastasis. J Agric Food Chem 2003; 51:7907-12.
10. Lee Y-J, Kuo H-C, Chu C-Y i wsp. Involvement of tumor suppressor protein p53 and p38 MAPK I caffeic acid phenethyl ester-induced apoptosis of C6 glioma cells. Biochem Pharmacol 2003; 66:2281-9.
11. Chung T-W, Moon S-K, Chang Y-C i wsp. Novel and therapeutic effect of caffeic acid and caffeic acid phenethyl ester on hepatocarcinoma cells: complete regression of hepatoma growth and metastasis by dual mechanisms. FASEB J 2004; 18:1670-81.
12. Chen C-N, Weng M-S, Wu C-L i wsp. Comparison of radical scavenging activity, cytotoxic effects and apoptosis induction in human melanoma cells by Taiwanese propolis from different sources. Evid Based Complement Alternat Med 2004; 1:175-85.
13. Oršolič N, Kneževič AH, Šver L i wsp. Immunomodulatory and antimetastatic action of propolis and related polyphenolic compounds. J Ethnopharmacol 2004; 94:307-15.
14. Oršolič N, Trezič S, Mihajlevič Ż i wsp. Effects of local administration of propolis and its polyphenolic compounds on tumor formation and growth. Biol Pharm Bull 2005; 28:1928-33.
15. Lee Y-T, Don M-J, Hung P-S i wsp. Cytotoxicity of phenolic acid phenethyl esters on oral cancer cells. Cancer Lett 2005; 23:19-25.
16. Jin UH, Chung TW Kang SA i wsp. Caffeic acid phenethyl ester in propolis is a strong inhibitor of matrix metalloproteinase-9 and invasion inhibitor: isolation and identification. Clin Chim Acta 2005; 362:57-64.
17. Hwang HJ, Park HJ, Chung HJ i wsp. Inhibitory effects of caffeic acid phenethyl ester on cancer cell metastasis mediated by the down-regulation of matrix metalloproteinase expression in human HT 1080 fibrosarcoma cells. J Nutr Biochem 2006; 17:356-62.
18. He Y-J, Liu B-H, Xiang D-B i wsp. Inhibitory effect of caffeic acid phenethyl ester on the growth of SW480 colorectal tumor cells involves β-catanin associated signaling pathway down-regulation. World J Gastroenterol 2006; 12:4981-5.
19. Jin U-H, Song K-H, Motumara M i wsp. Caffeic acid phenethyl ester induces mitochondria-mediated apoptosis in human myeloid leukemia U937 cells. Mol Cell Biochem 2008; 310:43-8.
20. Szliszka E, Czuba ZP, Domino M i wsp. Ethanolic extract of propolis (EEP) enhances the apoptosis – inducing potential of TRAIL in cancer cells. Molecules 2009; 14:738-54.
21. Lin W-L, Liang W-H, Lee Y-J i wsp. Antitumor progression potential of caffeic acid phenethyl ester involving p75NTR in C6 glioma cells. Chem Biol Ineract 2010; 188:607-15.
22. El-Rafaei MF, El-Naa MM. Inhibitory effect of caffeic acid phenethyl ester on mice bearing tumor involving angiostatic and apoptotic activities. Chem-Biol Interact 2010; 186:152-6.
23. Markiewicz-Żukowska R, Car H, Naliwajko SK i wsp. Ethanolic extract of propolis, chrysin, CAPE inhibit human astroglia cells. Adv Med Sci 2012; 57(2):208-16.
24. Kuo Y-Y, Jim W-T, Su L-C i wsp. Caffeic acid phenethyl ester is a potential therapeutic agent for oral cancer. Int J Mol Sci 2015; 16:10748-66.
25. Kabała-Dzik A, Rzepecka-Stojko A, Kubina R i wsp. Caffeic acid versus caffeic acid phenethyl ester in the treatment of breast cancer MCF-7 cells: migration rate inhibition. Integr Cancer Ther 2018; 17(4):1247-59.
26. Budisan L, Gulei D, Jurj A i wsp. Inhibitory effect of CAPE and kaempferol in colon cancer cell lines-possible implications in new therapeutic strategies. Int J Mol Sci 2019; 20:1199-2017.
27. Balkhi HM, Haq E, Gul T i wsp. Anti-glioma effects of caffeic acid phenethyl ester and Dasatinib combination therapy in vivo rat glioma model. Anti-Canc Agents Med Chem 2018; 18:1729-35.
28. Ishida Y, Gao R, Shah N i wsp. Anticancer activity in honeybee propolis: Functional insights to the role of caffeic acid phenethyl ester and its complex with γ-cyclodextrin. Integr Cancer Ther 2018; 17(3):867-73.
29. Matsunaga T, Tsuchimura S, Azuma N i wsp. Caffeic acid phenethyl ester potentiates gastric cancer cell sensitivity doxorubicin and cisplatin by decreasing proteasome function. Anti-Cancer Drugs 2019; 30:251-9.


