© Borgis - Nowa Stomatologia 1/2007, s. 31-35
*Agnieszka Mielczarek1, Mirosław Kwaśny2, Maksymilian Włodarski2
Wykorzystanie fluorescencji różnicowej w diagnostyce próchnicy – doniesienie wstępne
The application of the differential fluorescence method in caries diagnosis – preliminary study
1Zakład Stomatologii Zachowawczej Instytut Stomatologii Akademii Medycznej w Warszawie
Kierownik Zakładu: prof. dr hab. n. med. Elżbieta Jodkowska
2Zakład Technologii Optoelektronicznych Instytut Optoelektroniki WAT w Warszawie
Kierownik Zakładu: płk. dr inż. Mirosław Kwaśny

Metoda fluorescencji wzbudzanej laserami (LIF) od kilku lat znajduje zastosowanie w diagnostyce ogólno- medycznej. Wykorzystywana jest do wykrywania wczesnych faz nowotworów, miażdżycy, kamicy nerkowej i moczowej (1). „Optyczne biopsje”, jak nazywa się wspom- niane procedury diagnostyczne, w przeciwieństwie do badań histopatologicznych są nieinwazyjne, nie wymagają pobierania materiału, a analizowana ilość materiału jest nielimitowana. Promieniowanie indukujące i wzbudzone transmitowane są systemem światłowodowym, sygnały mierzone są w czasie rzeczywistym, a rejestrowane obszary można analizować wielokrotnie.
Detekcja metodą LIF polega na rejestracji fluorescencji obszaru tkanki pod wpływem padającego promieniowania. Promieniowanie wzbudzające indukuje odpowiednie barwniki fluoryzujące (fluorofory) zawarte w materiale biologicznym.
Fluorescencja wzbudzana laserami stosowana jest z wykorzystaniem endogennych fluoroforów (tzw. „autofluorescencja”) lub z wprowadzeniem egzogennych fluoroforów akumulujących się lepiej w tkankach nowotworowych niż zdrowych. Barwniki egzogenne spełniają jednocześnie rolę fotosensybilizatorów w leczeniu nowotworów metodą fotodynamiczną (2, 3). Fluorescencja indukowana w tkankach pochodzi od takich związków, jak m.in.: endogenne porfiryny, melanina, beta-karoten, dinukleotyd flawinoadeninowy (FAD), dinukleotyd nikotynoamidoadeninowy (NAD), białka zawarte w elastynie i kolagenie i pochodne pirydoksyny (4). Widma wzbudzenia i emisji wymienionych związków pokazano na rycinie 1.

Ryc. 1. Charakterystyka spektralna fluoroforów występujących w organizmie a) widma wzbudzenia b) widma emisji: 1 – kolagen, 2 – tryptofan, 3 – elastyna, 4 – pirydoksamino-5-fosforan, 5 – pirydoksyna, 6 – kwas 4-pirydoksylowy, 7 – NADH, 8 – protoporfiryna IX, 9 – FAD (wg. Bottiroli i wsp. 1995).
Końcowa forma widma indukowanej fluorescencji zależy od długości fali wzbudzenia, wzajemnych stosunków ilościowych pomiędzy fluoroforami, całkowitej ich ilości, poziomu pH badanego obszaru, formy redox oraz głębokości położenia obszaru fluoryzującego. Wymienione czynniki wskazują na dużą skalę trudności przy interpretacji widm spektralnych. Podstawowy problem to wybór odpowiedniej długości fali wzbudzenia i normalizacja natężenia emisji, której poziom zależy od natężenia promieniowania dochodzącego do tkanki i warunków geometrycznych pomiaru (prostopadłe ustawienie końcówki światłowodowej w stosunku do badanej tkanki).
Dotychczas jedynie dla kilku rodzajów tkanki łącznej, głównie płuc, udało się dobrać odpowiednią długość fali wzbudzenia fluorescencji (5, 6, 7). W lokalizacji wczesnych faz nowotworów płuc najlepszym rozwiązaniem było wykorzystanie lasera helowo-kadmowego (He-Cd), pracującego w zakresie długości fali 442 nm, do wzbudzenia bioflawonoidów (8, 9). Całkowita fluorescencja wzbudzana w tkankach zdrowych w warunkach in vivo, jest znacznie większa od fluorescencji tkanek nowotworowych, ponadto różne są stosunki intensywności w pasmach zielonym i czerwonym widma.
W pracach własnych autorzy badali wpływ długości fali promieniowania laserowego na zmiany w widmach fluorescencji szkliwa (10, 11). Poziom autofluorescencji szkliwa prawidłowego w porównaniu do zmienionego próchnicowo w warunkach in vitro jak i in vivo jest większy, przy wzbudzeniu laserami o długościach fali 442 nm i 532 nm. Przy wzbudzeniu promieniowaniem o długości fali 633 nm zależność ta jest identyczna dla zmian w warunkach in vitro, natomiast zmiany próchnicowe powstałe w warunkach in vivo generują pojawienie się dodatkowych struktur, dających wzrost poziomu autofluorescencji zmian próchnicowych w porównaniu ze szkliwem zdrowym. Zastosowanie źródła laserowego o długości fali około 400 nm umożliwia uzyskanie silnego poziomu sygnałów emisji szkliwa, dużego kontrastu między prawidłową i uszkodzoną powierzchnią szkliwa oraz jednoczesną wyraźną detekcję porfiryn.
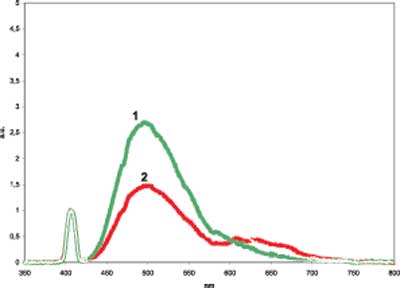
Ryc. 2. Wykres zależności natężenia fluorescencji od długości fali wzbudzenia (1 – światło zielone, 2 – światło czerwone).
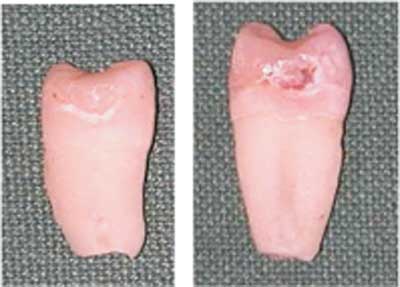
Ryc. 3. Przykładowe obrazy powierzchni badanych zębów zarejestrowane w świetle dziennym.
W prezentowanych badaniach, znając charakterystykę wzbudzeniowo-emisyjną szkliwa, podjęto próbę wykorzystania zmodyfikowanej metody LIF. Wzmocnienie kontrastu świecenia pomiędzy obszarem zdrowym i zmienionym próchnicowo uzyskano stosując metodę fluorescencji różnicowej.
Materiał i metody
Jako materiał do badań in vitro wykorzystano 40 ludzkich zębów usuniętych z różnych wskazań stomatologicznych, w tym również zęby zatrzymane. Zęby po ekstrakcji płukano pod bieżącą wodą, oczyszczano mechanicznie i przechowywano w roztworze wody destylowanej z dodatkiem kryształków tymolu. Oczyszczone i utrwalone zęby wykorzystywano do dalszych badań w postaci próbek szkliwa prawidłowego, odwapnionego w warunkach in vitro, oraz szkliwa z naturalnymi zmianami próchnicy wczesnej. Ocenie poddano styczne powierzchnie badanych zębów.
We wstępnej fazie badań do wizualizacji ocenianych obszarów zaadoptowano system LIFE firmy Xillix (ryc. 4). Układ ten przeznaczony jest do badań autofluorenscencji płuc. Obraz fluorescencji szkliwa obserwowanej po wzbudzeniu promieniowaniem lasera helowo-kadmowego, o mocy 15 mW na wyjściu obrazowodu, rejestrowany jest jednocześnie przez dwie kamery wyposażone – jedna w filtr zielony (520-530 nm) i druga w czerwony (630-640 nm).
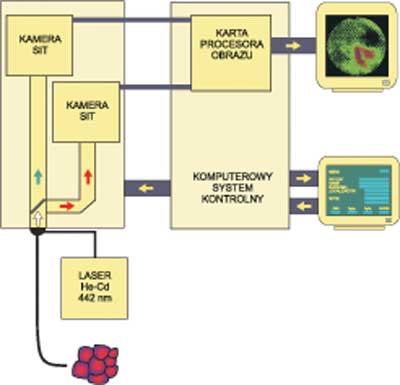
Ryc. 4. Schemat zaadaptowanego dla potrzeb badań systemu fluorescencji różnicowej LIFE.
Własny układ obrazowania fluorescencji różnicowej wzbudzonej na powierzchni badanych tkanek przedstawiono na rycinie 5. Omawiany system wyposażony był w końcówkę endoskopową, co umożliwi w przyszłości prowadzenie badań w warunkach in vivo. Źródło wzbudzenia w tego typu układach stanowią zwykle lasery o różnej mocy (20-50 mW), w zależności od długości stosowanych fal, lub ksenonowa lampa o mocy 300 W wyposażona w układ filtrów. W prezentowanym układzie wykorzystano laser półprzewodnikowy generujący promieniowanie o długości fali 407 nm i mocy ciągłej 25 mW (powierzchniowa gęstość mocy około 10 mW/cm2). Promieniowanie ze źródła transmitowane było cieczowym światłowodem o średnicy 5 mm do zewnętrznego toru giętkiego endoskopu. Promieniowanie odbite od tkanki i promieniowanie fluorescencji dochodziło torem centralnym endoskopu do czarno-białej kamery typu SIT o czułości 1x10-6 lux, wyposażonej w system filtrów. Układ optyczny rejestrował równolegle obrazy w paśmie czerwonym i zielonym. Specjalnie opracowany dla potrzeb badań program graficzny umożliwiał analizę obu otrzymanych obrazów.
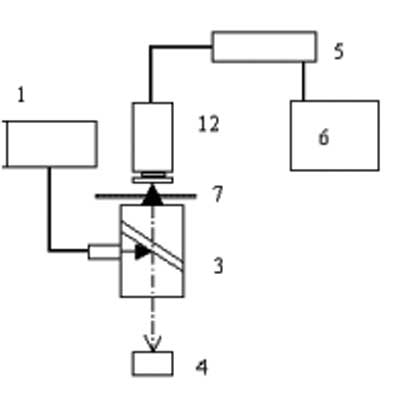
Ryc. 5. Schemat laboratoryjnego układu obrazowania fluorescencji wzbudzanej laserami: źródło laserowe ze światłowodem (1), kamera CCD (2), dzielnik wiązki promieniowania (3), powierzchnia zęba (4), moduł kontroli kamery (5) komputer PC z frame-graberem (6), koło filtrów (7).
Wyniki badań
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Andersson-Engels S. et al.: ,Fluorescence imaging and point measurements of tissue: aplications to the demarcation of malignant tumors and atherosclerotic lesion from normal tissue. Photochem. Photobiol., 1991, 53: 807-814. 2. Graczyk A.: Fotodynamiczna metoda rozpoznawania i leczenia nowotworów, Bellona, Warszawa, 1999. 3. Henderson B.W., Dougherty T.Y.: How does Photodynamic Therapy work? Photoche. Photobiol., 1992, 55: 145-157. 4. Bottiroli G. et al.: Natural fluorescence of normal and neoplastic human colon. A comprehensive "Ex vivo" study, Lasers Surg. Med., 1995, 16: 48-60. 5. Alfano R.R. et al.: Fluorescence spectra from cancerous and normal human breast and lung tissues. IEEE J. Quant. Electron., 1987, 10: 1806-1811. 6. .Andersson P.S. et al.: Autofluorescence of various rodent tissues and human skin tumors samples. Lasers Med. Sci, 1987, 2: 41-49. 7. Konig K. et al.: Laser induced autofluorescence of squamous cell carcinoma. Photodynamic Therapy and Biomedical Lasers, Excerpta Medica, 1992: pp 903-906. 8. Hung J. et al.: Autofluorescence of normal and malignant bronchial tissue. Lasers Surg. Med., 1991, 11: 99-10522. 9. Lam S. et al.: Detection of lung cancer by ratio fluorymetry with and without Photofrin. Proc. SPIE, 1990, 1201: 561-568. 10. Mielczarek A. i wsp.: Fotoluminescencja w nowoczesnej diagnostyce wczesnych zmian próchnicowych. Stomatologia Współczesna, 1998, 5(3): 179-183. 11. Mielczarek A. et al.: Diagnozowanie zmian próchnicowych z wykorzystaniem techniki laserowej. Badania porównawcze in vitro. Stomatologia Współczesna, 2000, 2: 13-17. 12. Mielczarek A. et al.: Differential fluorescence as a method used in caries diagnosis. (Abstract) J Dent Res, 2001, 80: 563.





