© Borgis - Nowa Pediatria 3/2007, s. 63-70
Motkowski Radosław1, Mikołuć Bożena1, Karpińska Joanna2, Janina Piotrowska-Jastrzębska1
Ocena stanu bariery antyoksydacyjnej u dzieci przedszkolnych leczonych w okresie niemowlęcym dietą eliminacyjną z powodu nadwrażliwości pokarmowej
Evaluation of antioxidant status of pre-school children treated in infancy with elimination diet due to food hypersensitivity
1Klinika Pediatrii i Zaburzeń Rozwoju Dzieci i Młodzieży Akademii Medycznej w Białymstoku
Kierownik Kliniki: Prof. dr hab. n. med. Janina Piotrowska-Jastrzębska
2Zakład Chemii Ogólnej i Nieorganicznej Uniwersytetu w Białymstoku
Streszczenie
The problem of feeding at the early stage of life cannot be considered only in respect of the direct influence of food elements on a child´s development.
Aim. Considering the increasing social and clinical problem of food allergies in children, the necessity of an elimination diet and the theory of "metabolic programming”, the aim of this paper was specified as an attempt to answer the question: "Has elimination diet applied in children with food hypersensitivity any effect on plasma levels of anti-oxidative vitamins and anti-ox-LDL antibody titre in these children at their pre-school age?”
Material. Considering the assumed inclusion and exclusion criteria, among 2.627 children surveyed at pre-school age, 154 children from 3 to 7 years of age (47.4% girls, 52.6% boys) were randomised in the group examined. The study group was divided into two groups: group I (n = 49) and II (n = 43) consisted of children treated in their infancy and early childhood age due to food hypersensitivity with soy formula (group I) or casein hydrolysate (group II) as a milk substitute for at least 12 months. Group III (control) comprised 62 children, who had never been treated with an elimination diet and who have been fed according to the nutritional rules for healthy children.
Method. The status of the anti-oxidative system was evaluated by simultaneous determination of retinol, a-tocopherol and coenzyme Q10 levels by High Performance Liquid Chromatography (HPLC). The titre of antibodies to oxidised LDL lipoproteins was specified by immunoenzymatic assay.
On the basis of the test results, the following
Conclusions have been reached:
1. It was shown that a-tocopherol and retinol levels in pre-school children, who had received dietary treatment in their infancy, were higher than in the control group.
2. A type of milk-substitute formula applied in the elimination diet had no effect on the status of the anti-oxidative system in the children examined.
3. A positive family history of early occurrence of circulatory disorders had no effect on the anti-oxidative system parameters examined in the pre-school children.

WSTĘP
Rozpoznanie w okresie niemowlęcym nadwrażliwości pokarmowej wiąże się z zastosowaniem w leczeniu diety eliminacyjnej. Jest to czasowe lub stałe wyeliminowanie z diety chorego dziecka pojedynczego lub kilku składników pokarmowych, które powodują występowanie niepożądanych reakcji alergicznych. Wyeliminowany z diety pokarm powinien być zastąpiony innym, o równoważnych wartościach odżywczych (1). Postępowanie takie, poza poprawą stanu klinicznego, zapewnia prawidłowy rozwój dziecka i zabezpiecza przed wystąpieniem ilościowych i jakościowych stanów niedoborowych (2).
W leczeniu dietetycznym alergii na białka mleka krowiego mają zastosowanie preparaty o znacznym stopniu hydrolizy białek mleka krowiego, zarówno kazeiny jak i białek serwatkowych. W terapii nadwrażliwości pokarmowej wykorzystywane są także preparaty mlekozastępcze zawierające białko soi (1, 3, 4).
Na obecnym etapie wiedzy problem żywienia we wczesnym okresie życia, w tym dietetycznego nie może być rozpatrywany tylko i wyłącznie w aspekcie bezpośredniego wpływu składników pokarmowych na rozwój dziecka. Należy uwzględniać także odległe następstwa diety stosowanej w pierwszych latach życia. W 1986 roku Barker (5) opublikował wyniki badań epidemiologicznych dotyczących związku pomiędzy czynnikami żywieniowymi działającymi we wczesnym okresie życia, a występowaniem chorób przewlekłych w wieku dojrzałym. Jak dotąd, najwięcej informacji potwierdzających te zależności dostarczyły badania eksperymentalne przeprowadzone na modelach zwierzęcych (6-8).
W 1991 roku Allan Lucas (9) przedstawił teorię „programowania metabolicznego”, która łączy wpływ czynników żywieniowych i metabolicznych działających w tzw. „krytycznych” okresach rozwoju człowieka, z występowaniem przewlekłych chorób w wieku dojrzałym. Za krytyczny okres ontogenezy uznawany jest okres prenatalny, niemowlęcy i wczesnego dzieciństwa. Powyższą teorię potwierdzają badania dotyczące wpływu żywienia kobiet ciężarnych na urodzeniową masę ciała i stan zdrowia ich dzieci w wieku dojrzałym (10).
Znany jest wpływ długotrwale stosowanej diety bezmlecznej na wskaźniki rozwoju somatycznego, procesy mineralizacji tkanki kostnej oraz metabolizm białka (2, 11-13).
U dzieci z alergią/nadwrażliwością pokarmową nie są jednak poznane odległe następstwa stosowanego we wczesnych okresach ontogenezy leczenia żywieniowego na stan bariery antyoksydacyjnej. Brak jest danych w piśmiennictwie dotyczących zależności pomiędzy rodzajem stosowanej u niemowląt diety, a stwierdzanym w późniejszych okresach życia stanem antyoksydacyjnym organizmu.
W warunkach fizjologicznych istnieje w organizmie równowaga pomiędzy utleniaczami i przeciwutleniaczami. Wzrost produkcji reaktywnych form tlenu (RFT) lub spadek aktywności antyoksydacyjnej powoduje jej zachwianie w kierunku reakcji utleniania powodując stres oksydacyjny (14). W wyniku zaburzeń równowagi oksydacyjnej ustroju największym modyfikacjom strukturalnym i funkcjonalnym ulegają lipidy (15). Jednym z opisywanych w piśmiennictwie markerów peroksydacji lipidów jest miano przeciwciał przeciwko zmodyfikowanym oksydacyjnie lipoproteinom LDL (ox-LDL). Najważniejszym elementem obrony antyoksydacyjnej lipidów są witaminy rozpuszczalne w tłuszczach wykazujące właściwości zmiataczy wolnych rodników. Należą do nich tokoferole (witamina E), karotenoidy i retinol (witamina A) oraz koenzym Q10 (16).
Biorąc pod uwagę zwiększającą się częstość występowania alergii pokarmowej u dzieci, konieczność stosowania leczniczej diety eliminacyjnej oraz teorię „programowania metabolicznego”, za cel pracy przyjęto próbę odpowiedzi na pytanie czy lecznicza dieta eliminacyjna stosowana u dzieci z nadwrażliwością pokarmową w okresie niemowlęcym ma wpływ na osoczowe stężenie witamin antyoksydacyjnych i miano przeciwciał przeciwko ox-LDL oceniane u tych dzieci w wieku przedszkolnym?
MATERIAŁ I METODY
Kwalifikacji dzieci do badania dokonano w oparciu o metodę ankietową. Po przekazaniu rodzicom/opiekunom dzieci informacji o celu i zasadach prowadzonego badania wydano do wypełnienia 3900 kwestionariuszy ankiet, uzyskując zwrotnie 2627 (67,3 %).
Ankiety analizowano pod względem informacji dotyczących sposobu żywienia badanych dzieci w okresie niemowlęcym (w tym leczenia dietą eliminacyjną) oraz wywiadu rodzinnego obciążonego lub nie przedwczesnym występowaniem chorób układu krążenia.
W ocenie sposobu żywienia dzieci leczonych w okresie niemowlęcym dietą eliminacyjną uwzględniono wiek rozpoczęcia i czas leczenia dietetycznego oraz rodzaj zastosowanego preparatu mlekozastępczego.
Szczegółowy wywiad rodzinny dziecka dotyczył występowania u członków rodziny do drugiego pokolenia takich problemów zdrowotnych jak: nadciśnienie tętnicze, choroba wieńcowa, miażdżyca tętnic obwodowych, cukrzyca, otyłość oraz wysokie stężenie cholesterolu w surowicy. Do grupy z wywiadem rodzinnym obciążonym przedwczesnym występowaniem chorób układu krążenia kwalifikowano dzieci zgodnie z zaleceniami Amerykańskiej Akademii Pediatrii (17), rozszerzonymi o przedwczesne występowanie nadciśnienia i otyłości.
Stwierdzono, że 1185 (45,1 %) ankietowanych dzieci otrzymywało w niemowlęctwie dietę eliminacyjną w celach diagnostycznych (2-3 tygodnie) lub terapeutycznych (do kilku lat). U 1158 (44,1%) badanych dzieci stwierdzono w rodzinie przedwczesne występowanie chorób układu krążenia.
Do drugiego etapu badań zakwalifikowano 187 dzieci (7,11 % z 2627) w wieku od 3 do 7 lat, u których potwierdzono rozpoznanie nadwrażliwości pokarmowej, leczenie dietą eliminacyjną rozpoczęto w pierwszym półroczu życia, a w terapii trwającej minimum 12 miesięcy stosowano tylko jeden rodzaj preparatu mlekozastępczego: preparat sojowy lub hydrolizat kazeiny.
Kryteria wyłączenia z badań obejmowały wywiad obciążony występowaniem chorób przewlekłych, chorobę infekcyjną w dniu badania i w okresie 3 tygodni wcześniej, leczenie systemowe glikokortykosteroidami, otyłość (ciężar ciała powyżej 97 centyla) oraz podejrzenie nadciśnienia tętniczego (ciśnienie tętnicze skurczowe lub rozkurczowe powyżej 97 centyla stwierdzone w dwóch pomiarach).
Metodą losowania dokonano doboru pacjentów do grupy badanej (n = 92, 43 dziewczynki i 49 chłopców) i do grupy kontrolnej (n = 62, 30 dziewczynek i 32 chłopców). Grupę kontrolną stanowiły dzieci zdrowe, które nigdy nie były leczone dieta eliminacyjną. Utworzone zostały trzy grupy badanych dzieci. Grupę I stanowiło 49 dzieci w wieku średnio 5,37 lat (SD 1.14) leczonych w okresie niemowlęcym i wczesnodziecięcym mlekozastępczymi preparatami sojowymi. Grupa II obejmowała 43 dzieci w wieku średnio 5.10 lat (SD 1.20) leczonych w okresie niemowlęcym i wczesnodziecięcym mlekozastępczym hydrolizatem kazeiny. Grupę kontrolną (III) stanowiło 62 dzieci w wieku średnio 5,63 lat (SD 1,13), u których w żadnym okresie życia nie była stosowana dieta eliminacyjna i były karmione wg zasad prawidłowego żywienia dzieci zdrowych.
Badania przeprowadzono w Poradni Konsultacyjnej Kliniki Pediatrii i Zaburzeń Rozwoju Dzieci i Młodzieży Samodzielnego Publicznego Dziecięcego Szpitala Klinicznego Akademii Medycznej w Białymstoku po uzyskaniu świadomej, pisemnej zgody rodzica/opiekuna dziecka na udział w badaniu. Na przeprowadzenie badań uzyskano zgodę Komisji Bioetycznej Akademii Medycznej w Białymstoku.
Ocena stężenia alfa-tokoferolu, retinolu i koenzymu Q10 została przeprowadzona w osoczu badanych dzieci. Miano przeciwciał przeciwko zmodyfikowanym oksydacyjnie lipoproteinom LDL określono w surowicy.
Krew do badań pobierana była w godzinach rannych, przynajmniej po 12 godzinach od ostatniego posiłku. Materiał do oznaczenia miana przeciwciał pobierany był w ilości 2 ml do szklanej probówki bez antykoagulanta. Po odwirowaniu surowica była zamrażana w temperaturze -70°C w odpowiednio oznakowanych próbówkach do czasu przeprowadzenia oznaczeń. Krew do oznaczenia witamin antyoksydacyjnych w ilości 1,8 ml pobierana była do próbówki z 3,8% cytrynianem sodowym w proporcji 9:1. Po odwirowaniu w temp. 4° C przez 30 minut supernatant był przenoszony do głębokiego zamrożenia w temperaturze -70°C. Do oznaczenia miana przeciwciał przeciwko zmodyfikowanym oksydacyjnie lipoproteinom LDL wykorzystana została metoda immunoenzymatyczna z wykorzystaniem odczynników firmy Biomedica. Miano przeciwciał przeciwko ox-LDL określone zostało w milijednostkach na mililitr (mU/ml). Stężenia retinolu, a-tokoferolu i koenzym Q10 (wyrażone w mikromolach na litr) oznaczone zostały metodą symultanicznego określania ilości tych witamin w jednej, małej próbce osocza z wykorzystaniem wysokosprawnej chromatografii cieczowej w oparciu o zestaw do HPLC produkcji Thermo Separation, USA (18).
Metody statystyczne
Uzyskane wyniki badań poddano analizie statystycznej, w której dla cech mierzalnych wyliczono średnią arytmetyczną i 95% przedział ufności (CI, ang. Confidence Interval) dla tej średniej, medianę oraz odchylenie standardowe, zaś dla cech jakościowych ich rozkład ilościowo-procentowy.
Przy pomocy testu Kołmogorowa-Smirnoffa dokonano oceny rozkładu badanych cech, a ze względu na brak zmiennych o rozkładzie normalnym do porównań między grupami stosowano test U Manna-Whitney´a. Współzależność między cechami jakościowymi oceniano testem niezależności c2. W analizie regresji wielokrotnej zastosowano metodę standardową i krokową postępującą.
W obliczeniach przyjęto poziom istotności p<0,05 jako znamienny statystycznie, upoważniający do odrzucenia poszczególnych stawianych hipotez zerowych.
W opracowywaniu danych wykorzystano pakiet statystyczny Statistica 5.0 w wersji polskojęzycznej przeznaczonej dla komputerów osobistych z systemem operacyjnym Windows.
WYNIKI
Analiza wyników badań dzieci z nadwrażliwością pokarmową wykazała, że w leczeniu dietetycznym hydrolizaty kazeiny były wprowadzane w wieku 3,4 miesiąca (CI 2,8-4,0), o 1 miesiąc wcześniej niż preparaty sojowe - średnio 4,4 miesiąca (CI 4,0-4,9), (p = 0,031). Nie stwierdzono różnic istotnych statystycznie dotyczących czasu stosowania diety eliminacyjnej. W badanych grupach wynosił on średnio 29 miesięcy w grupie I (CI 25,5-33,4) i 28 miesięcy w grupie II (CI 25,2-31,4) (p=0,55).
Dokonano analizy sposobu żywienia badanych dzieci w wieku przedszkolnym. Stwierdzono, że dzieci uczęszczając do przedszkola przez 5 dni w tygodniu były karmione według obowiązujących w Polsce zasad racjonalnego żywienia dzieci zdrowych w wieku 3-6 lat.
Oznaczone w wieku przedszkolnym miano przeciwciał przeciwko zmodyfikowanym oksydacyjnie lipoproteinom LDL wynosiło u 92 dzieci leczonych w niemowlęctwie dietą eliminacyjną średnio 942 mIU/ml (CI 745 – 1139, SD 898) i było niższe niż w grupie kontrolnej (1348 mIU/ml (CI 1120 – 1577, SD 861) (p = 0,0001) (ryc. 1.). Nie wykazano istotnych statystycznie różnic w zależności od rodzaju stosowanego preparatu mlekozastępczego (tab. 1).
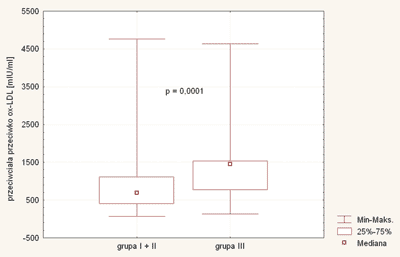
Ryc. 1. Miano przeciwciał przeciwko ox-LDL u badanych dzieci.
Tabela 1. Miano przeciwciał przeciwko zmodyfikowanym oksydacyjnie lipoproteinom LDL oraz stężenia witamin antyoksydacyjnych u dzieci przedszkolnych leczonych w okresie niemowlęcym dietą eliminacyjną w zależności od stosowanego preparatu mlekozastępczego.
| Badane parametry | GRUPA I preparat sojowy | GRUPA II hydrolizat kazeiny | p |
| n | śr. | CI -95 % | CI + 95% | mediana | SD | n | śr. | CI -95 % | CI + 95% | mediana | SD |
| Miano przeciwciał przeciwko ox-LDL (mIU/ml) | 49 | 858,0 | 591,7 | 1124 | 687,5 | 865,3 | 43 | 1035,7 | 732,5 | 1339 | 767,7 | 935,4 | 0,31 |
| koenzym Q10 (mmol/l) | 49 | 0,38 | 0,22 | 0,54 | 0,21 | 0,53 | 43 | 0,41 | 0,20 | 0,60 | 0,17 | 0,63 | 0,929 |
| retinol (mmol/l) | 49 | 3,10 | 2,49 | 3,71 | 2,69 | 2,03 | 43 | 3,51 | 2,85 | 4,17 | 2,87 | 2,09 | 0,285 |
| a-tokoferol (mmol/l) | 49 | 31,96 | 24,28 | 39,64 | 23,16 | 25,56 | 43 | 26,67 | 20,97 | 32,39 | 26,01 | 18,09 | 0,50 |
Przeprowadzona u dzieci w wieku przedszkolnym ocena stężenia koenzymu Q10 w osoczu nie wykazała różnic istotnych statystycznie w badanych grupach (p=0,492).W grupie badanej wynosiło ono średnio 0,39 mmol/l (CI 0,27 – 0,52, SD 0,58), a w grupie kontrolnej 0,48 mmol/l (CI 0,24 – 0,71, SD 0,87) Średnie stężenie retinolu w osoczu dzieci leczonych dietą eliminacyjną wynosiło 3,30 mmol/l (CI 2,86 – 3,74, SD 2,06) i było istotnie statystycznie wyższe (p=0,016) niż w grupie kontrolnej – 2,44 mmol/l (CI 1,98 – 2,89, SD 1,68) (ryc. 2). Podobną różnicę (p=0,038) stwierdzono dla ocenianych w wieku przedszkolnym średnich stężeń a-tokoferolu – 29,44 mmol/l (CI 24,65 – 34,24, SD 22,35) vs 21,95 (CI 17,35 – 26,55, SD 17,01) (ryc. 3).
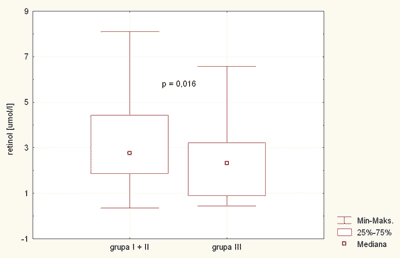
Ryc. 2. Stężenie retinolu w badanych grupach dzieci.

Ryc. 3. Stężenie a -tokoferolu w badanych grupach dzieci.
Stężenia retinolu wyższe niż 2,8 mmol/ wykazano u 49% dzieci w wieku przedszkolnym leczonych w okresie niemowlęcym dietą eliminacyjną, a w grupie dzieci zdrowych u 32% (p=0,04). U 25% badanych dzieci w wieku przedszkolnym leczonych w okresie niemowlęcym dietą eliminacyjną, stężenie a-tokoferolu było wyższe niż 37 mmol/l.
Rodzaj preparatu mlekozastępczego stosowanego w żywieniu dzieci z nadwrażliwością pokarmową nie miał wpływu na stężenie badanych witamin antyoksydacyjnych ocenianych w wieku przedszkolnym (tab. 1).
Miano przeciwciał przeciwko zmodyfikowanym oksydacyjnie lipoproteinom LDL oraz stężenie witamin antyoksydacyjnych analizowano w odniesieniu do wywiadu rodzinnego dziecka. Nie stwierdzono istotnych statystycznie różnic pomiędzy grupą dzieci z wywiadem rodzinnym obciążonym i nieobciążonym przedwczesnym występowaniem chorób układu krążenia (tab. 2).
Tabela 2. Miano przeciwciał przeciwko zmodyfikowanym oksydacyjnie lipoproteinom LDL oraz stężenia witamin antyoksydacyjnych w grupach dzieci z obciążonym nie obciążonym wywiadem rodzinnym chorobami układu krążenia
| grupa z obciążonym wywiadem rodzinnym | grupa z nieobciążonym wywiadem rodzinnym | p |
| n | śr. | CI -95 % | CI + 95% | mediana | SD | n | śr. | CI -95 % | CI + 95% | mediana | SD |
| Miano przeciwciał przeciwko ox-LDL (mIU/ml) | 91 | 1071 | 878 | 1263 | 824,35 | 876,3 | 63 | 1163 | 913,1 | 1414 | 986,9 | 944,8 | 0,38 |
| koenzym Q10 (mmol/l) | 91 | 0,44 | 0,31 | 0,58 | 0,19 | 0,63 | 63 | 0,39 | 0,17 | 0,62 | 0,16 | 0,83 | 0,41 |
| retinol (mmol/l) | 91 | 3,01 | 2,63 | 3,39 | 2,65 | 1,80 | 63 | 2,89 | 2,28 | 3,49 | 2,42 | 2,20 | 0,33 |
| a-tokoferol (mmol/l) | 91 | 26,14 | 21,91 | 30,38 | 19,28 | 19,88 | 63 | 27,13 | 21,09 | 33,16 | 21,65 | 22,12 | 0,8 |
Wykorzystując metody analizy regresji wielokrotnej oceniono zależności pomiędzy mianem przeciwciał przeciwko ox-LDL, a wiekiem badanych dzieci, płcią, BMI, urodzeniową masą ciała, czasem karmienia piersią, czasem rozpoczęcia diety eliminacyjnej oraz stężeniami retinolu i a-tokoferolu. W sposób istotny statystycznie stężenie ox-LDL zależało w ocenianym modelu od zastosowania w leczeniu diety eliminacyjnej (p=0,01) (tab. 3).
Tabela 3. Wyniki oceny modelu regresji wielokrotnej z analizą miana przeciwciał przeciwko ox-LDL jako zmiennej zależnej.
| Zmienna | b | Błąd standardowy b | p |
| wyraz wolny | - | - | 0,46 |
| leczenie dietą eliminacyjną | 0,25 | 0,09 | 0,01 |
| stężenie retinolu | 0,07 | 0,08 | 0,39 |
| stężenie a-tokoferolu | 0,03 | 0,08 | 0,72 |
| urodzeniowa masa ciała | 0,05 | 0,08 | 0,54 |
| wiek rozpoczęcia diety eliminacyjnej | 0,01 | 0,08 | 0,95 |
| wiek dziecka | 0,13 | 0,09 | 0,14 |
| BMI | -0,08 | 0,08 | 0,35 |
| płeć | -0,03 | 0,08 | 0,72 |
| czas karmienia piersią | -0,13 | 0,08 | 0,1 |
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Kaczmarski M.: Stanowisko Polskiej Grupy Ekspertów: Alergia i nietolernacja pokarmowa. Warszawa: Unimed; 1997. 2. Piotrowska-Jastrzębska J.: Badania auksologiczne i densytometryczne dzieci z nadwrażliwością pokarmową leczonych dietą eliminacyjną. Rozprawa habilitacyjna.: Akademia Medyczna w Białymstoku; 1998. 3.Host A., et al.: Dietary products used in infants for treatment and prevention of food allergy. Joint Statement of the European Society for Paediatric Allergology and Clinical Immunology (ESPACI) Committee on Hypoallergenic Formulas and the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN) Committee on Nutrition. Arch. Dis. Child., 1999; 81, 1: 80-4. 4.Osborn D.A., Sinn J.: Formulas containing hydrolysed protein for prevention of allergy and food intolerance in infants. Cochrane Database Syst. Rev., 2003, 4: CD003664. 5.Barker D.J., Osmond C.: Infant mortality, childhood nutrition, and ischaemic heart disease in England and Wales. Lancet 1986; 1, 8489: 1077-81. 6. Desai M., et al.: Organ-selective growth in the offspring of protein-restricted mothers. Br. J. Nutr., 1996; 76, 4: 591-603. 7.Mott G.E., et al.: Cholesterol metabolism in adult baboons is influenced by infant diet. J. Nutr., 1990; 120, 3: 243-51. 8. Reiser R., Sidelman Z.: Control of serum cholesterol homeostasis by cholesterol in the milk of the suckling rat. J. Nutr., 1972; 102, 8: 1009-16. 9. Lucas A.: Programming by early nutrition in man. Ciba Found Symp., 1991; 156: 38-50; discussion 50-5. 10.Ravelli A.C., et al.: Obesity at the age of 50 y in men and women exposed to famine prenatally. Am. J. Clin. Nutr., 1999; 70, 5: 811-6. 11.Hernell O., Lonnerdal B.: Nutritional evaluation of protein hydrolysate formulas in healthy term infants: plasma amino acids, hematology, and trace elements. Am. J. Clin. Nutr., 2003; 78, 2: 296-301. 12.Konstantynowicz J., et al.: Densytometryczna ocena zasobów mineralnych u dzieci i młodzieży z nadwrażliwością pokarmową leczonych dietetycznie. Pol. Merkuriusz Lek., 1998; 5, 28: 203-207. 13.Szajewska H., et al.: Czy odpowiedź metaboliczna i wzrastanie wcześniaków żywionych hydrolizatami białkowymi odbiegają od obserwowanych u karmionych standardowym mlekiem modyfikowanym? Pediatr. Pol. 2002; 77, 7: 569-577. 14.Gutteridge J.M.: Free radicals in disease processes: a compilation of cause and consequence. Free Radic. Res. Commun., 1993; 19, 3: 141-58. 15.Rozenberg O., et al.: Paraoxonase (PON1) deficiency is associated with increased macrophage oxidative stress: studies in PON1-knockout mice. Free Radic. Biol. Med., 2003; 34, 6: 774-84. 16.Engler M.M., et al.: Antioxidant Vitamins C and E Improve Endothelial Function in Children With Hyperlipidemia: Endothelial Assessment of Risk from Lipids in Youth (EARLY) Trial. Circulation 2003; 108, 9: 1059-1063. 17. American Academy of Pediatrics. Committee on Nutrition. Cholesterol in childhood. Pediatrics 1998; 101, 1 Pt 1: 141-7. 18.Karpinska J., et al.: HPLC method for simultaneous determination of retinol, alpha-tocopherol and coenzyme Q10 in human plasma. J. Pharm. Biomed. Anal., 2006; 42, 2: 232-6. 19.Pokuszyńska K., et al.: Wpływ leczenia dietą hipoalergiczną na składniki bariery antyoksydacyjnej i produkty peroksydacji lipidów u dzieci z alergią pokarmową. Alerg Astma Immun. 2000; 5, 1: 68-73. 20. Proszynska K., Lorenc R.S.: Witaminy A, D, E - znaczenie, zapotrzebowanie, suplementacja, toksyczność. Medycyna 2000 1998; 2, 1: 40-43. 21.Shanmugasundaram K.R., et al.: Excessive free radical generation in the blood of children suffering from asthma. Clin. Chim. Acta., 2001; 305, 1-2: 107-14. 22. Van Biervliet J.P., et al.: Serum cholesterol, cholesteryl ester, and high-density lipoprotein development in newborn infants: response to formulas supplemented with cholesterol and gamma-linolenic acid. J. Pediatr., 1992; 120, 4 Pt 2: S101-8. 23. Wachnik-Swiecicka A., Rudzka-Kantoch Z.: Ocena stężenia witaminy A oparta o oznaczenia retinolu w surowicy dzieci i niemowląt. Pediatr. Pol., 1995; 70, 4: 303-6. 24. Ballew C., et al.: Serum retinol distributions in residents of the United States: third National Health and Nutrition Examination Survey, 1988-1994. Am. J. Clin. Nutr., 2001; 73, 3: 586-93. 25. Karr M., et al.: Age-specific reference intervals for plasma vitamins A, E and beta-carotene and for serum zinc, retinol-binding protein and prealbumin for Sydney children aged 9-62 months. Int. J. Vitam. Nutr. Res., 1997; 67, 6: 432-6. 26. Ashour M.N., et al.: Antioxidant status in children with protein-energy malnutrition (PEM) living in Cairo, Egypt. Eur. J. Clin. Nutr., 1999; 53, 8: 669-73. 27. Maxwell S.R.: Prospects for the use of antioxidant therapies. Drugs 1995; 49, 3: 345-61. 28. Kayden H.J., Traber M.G.: Absorption, lipoprotein transport, and regulation of plasma concentrations of vitamin E in humans. J. Lipid. Res., 1993; 34, 3: 343-58. 29. Nagao A.: Oxidative Conversion of Carotenoids to Retinoids and Other Products. J. Nutr., 2004; 134, 1: 237S-240. 30.Wittenstein B., et al.: Plasma antioxidants in pediatric patients with glycogen storage disease, diabetes mellitus, and hypercholesterolemia. Free Radic. Biol. Med. 2002; 33, 1: 103-10. 31.Mikoluc B., et al.: Coenzyme Q10 level in plasma of children with inflammatory process. Rocz. Akad. Med. Bialymst., 2002; 47: 123-9. 32. Artuch R., et al.: Serum ubiquinone-10 in a pediatric population. Clin. Chem., 1998; 44, 11: 2378-9. 33. Steghens J.P., et al.: Simultaneous measurement of seven carotenoids, retinol and alpha-tocopherol in serum by high-performance liquid chromatography. J. Chromatogr. B. Biomed. Sci. Appl., 1997; 694, 1: 71-81. 34. Weinmann A.R., et al.: Simultaneous high-performance liquid chromatographic determination of retinol by fluorometry and of tocopherol by ultraviolet absorbance in the serum of newborns. J. Chromatogr. B. Biomed. Sci. Appl., 1999; 729, 1-2: 231-6. 35.Gazdik F., et al.: Decreased levels of coenzyme Q(10) in patients with bronchial asthma. Allergy 2002; 57, 9: 811-4. 36. Danysz A., Kwieciński A.: Właściwości farmakologiczne i lecznicze koenzymu Q10. Farm. Pol., 1997; 53, 13: 589-597. 37.Erkkila A.T., et al.: Autoantibodies against oxidized low-density lipoprotein and cardiolipin in patients with coronary heart disease. Arterioscler Thromb. Vasc. Biol. 2000; 20, 1: 204-9. 38. Frostegard J., et al.: Circulating oxidized low-density lipoprotein is increased in hypertension. Clin. Sci. (Lond), 2003; 105, 5: 615-20. 39. Aviram M.: Review of human studies on oxidative damage and antioxidant protection related to cardiovascular diseases. Free Radic. Res., 2000; 33 Suppl: 85-97. 40. Geng Y.J., Libby P.: Evidence for apoptosis in advanced human atheroma. Colocalization with interleukin-1 beta-converting enzyme. Am. J. Pathol., 1995; 147, 2: 251-66. 41.Liuba P., et al.: Acute infections in children are accompanied by oxidative modification of LDL and decrease of HDL cholesterol, and are followed by thickening of carotid intima-media. Eur. Heart. J. 2003; 24, 6: 515-21. 42.Skrzep-Poloczek B., et al.: Nephrotic origin hyperlipidemia, relative reduction of vitamin E level and subsequent oxidative stress may promote atherosclerosis. Nephron. 2001; 89, 1: 68-72. 43. Simonini G., et al.: Evidence for immune activation against oxidized lipoproteins in inactive phases of juvenile chronic arthritis. J. Rheumatol., 2001; 28, 1: 198-203. 44.Benabdeslam H., et al.: Lipid peroxidation and antioxidant defenses in cystic fibrosis patients. Clin. Chem. Lab. Med., 1999; 37, 5: 511-6. 45.Vasankari T., et al.: Reduced mildly oxidized LDL in young female athletes. Atherosclerosis 2000; 151, 2: 399-405. 46.Setchell K.D., et al.: Isoflavone content of infant formulas and the metabolic fate of these phytoestrogens in early life. Am. J. Clin. Nutr., 1998; 68, 6 Suppl): 1453-1461.



