© Borgis - Nowa Pediatria 3/2004, s. 110-115
Andrzej Brzecki
Uzasadnienie leczenia klenbuterolem niektórych chorób ośrodkowego układu nerwowego
Finding grounds for medical treatment of some CNS using clenbuterol
z Centrum Rehabilitacji dla Dzieci Niepełnosprawnych, Strzelin/Mikoszów
Streszczenie
In the pictures the results of sympathetic cerebropetal exclusion in an experimental osmotic and angiogenic edema influenced by stimulants and anaesthetic´s factors are presented. The results are in accordance with the latest research and they confirm the reports concerning significance of astrocyte in a role of an intermediary in the blood ... barrier and sensibility of brain tissues that is connected their neurobiological activity. Low responsiveness to stimuli of brain tissues and changes in brain microvessel permeability (e.g. in a coma) results in inhibitory stimulation (GABA-ergic).
The above, as well as other mentioned data, prove that adrenomimetic medicines work neuroprotectively and that they affect brain activities connected with both a local blood flow and neurochemical stimulation. The issue of neuroprotective factors has been explicated and the significance of adrenomimetics-clenbuterol which stimulates beta2-adrenoreceptors of transverse striated muscles and protects brain by means of brain derived neurothropic factors (BDNF) has been emphacised. On this basis, we have put forward the hypothesis about neuro-degenerative CNS illnesses´ treatment. The significance of adrenergic neurotransmitters and other stimulation of a central regulation and some possibilities of administration of beta2-adrenomimetics in some motor disturbances of CNS has been discussed. The usefulness of application of clenbuterol in children cerebral palsy has been motivated. Clenbuterol has been used in the treatment in Rehabilitation Centre in Mikoszów near Strzelin. It has turned out that this well known medicine in asthma treatment, of both children and adults, showing practically no side effects, is useful in treatment of children with some disturbances of the central narvous system, in particular, with various sorts of motor hyperexcitability, and moreover, with motor paresis.

Przedstawiono własne badania doświadczalne nad zachowaniem się obrzęku mózgu pod wpływem niektórych czynników nerwowych oraz wskazania do stosowania klenbuterolu w zaburzeniach ośrodkowego układu nerwowego, ze szczególnym uwzględnieniem mózgowego porażenia dziecięcego.
W organizacji strukturalnej układu współczulnego mózgu znamienna jest obecność obwodowych struktur autonomicznych, które działają przez pień współczulny ( truncus sympaticus). Z rostralnego odcinka pnia, a w szczególności ze zwoju szyjnego górnego, współczulne włókna pozazwojowe splotu okołotętniczego oplatają tętnice szyjne ( plexus caroticus communis). Końcowe rozgałęzienia splotu tętnicy szyjnej wewnętrznej ( plexus caroticus internus) leżą pomiędzy przydanką ( adventitia) a błoną środkową ( media) (33) i obejmują mózg wraz z przysadką i szyszynką. Neuroprzekaźnik adrenergiczny (oraz zapewne i neuroprzekaźniki peptydowe – endorfiny, enkefaliny i in. wydzielany z zakończeń włókien współczulnych reguluje przepuszczalność śródbłonka włośniczek (6) oraz transport poprzez barierę krew-mózg, za pośrenictwem astrocytów, które łączą ściany włośniczek z neurocytami. Astrocyty spełniają też inne funkcje, np. wychwytują nadmiar jonów K+, zaopatrują neurocyty w glukozę, zapobiegają dyfuzji neuroprzekaźnika poza szczelinę synaptyczną, etc. (25). Neuroprzekaźnik adrenergiczny z zakończeń włókien współczulnych oddziałuje nadto z receptorami adrenergicznymi pinealocytów szyszynki i stymuluje syntezę melatoniny (30). Nie wiemy, czy obwodowe tj. pochodzące ze splotu około tętnicy szyjnej wewnętrznej pobudzenia współczulne mózgu przeważają nad ośrodkowymi pobudzeniami adrenergicznymi, których źródłem są neurony umiejscowione w miejscu sinawym ( locus ceruleus), tworzące ośrodek, zaopatrujący cały mózg (23).
W doświadczalnym obrzęku wodnym (naczyniopochodnym i osmotycznym) obserwowano skutki wyłączenia splotu około tętnicy wewnętrznej oraz zachowanie się tego obrzęku pod wpływem pobudzenia tkanki nerwowej i w narkozie (9). Po kraniotomii i przecięciu opony twardej można było obserwować wypuklenie obrzękłej tkanki mózgowej spod opony i pobrać materiał żywej tkanki mózgu do badania. Model zatrucia wodnego stosunkowo mało obciążał zwierze doświadczalne (większość przeżywała). Uzyskane efekty obrzęku były powtarzalne i okazało się możliwe przy pomocy mikroskopii świetlnej-kontrastowo-fazowej, śledzenie delikatnych zmian morfologicznych włośniczek i żywej tkanki nerwowej (ryciny 1-9).
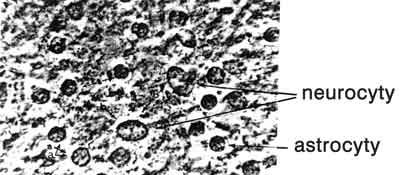
Ryc. 1. Warstwa korowa mózgu zdrowego szczura. Pow. ok. 1350 x.
Ryc. 2. Warstwa korowa mózgu zdrowego szczura: wśród zbitej tkanki (neuropilu) widoczne są włośniczki; dwie z nich zdradzają swoją obecność przez znajdujące się w ich świetle krwinki czerwone, inne przedstawiają się jako szare smugi. Pow. ok. 900 x.

Ryc. 3. Warstwa korowa mózgu zdrowego szczura. Wśród zbitej tkanki (neuropilu) przebiega włośniczka obudowana komórkami śródbłonka. W środku naczynia – krwinki czerwone. Pow. ok. 900 x.
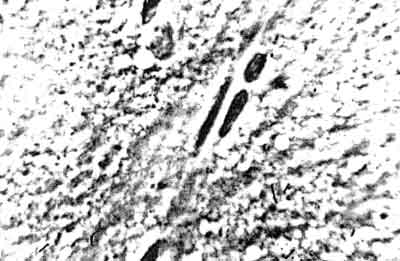
Ryc. 4. Warstwa korowa graniczy z istotą białą mózgu zdrowego szczura: po lewej widoczne oligodendrocyty o wyraźnych pęcherzykowych jądrach, po prawej przeważają neurocyty.

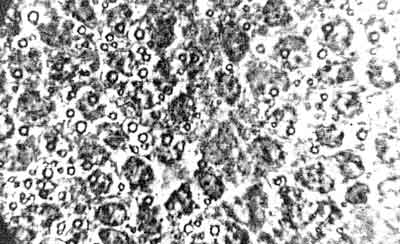
Ryc. 5. Obrzęk mózgu szczura: wokół włośniczek wypełnionych szczelnie krwinkami czerwonym (zastój) widoczne są okołonaczyniowe pochewki płynu obrzękowego, a w neuropilu przejaśnienia utworzone przez płyn obrzękowy. Pow. ok. 900 x.
Ryc. 6. Obrzęk mózgu szczura: rozdęte, znacznie zmienione astrocyty. Pow. ok. 1300 x.
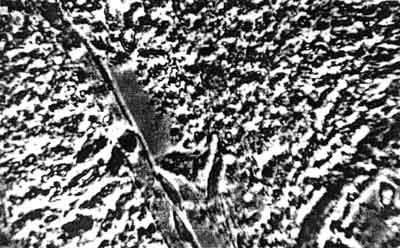
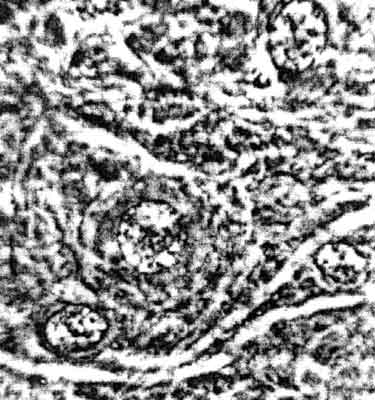
Ryc. 7. Obrzęk mózgu szczura: okołonaczyniowa pochewka płynu obrzękowego. Pow. ok. 900 x.
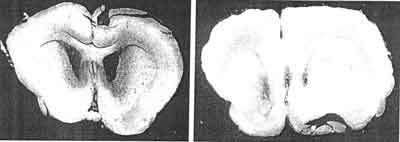
Ryc. 8-9. Przekroje czołowe mózgu szczura: obrzęk asymetryczny większy po stronie prawej, t.j. po stronie usunięcia splotu współczulnego tętnicy szyjnej prawej.
Pobudzenie mózgu przy pomocy strychniny lub leków pobudzających układ współczulny (podawanych podoponowo lub dootrzewnowo) utrudniało powstanie obrzęku, który powstawał później i był mniej wydatny. Narkoza uretanowa sprzyjała tworzeniu się obrzęku. Wyłączenie splotu tętnicy szyjnej wewnętrznej znacznie nasilało obrzęk po jej stronie. Przedstawione ryciny nie były publikowane i ilustrują wnioski: „rozwój i nasilenie obrzęku zależy od stanu pobudliwości tkanki nerwowej, to jest zdolności wysyłana i przekazywania bodźców. Ta zdolność wpływa przypuszczalnie na stan przemiany komórkowej. Pobudzenie współczulne utrudnia, a wyłączenie ułatwia dynamikę rozwoju i wielkości obrzęku.
W rozwoju obrzęku mózgu mają udział bariera krew – mózg i astrocyty które pośredniczą pomiędzy włośniczkami, a neurocytami”. Cytowane wnioski z doniesienia z 1965 roku, są nadal aktualne.
Ract et al. (35) wykazali, że uszkodzenie bariery krew-mózg po ciężkim urazie mózgu zależy od niedoboru katecholamin (dopaminy i norepinefryny) i powoduje wzmożoną przepuszczalnością włośniczek, a neuroprotekcyjne działanie leku adrenergicznego łączy się ze zwiększonym zużyciem tlenu, przepływem krwi i pobudzeniem biochemicznym, warunkującym wzrost gotowości obronnej komórek tkanki nerwowej i zmniejszenie obrzęku.
Również kwas glutaminowy, podstawowy przekaźnik pobudzający, występujący w nadmiarze po uszkodzeniu urazowym mózgu, może działać obrzękotwórczo, ponieważ doprowadza do wzrostu przepuszczalności śródbłonka włośniczek i komórek glejowych oraz neurocytów. Kwas glutaminowy (glutaminian) można wykryć w nadmiarze w płynie mózgowo-rdzeniowym chorych na ciężkie wirusowe zapalenie opon mózgowo-rdzeniowych, mielopatię, stwardnienie rozsiane o ostrym przebiegu, czyli chorób przebiegających z obrzękiem (40).
Maxwell et al. (31) dowiedli, że ochronę neurocytów przed obrzękiem wywołanym nadmiarem pobudzeń glutamatowych, spełniają obrzękłe astrocyty, które ograniczają dyfuzję glutamatów od strony ogniska uszkodzenia (urazowego obrzęku), czyli astrocyty stanowią zaporę, która broni neurocyty. przed obrzękiem.
Nadmiar pobudzeń. pod wpływem glutamatów nie jest korzystny, ponieważ może dojść do efektu ekscytotoksycznego i do śmierci komórki. Nadmiar amin katecholowych prowadzi do krwotoku. Hiperammonemia może prowadzić do obrzęku mózgu po przełamaniu obrzęku astrocytów i aktywności serotoninergicznej (2).
Wiele badań ostatnich lat wskazały na wzrost przepuszczalności bariery krew-mózg, a następnie obrzęku mózgu w niedotlenieniu, śpiączce, zatruciach, po urazie mózgu tj. gdy przeważają pobudzenia hamujące (GABA-ergiczne), a wyłączeniu ulegają troficzne pobudzenia adrenergiczne i glutaminionergiczne1 .
Borges et al. (7) wykazali skuteczny wpływ ośrodkowego układu adrenergicznego na naczyniopochodny obrzęk mózgu W doświadczeniu zastosowano agonistę beta2-adrenoceptora tj klenbuterol, który redukował przechodzenie błękitu Evansa i wody przez ścianę naczynia i „ratował” (tj. hamował) w doświadczeniu rozwój obrzęku mózgu. Te wyniki potwierdzają omówione doświadczenia z 1965 roku, inne wskazują na obniżenie przepuszczalności włośniczek pod wpływem leków adrenergicznych, m.in. pod wpływem beta2-adrenoreceptorów, co wykazali w doświadczeniu in vitro Allen i Coleman (1). Beaumont et al. (5) wykazali, że w narastającym ciśnieniu śródczaszkowym dopamina może normalizować przepływ mózgowy, lecz w nadciśnieniu tętniczym podwyższa przepuszczalność bariery krew-mózg, w przeciwieństwie do epinefryny, która obniża tę przepuszczalność (42).
Badania Ito et al. (24) nad morfologią obrzęku po urazie doświadczalnym wykazały przy pomocy MRI z zastosowaniem „diffusion-weighted magnetic resonance imaging” (DWI), zasadniczeą rolę nadciśnienia tętniczego i niedotlenienia, które powodują przede wszystkim rozwój obrzęku cytotoksycznego z udziałem nadmiaru dopaminy. Dochodzi wtedy do ograniczena mediatorów tkankowych (endothelina, tlenek azotu (NO) (41). Wykazano (19), że wymienione czynniki wraz z kwasem glutaminowym, wpływają na aktywność mózgu związaną z regionalnym przepływem krwi rCBF, który ma zasadnicze znaczenie na stan czynnościowy tkanki mózgu, związany z modulacją neuroprzekaźników.
Kwas glutaminowy – neuroprzekaźnik pobudzający działa jak wiadomo w przeciwieństwie do przekaźnika hamującego, tj. kwasu gaba-aminomasłowego (GABA). Wzrost pozakomórkowego glutamatu jest znamienny u ludzi po ciężkich urazach mózgu (44) a mikroglej ma odgrywać rolę czynnika ograniczającego jego koncentrację (29). Obniżenie stężenia glutamatu oraz blokowanie kanałów sodowych zmniejsza uszkodzenie mózgu wskutek obrzęku i dlatego może być wskazówką jego leczenia. Wskaźnikiem obrzęku indukowanego przez kwas glutaminowy ma być stężenie tauryny (doświadczenie in vitro) i – być może – oznaczanie tauryny w płynie mózgowo-rdzeniowym można będzie wykorzystać dla monitorowania terapii urazowego uszkodzenia mózgu przebiegającego z obrzękiem (40).
BETA2-ADRENOMIMETYKI, W SZCZEGÓLNOŚCI KLENBUTEROL
W licznych pracach doświadczalnych ostatnich lat wykazano, że klenbuterol drogą krwi pobudza receptory adrenergiczne mięśni poprzecznie prążkowanych i tą drogą może zwiększać masę i siłę mięśni i cofać zanik mięśni oraz działać na CUN (vide piśmiennictwo cytowane w pracy Kobel-Buys i Buys) (27). Klenbuterol wykazuje działanie przeciwdrgawkowe (17), kortykosteron hamuje odpowiedzi adrenergiczne klenbuterolu (10).
Propranolol-antagonista receptora beta-adrenergicznego znosi działanie neuroprotekcyjne klenbuterolu, natomiast brak propranololu przywraca aktywność klenbuterolu, co w doświadzeniu świadczy, że działa on poprzez aktywację receptora beta-adrenergicznego (39).
Culmsee et al. (11) i Junker et al. (25) wykazali w doświadczeniach na szczurach, że beta2- adrenomimetyk (klenbuterol) jest zdolny chronić mózg przed uszkodzeniem z niedotlenienia, a w dawkach 0,01-0,5 mg/kg podanych dootrzewnowo, pobudza astrocyty, redukuje objętość zawału korowego, chroni przed rozwojem obrzęku. To neuroprotekcyjne działanie odbywa się via pobudzenia współczulne za pośrednictwem czynnika wzrostu nerwów (nerve growth factor (NGF) i innych czynników neurotroficznych pochodzących z mózgu (brain derived neurotrophic fasctor; BDNF); neurotrofin 3, 4, 5, 6 (NT 3-6). Wszystkie one wspomagają przeżywanie neuronów w ośrodkowym układzie nerwowym.
Te i inne dane doprowadziły do hipotezy terapii chorób nerwowo-zwyrodnieniowych CUN i udarów mózgu czynnikami neuroprotekcji (do których zaliczono klenbuterol) (38).
Poza klenbuterolem istnieją inne związki neuroprotekcyjne: należy do nich cholina aktywna, tzw. CDP-cholina, pochodna połączenia acetylocholiny i lecytyny (nazwa ang. citicoline), która jest naturalnym związkiem endogennym i ma wykazywać działanie neuroprotekcyjne w doświadczalnym niedokrwieniu mózgu (4).
Melatonina – to wysoce skuteczny, fizjologiczny hormon „oczyszczający mózg” od wolnych rodników (przeciwutleniaczy); wiele badań doświadczalnych dowiodło jego działania neuroprotekcyjnego. Doniesienie Sarrafzadeh et al. (36) zasługuje na uwagę ze względu wspomniane zależności między układem współczulnym a szyszynką.
NMDA, którego receptor pochodzi od kwasu N-metylo-D-asparaginowego, bierze udział w licznych aspektach funkcjonowania wyższych czynności mózgu, także w procesach patologicznych (30), oraz wykazuje działanie neuroprotekcyjne w ogniskowej ischemii mózgu i zmniejsza obrzęk mózgu (28).
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Allen M.J., Coleman R.A.: Beta2-adrenoceptors mediate. A reduction in endothelial permeability in vitro. Eur. J. Pharmacol. 1995, 14, 274, 1-3:7-15. 2. Bachmann C.: Mechanisms of hyperammonemia. Clin. Chem. Lab. Med., 2002, 40, 7:633-62. 3.Balmelli C. et al.: Fatal brain edema after ingestion of excstasy and benzylpiperazine. Dtsch. Med. Wochenchr., 2001,126, 28-29:809-811. 4.Baskaya M.K. et al.: Neuroprotective effects of citicoline on brain oedema and blood-brain barrier breakdown after traumatic brain injury. J. Neurosurg., 2000, 92, 3:448-52. 5.Beaumont A. et al.: contrasting effects of dopamine therapy in experimental brain injury J. Neurotrauma, 2001, 18, 12:1359-72. 6.Borges N. et al.: Changes in brain microvessel endothelial cell monolayer permeability induced by adrenergic drugs, Eur. J. Pharmacol., 1994, 269:2. 7. Borges N. et al.: Dynamicts of experimental vasogenic brain oedema in the rat: changes induced by adrenergic drugs. J. Auton. Pharmacol., 1999, 19, 4:209-17. 8. Brabach L., Humble M.: Young women dies of water intoxication after taking one tablet of ecstasy. Today´s drug panorama calls for increased vigilance in health care. Lakartidingen, 2001, 98, 8:817-9. 9. Brzecki A.: Der Einfluss der symphatischen Innervation und der Erregbarkeit des zentralen Nervensystems auf das experimentelle Hirnoedem. Proceedings Tom IV. 8th International Congress of Neurology, Vienna, 5-10.IX.1965, 357-360. 10.Bugajski J. et al.: A single corticosterone pretreatment. inhibits the hypothalamic-pituitary adrenal responses to adrenergic and cholinergic stimulation J. Phys. Pharmac., 2001, 52, 2:313-24. 11.Culmsee C. et al.: Clenbuterol induces growth factor mRNA, activates astrocytes, protects rat brain tissue against ischemic damage. Eur. J. Pharmacol., 1999, 20, 379, 1:33-43. 12.Dolan R. et al.: Human Memory Systems, 381, Human Brain Function, Ed.: Frackowiak R.S. Friston K.J., Frith C.D., Dolan R.J., Mazziotta J.C., Academic Press, San Diego-Toronto, 1997. 13.Dolan R.J. et al.: Measuring Neuromodulation with Functional Imaging. Human Bran Function, 404-428, Edit. Frąckowiak, Friston K.J., Frith C.D., Dolan R.J., Mazziota J.C., Acaemic Press, San Diego-Toronto, 1997. 14.Eidelberg D.: Functional brain networks in movement disorders. Current Opinion in Neurology, 1998, 11:319-326. 15.Espejo E.F., Minano J.: Adrenergic hyperactivity and metanephrine excess in the nucleus accumbens after prefrontocortical dopamine depletion. J. Neurophysiol., 2001, 85:30-4. 16.Espejo E.F. et al.: Behavioral expression of opiate withdrawal is altered after prefrontocortical dopamine depletion in rats: monoaminergic correlates. Neuropsychopharmacology, 2001, 25, 2:204-12. 17.Fisher W. et al.: Anticonvulsant and sodium channel blocking activity of higher doses of clenuterol. Arch. Pharmacol. (Namynyn Schmiedebergs), 2001, 363, 2:182-192. 18. Floßdorf W. et al.: Klenbuterol w zanikach mięśniowych i niedowładach różnego pochodzenia. MMW (edycja polska), 1998, 12:29-32. 19.Forman S.D. et al.: Simultaneous glutamate and perfusion fMRI responses to regional brain stimulation. J. Cereb. Blood Flow Metab., 1998, 18, 10:1064-70. 20.Frąckowiak R.S.: The Cereral Basis of Functional Recovery. 243 264, Human Brain Function., Edit. Frąckowiak R.S., Frith Ch.D., Dolan R.J., Mazziota J.C., Academic Press, San Diego-Toronto, 1997. 21.Frerichs O. et al.: The influence on nerve regeneration by the beta2-receptor agonist Clenbuterol. Handschr. Mikrochir. Plast. Chir., 2002, 34, 2:84-8. 22.Frerichs O. et al.: Regeneration of peripheral nerves after clenbuterol treatment in a rat model. Muscle Nerve, 2001, 24, 12:1087-91. 23.Hanaway J. et al.: The brain atlas. Fitzgerald Science Press, Bethesda, Meryland, 1998. 24.Ito J. et al.: Characterization of edema by diffusion-weighted imaging in experimental traumatic brain injury. J. Neurosurg., 1996, 84, 1:97-103. 25.Junker V. et al.: beta-adrenoceptors activates astrocytes and provides neuroprotection. Eur. J. Pharmacol., 2002, 20, 446, 1-3:25-36. 26.Kenn W.R.: The brain alpha7 nicotinic receptor may be am important therapeutic target for the treatment of Alzheimer´s disease. Behavior. Brain Res., 2000, 113, 1-2:169-81. 27.Kobel-Buys K., Buys G.: Wpływ podawania clenbuterolu na ośrodkowe zaburzenia ruchowe u dzieci chorych na mózgowe porażenie dziecięce. Pediatria, Cur. Med. Lit., 2000, 2:82-90. 28.Kroppenstedt S.N. et al.: Neuroprotective properties of aptiganel HCL (Cerestat) following controlled cortical impact injury. Acta Neurochir., Suppl. (Wien), 1998, 71:114-6. 29.van Landeghem F.K. et al.: Early expression of glutamate transporter proteins in ramified microglia after controlled cortical impact injury in the rat. Glia, 2001, 35, 3:167-79. 30. Longstaff A.: Neurobiologia, przekład pod red. A. Wróbla, PWN Warszawa, 2002.31. Maxwell W.L. et al.: Massive astrocytic swelling in response to extracellular glutamate - a possible mechanism for post-traumatic brain swelling? Acta Neurochir., Suppl. (Wien) 1994, 60:465-7. 32.Menkes J.H.: Textbook of child neurology. Williams & Wilkins, Baltimore-Tokyo, 1995. 33.Müller L.R.: Lebensnerven und Lebenstriebe. Julius Springer, Berlin, 1931. 34. Passingham R.: Functional organisation of the motor system human brain function. 243-269, Edit. Frąckowiak R.S., Friston K.J., Frith C.D., Dolan R.J., Mazziota J.C.: Academic Press, San Diego-Toronto, 1997. 35.Ract C. et al.: Comparison of dopamine and norepinephrine after traumatic brain injury and hypoxic-hypotensive insult. J. Neurotrauma, 2001, 18, 11:1247-54. 36.Sarrafzadeh A.S. et al.: Neuroprotective effect of melatonin on cortical impact injury in the rat. Acta Neurochir., (Wien), 2000; 1, 42, 11:1293-9. 37.Schreiber G. et al.: Clenbuterolbehandlung bei kongenitalen Myopathien: eine offene, nicht kontrollierte. Pilotstudie, cyt. poz. 18. 38.Semkova I., Krieglstein J.: Neuroprotection mediated via neurotrophic factors and induction of neurotrophic factors. Brain Res. Rev., 1999, 30, 2:176-188. 39. Semkova I. et al.: Clenbuterol protects mouse cerebral cortex and rat hippocampus from ischemic damage and attenuates glutamate neurotoxicity in cultured hippocampal neurons by induction of NGF. Brain Res., 1996, 22, 717, 1-2:44-54.40. Stover J.F. et al.: Neurotransmitters in cerebral fluid reflect pathological activity. Eur. J. Clin. Invest., 1998, 28, 9:760-1. 41. Thomale U.W. et al.: Cortical hypoperfusion precedes hyperperfusion following controlled cortical impact injury. Acta Neurochir., Suppl., 2002, 81:229-31.42. Tuor U.I. et al.: The effects of hypertension induced by catecholamines and the relationship between cerebral blood flow and glucose use. Am. J. Physiol., 1986, 251, 4:2. 43.Uc E.Y. et al.: Beta-adrenergics enchance brain extraction of levodopa. Mov. Disord., 2002, 17, 1:54-9.44. Vespa P. et al.: Increase in extracellular glutamate caused by reduced cerebral perfusion pressure and seizures after human traumatic brain injury: a microdialysis study. J. Neurosurg., 1998, 89, 69:71-82.








