© Borgis - Postępy Fitoterapii 3/2006, s. 118-130
*Tadeusz Wolski, Wanda Zwolan, Anna Lewandowska
Rzepień pospolity ( Xanthium strumarium L.) – surowiec zielarski o wielokierunkowym działaniu farmakologicznym. Analiza fitochemiczna związków fenolowych
Rough Cocklebur (Xanthium strumarium L.) medicinal plant with multidirectional pharmacological effects – phYtochemical analysis of phenolic compounds
Katedra i Zakład Farmakognozji z Pracownią Roślin Leczniczych, AM Lublin
Kierownik Katedry i Zakładu: prof. dr hab. Kazimierz Głowniak
Summary
The present work consists of two parts. In the first part the literature review relating to rough cocklebur (Xanthium strumarium L.) was presented. There were depicted data concerning the origin of the genus Latin name, dissemination of the plant and characterization of its anatomy and morphology. The survey of chemical composition provide information on tannins, phenolic acids, flavonoids, ethereal oil, sterols, triterpenes, alkaloids, sesquiterpene lactones, carboxyatractyloside and mineral compounds, such as iodine. Furthermore multidirectional pharmacological effects of rough cocklebur were described. Xanthium strumarium L. is used as a medicine in folk and traditional medicine of many cultures all over the world. From among pharmacological actions which Xanthium tells the most valuable consider: antibacterial, also against Helicobacter pylori, fungistatic, cytostatic, neuroprotective, hypoglycemic and diuretic.
In experimental part of the paper analysis of polyphenolic compounds presented in vegetative and generative parts of Xanthium strumarium L. was introduced. The results of TLC analysis showed presence, in the fraction of glycosylated forms: izoquercitrin, hyperoside, luteolin 7-glucoside and rutoside; in the fraction of aglicons: luteolin and quercitin. Determination of composition of tannins fraction contain analysis of free phenolic acids and their quantity after acidic hydrolysis. As a consequence of these analysis were identified: before hydrolysis – cafeic acid, ferulic acid and gallic acid, after hydrolysis – chlorogenic acid, cafeic acid and gallic acid.

Wielka Encyklopedia Ziół z 1999 r. (1) podaje, że do rodzaju Xanthium należą tylko dwa gatunki. Wcześniej liczni autorzy wyróżniali ponad 20 gatunków o nazwach związanych głównie z miejscem ich występowania. Intensywne rozmnażanie się w obrębie gatunku i okazjonalne krzyżowanie jest źródłem niespotykanej zmienności, która często prowadzi do powstawania lokalnych, małych i niestabilnych taksonów (2, 3, 4).
Jednoroczne rośliny z rodzaju Xanthium są pospolitymi chwastami, zaliczanymi do rodziny Asteraceae ( Compositeae) i podrodziny Tubiflorae, rozpowszechnionymi niemal na wszystkich kontynentach. Nazwa rodzaju rośliny Xanthium pochodzi od greckiego słowa xanthos – żółty, jako antyczna nazwa ziela, którego owoc i korzeń używane były do farbowania włosów na żółto. Nazwa gatunkowa strumarium wywodzi się od łacińskiego słowa struma – wole, skrofuły, ponieważ roślinę tę stosowano w leczeniu takich schorzeń (1, 4-6). Konsensus w klasyfikacji taksonomicznej uzyskano po sugestii Love i Dansereau (cyt. za 2), którzy opierając się na wynikach wieloletnich badań stwierdzili, że liczne, wcześniej poznane gatunki, są w istocie tylko podgatunkami, bądź odmianami dwóch podstawowych gatunków: rzepienia pospolitego Xanthium strumarium L. i rzepienia kolczastego (ciernistego) Xanthium spinosum L. (2-4).
Kontrowersje dotyczą również pochodzenia rośliny. Chociaż po raz pierwszy opisano ją w Europie, to prawdopodobnie rzepień pospolity pochodzi z Kalifornii. Obecnie rodzaj Xanthium występuje niemalże na całym świecie, zwykle w strefie umiarkowanej od 53°N do 33°S szerokości geograficznej (2, 7-11). Liczne skupiska rzepienia rosną na terenach od Europy do wschodniej Azji, w Indiach, Australii, południowej Afryce i obu Amerykach. W niektórych miejscach występowania roślina ta jest bardzo pospolitym i ekspansywnym chwastem, dlatego też podlega administracyjnemu zwalczaniu, np. w Australii (1, 9, 12-14), co jest jednak trudnym zadaniem, ponieważ nabyła ona oporności na niektóre herbicydy (15).
Xanthium występuje także na Lubelszczyźnie, zwłaszcza w północno-zachodniej i południowo-zachodniej jej części (16, 17). Xanthium strumarium występuje w Polsce w różnorodnych siedliskach, na obszarach otwartych, polach uprawnych, nieużytkach, obszarach częściowo zalewanych przez powodzie. Równie często rośnie na poboczach dróg, w rowach, na rumowiskach, torfowiskach, brzegach rzek, jezior i stawów (4, 5, 18-21). Roślina ta nie lubi miejsc zacienionych, rośnie na różnorodnych glebach o dobrej wilgotności, od piaszczystych do gliniastych, o odczynie słabo kwaśnym i obojętnym. Na żyznych glebach o dużej wilgotności silnie wyrasta, tworząc zwykle wielkie skupiska. Na glebach suchych, słabych, może urosnąć zaledwie na wysokość kilku centymetrów. Roślina ta potrafi przetrwać suszę i wydać nasiona. Wytrzymuje także częściowe zanurzenie w wodzie, nawet do 6-8 tygodni, tworzy wtedy specjalne korzenie w zanurzonej części łodygi. Nasiona tej rośliny są zdolne do rozmnażania nawet przez kilka lat i mogą być przenoszone przez wodę, wiatr, ludzi i zwierzęta. Nasiona chronione są twardą zdrewniałą szyszką, dlatego mogą przetrwać pożary i wtedy są rośliną pionierską na pogorzeliskach (4, 7, 10).
Rzepień swoim wyglądem przypomina łopian i bieluń dziędzierzawę, ma podobne owoce, także czepiające się sierści zwierząt i ubrań. Podobieństwo to bywa wykorzystywane do fałszowania surowca zielarskiego, jakim jest bieluń dziędzierzawa – Datura stramonium (1, 4). Aktualnie Xanthium strumarium należy do surowców zapomnianych w Polsce, chociaż w świecie prowadzi się liczne badania nad tą rośliną (22-29).
Budowa morfologiczna i anatomiczna
Xanthium strumarium jest jednoroczną, jednopienną rośliną zielną o wysokości 15-120 cm, szarozieloną. Łodygę ma wzniesioną, zwykle rozgałęzioną, nieco kanciastą, krótko i szorstko owłosioną, w górnej części gruczołowatą, bez kolców. Liście, o dość długich ogonkach, są ułożone na łodydze skrętolegle, w zarysie prawie trójkątne, duże, szersze niż dłuższe. Brzegi blaszki liściowej są 3-klapowe lub bez wyraźnych klap, grubo i nieregularnie ząbkowane, piłkowane lub karbowano-piłkowane. Są one dość sztywne, po obu stronach szarozielone, krótko owłosione, szorstkie. Nasada blaszki liściowej jest w zarysie ucięta lub sercowata. Spodnia strona liścia jest jaśniejsza z widocznymi włoskami wydzielniczymi. Wielkość liści jest różna, w zależności od okresu wzrostu, ale przeciętnie osiągają one długość i szerokość do 16 cm (2, 4, 5, 7, 8, 10, 18-21, 30).
Xanthium wytwarza koszyczki o kwiatach jednopłciowych. Kształt okrywy koszyczka jest jajowaty. Listki okrywy mają 10-15 mm długości oraz żółte kolce. Pomiędzy kolcami występują bardzo cienkie, krótkie i prawie przylegające włoski. Na szczycie łodygi umieszczone są koszyczki pręcikowe, niżej słupkowe. Kwiatostany pręcikowe są wielokwiatowe i zebrane w niewielkie, gęste główki. Listki okrywy są wolne, rozmieszczone w niewielu szeregach. Składają się one z pięciu pręcików, których nitki u nasady są zrośnięte, zaś pylniki wolne. Znamię szczątkowego słupka jest niepodzielone. Kwiaty wytwarzają bladożółty pyłek. Kwiaty słupkowe są odmienne od pręcikowych. Listki okrywy są ściśle zrośnięte ze sobą i dnem koszyczka, tworząc skorupę, z czasem twardniejącą, zawierającą w oddzielnych komorach dwa kwiaty. Kwiaty słupkowe są zredukowane do samej zalążni i dwu długich znamion, które wystają ze skorupowatej osłony przez niewielkie pory. Kwiaty słupkowe pozbawione są korony. Okrywa koszyczka jest jajowata, zrosłoliściowa, kolczasto-hakowata, z kolcami prostymi i nagimi, pomiędzy nimi miękko owłosiona.
Rzepień pospolity charakteryzuje się długim okresem wegetacji, kiełkuje w kwietniu lub maju, wzrasta i kwitnie w zależności od długości dnia (maksymalnie do 14 godzin) od czerwca do października lub listopada (2, 4, 5, 7, 8, 10, 18-21, 30).
Owocami rzepienia są szarozielone owocujące koszyczki. Skorupowata osłona żeńskiego kwiatu przekształca się w twardą okrywę nasienną, zawierającą dwie spłaszczone, owalne niełupki. Owoce okryte są krótkimi i niezbyt gęsto ustawionymi cierniami, krótko i miękko owłosione, a także, zazwyczaj obficie ogruczolone. Ciernie dojrzałych koszyczków są znacznie krótsze niż połowa średnicy koszyczka, prostopadłe, proste lub lekko łukowate, o szczycie hakowatym, w dolnej części owłosione, tak jak okrywa między nimi. Dzioby szczytowe owoców są krótkie, zakończone cienkim, prostym lub zagiętym haczykiem, czasem lekko rozchylone, czasem stykające się ze sobą i krzyżujące zagiętymi kończykami, często prawie równoległe. Koszyczki są 1,5-2,5 razy dłuższe niż szersze, o długości zmiennej, zwykle ok. 1,5 cm. Twarda okrywa nasienna nie pęka uwalniając nasiona, natomiast za pomocą haczykowatych cierni przymocowuje się do sierści zwierząt, które przenoszą owoce na znaczne odległości. Mogą być także przenoszone przez prąd wody, ponieważ unoszą się na powierzchni. Woda sprawia, że ściany łupiny nasiennej stają się miękkie i pękają uwalniając nasiona (2, 4, 5, 7, 8, 10, 18-21, 30, 31).
Cała podziemna część rośliny składa się ze strefy przejściowej oraz korzenia właściwego. Strefa przejściowa stanowi ok. 1/3 całej długości. Korzeń główny jest walcowaty, zwężający się ku końcowi, ma 10-25 cm długości i do 2,5 cm średnicy, z licznymi korzeniami bocznymi. Korzenie rosnące na piaszczystych brzegach rzek są zazwyczaj cieńsze i bardziej wydłużone. Powierzchnia zewnętrzna jest żółtawobrązowa z podłużnymi szczelinami. Przełom jest łamliwy. Na świeżo przeciętej powierzchni widać jasnożółty zdrewniały rdzeń (3/4 całkowitej średnicy korzenia). Smak surowca jest gorzki, zapach aromatyczny (32).
Surowcami wykorzystywanymi w medycynie ludowej są organy nadziemne, tj. ziele ( Xanthii strumarii herba) i owoce ( Xanthii strumarii fructus) zbierane po dojrzeniu, a następnie suszone. W medycynie chińskiej i indyjskiej stosowany jest również korzeń, jako lek w terapii nowotworów (1, 4, 5, 6, 10, 20, 32-34).
Skład chemiczny
Jak podaje piśmiennictwo (4, 5, 9, 12, 18-21, 35, 36), w Xanthium strumarium L. stwierdzono obecność garbników, fenolokwasów, flawonoidów, olejku eterycznego, steroli, triterpenów, alkaloidów, laktonów seskwiterpenowych, karboksyatraktylozydu oraz związków jodu.
Xanthium strumarium L. jest surowcem bogatym w związki polifenolowe. Według danych piśmiennictwa z rzepienia wyizolowano różne pochodne polifenolowe, m.in.: w 1998 r. Ma i wsp. (37) wyizolowali kawolidy oraz nowy związek, niezaliczany do związków polifenolowych, o nazwie tiazinedion. Strukturę kawolidów i tiazinedionu przedstawiono na rycinie 1. W 2003 r. Sheu i wsp. (38), stosując wysokosprawną chromatografię cieczową (HPLC) i elektroforezę kapilarną, stwierdzili m.in. obecność pochodnych kwasu kawowego oraz kwasu chlorogenowego. Brak jest natomiast w dostępnym piśmiennictwie informacji na temat zawartości i składu garbników oraz flawonoidów.
| NAZWA | WZÓR |
| Ksantiozon, tiazinedion | 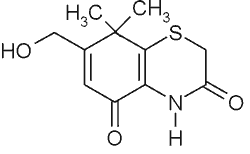 |
| 3-O-Kawoilochinian potasu | 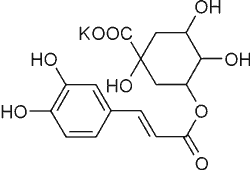 |
| Kwas 1,5-di-O-kawoilochinowy | 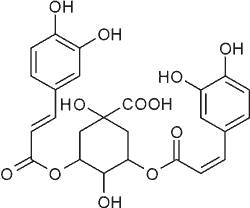 |
| Kwas 1,3,5-tri-O-kawoilochinowy | 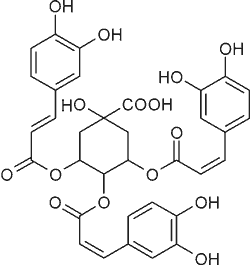 |
Ryc. 1. Struktury garbników będących kawolidami i tiazinedionu występujących w Xanthium strumarium L. (37).
Jeżeli chodzi o sterole i triterpeny, to badania tej grupy związków, są fragmentaryczne i dotyczą one obecności w korzeniu octanu β-sitosterolu i fukosterolu, zaś we fakcji triterpenowej wykryto alkohole triterpenowe, których struktury nie ustalono (35). Prowadzone od kilku lat w naszej Katedrze prace (39, 40) potwierdziły obecność, zarówno saponin, jak i triterpenów w badanych surowcach.
Ze względu na przynależność surowca do rodziny Asteraceae istnieją domniemania, że w surowcu mogą występować alkaloidy pirolizydynowe. Jak wykazały badania Dharmananda (41) zawartość ich była poniżej 1 ppm. Tak więc wydaje się, że niektórzy autorzy (5, 17, 18, 20) podają prawdopodobnie niesprawdzone informacje na temat tej grupy związków. Jak wynika z badań skriningowych, wykonanych przez nas w Xanthium strumarium L., nie stwierdzono obecności alkaloidów (42).
Badania indyjskie wykazały, że w liściach Xanthium strumarium L. występuje olejek eteryczny, który otrzymywano przez destylację próżniową i poddawano analizie chromatograficznej. Jak wykazały te badania (43, 44) zawierał on m.in.: d-limonen (35%), p-cymen (5%), β-kariofylen (6%), terpineol (7,3%), 1-α-jonon (10,9%), d-karweol (25%) oraz α-pinen (0,1%). Wykonane przez nas badania metodą SPME/GC MS wykazały również zawartość olejku, zarówno w częściach podziemnych, jak i nadziemnych. Będzie to przedmiotem oddzielnej publikacji.
Szczególne zainteresowanie budzi frakcja laktonów seskwiterpenowych występujących w badanych surowcach. W toku badań fitochemicznych stwierdzono w Xanthium strumarium L. obecność związków zaliczanych do α- i β-nienasyconych γ-laktonów o szkielecie ksantanolidu (35, 45-47). Jak podaje piśmiennictwo (38, 48-51) z części nadziemnych wyizolowano wiele ksantanolidów i seskwiterpenów typu ksantanu oraz ich pochodne epoksydowe, takie jak 11α, 13-dihydroksyksantatyna, 1α, 4α-endoperoksyd, 4β,5β-epoksyd ksantatyny, kwas 1β,4β,4α,5α-diepoksyksant-11(13)-en-12-owy, 1α,5α-epoksyksantatyna, 1β, 5α-epoksyksantatyna, ksantynozyna, epiksantanol, 2-hydroksytomentozyna, 2-hydroksytomentozyna, 1β,5-epoksyd, ksantumanol. Wzory niektórych laktonów seskwiterpenowych występujących w Xanthium podano na rycinie 2 (49).
| NAZWA | WZÓR |
| Ksantatyna (seko-4,5-gwajanolid) | 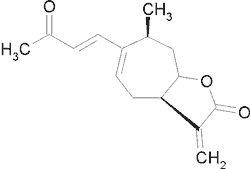 |
| 8-Epi-ksantatyna | 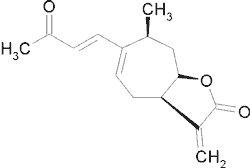 |
| Epoksyd 8-ksantatyny | 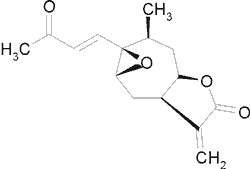 |
| Ksantynina | 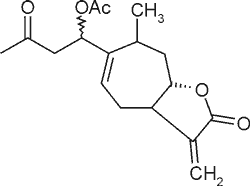 |
| Ksantymina | 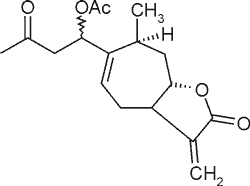 |
| Ksantanol | 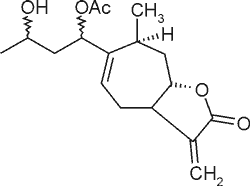 |
| Izoksantanol | 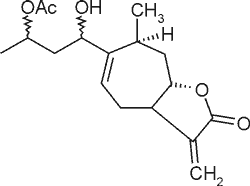 |
Ryc. 2. Budowa laktonów seskwiterpenowych występującyh w Xanthium strumarium L. (35, 45).
Według danych piśmiennictwa (5, 18- 20) Xanthium zawiera związki jodu i jest stosowane w leczeniu chorób tarczycy. Brak jest szczegółowych badań na temat zawartości tego pierwiastka. Wykonane przez nas badania potwierdziły jego obecność. Zawartość procentowa jodu kształtowała się na poziomie: ziele – 0,1%, owoce – 0,16% i korzeń – 0,12% (39).
Jak podaje piśmiennictwo (6, 52-55) w niektórych roślinach, zwłaszcza pochodzących ze Stanów Zjednoczonych, występuje glikozyd kaurenowy, zwany karboksyatraktylozydem (CAT), a jego strukturę podaje rycina 3. Jak wynika z przedstawionej struktury, związek ten ma charakter bardzo polarny i może być dobrze rozpuszczalny w układach wodnych. Z danych piśmiennictwa (10, 52) wynika, że związek ten występuje w owocach, a szczególnie znaczącą jego ilość znaleziono w młodych siewkach i kolcach owoców (6).
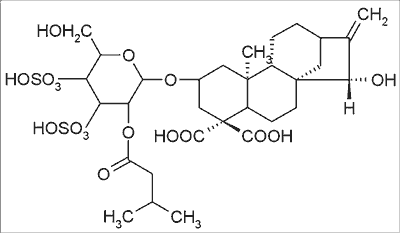
Ryc. 3. Karboksyatraktylozyd (6, 54).
Właściwości farmakologiczne i zastosowanie
Jak wynika z literatury Xanthium strumarium L. był od dawna stosowany w medycynie chińskiej, gdyż stosowano go już w dynastii Tang (lata 618-907) i do dziś jest powszechnie wykorzystywanym składnikiem chińskich leków gotowych (1, 4, 6, 33, 34).
Działanie lecznicze surowca uwarunkowane jest składem fitochemicznym występujących w nim związków farmakologicznie czynnych. Do głównych grup związków farmakologicznie czynnych występujących w częściach nadziemnych, jak i podziemnych rzepienia pospolitego, należy zaliczyć grupę związków polifenolowych, tj. fenolokwasów, garbników oraz flawonoidów. Dlatego też w medycynie ludowej surowiec ten stosowany jest, zarówno zewnętrznie i wewnętrznie. Zewnętrznie w stanach zapalnych skóry, wewnętrznie w postaci naparów w biegunkach (1, 4, 11, 20, 56).
W lecznictwie światowym surowcem jest zarówno ziele, jak i korzeń, który stosowany był w alergicznych nieżytach nosa, zapaleniu zatok, katarze, reumatyzmie, artretyzmie, lumbago, trądzie i świądzie. Najnowsze doniesienia naukowe wskazują na działanie bakteriostatyczne, fungistatyczne i przeciwnowotworowe, poprzez bezpośredni wpływ na układ odpornościowy (24, 25, 57-62). Stwierdzono również, że surowce z rzepienia i otrzymane z nich przetwory wykazują działanie antyoksydacyjne i przeciwzapalne. Mechanizm tego działania wykazano w badaniach eksperymentalnych, z których wynika, że Xanthium jest inhibitorem syntezy produktów przemiany kwasu arachidonowego oraz produkcji tlenku azotu. Poprzez hamowanie czynnika jądrowego κB hamuje syntetazę tlenku azotu (NOS) i syntetazę prostaglandyn (PGE-2) oraz czynnika martwicy nowotworów (TNF-α) (23, 63-67).
Badania in vitro wykazały, że ekstrakt otrzymany z kwitnących pędów jest silnym inhibitorem rozwoju przecinkowca cholery ( Vibrio cholerae), w znacznie wyższym stopniu niż antybiotyki stosowane w próbie kontrolnej (25). Japońscy uczeni zidentyfikowali w zielu rzepienia lakton seskwiterpenowy ksantatynę i wykazali jego wyjątkowo silną aktywność przeciwko szczepom Staphylococcus aureus opornym na metycylinę (61). Podobne działanie zaobserwowano także wobec Staphylococcus epidermidis, Streptococcus faecalis, Klebsiella pneumoniae, Bacillus cereus, Bacillus subtilis, Pseudomonas aeruginosa, Salmonella typhi oraz Mycobacterium tuberculosis (25, 61, 68, 69). Tripathi (62) wykazał w swych badaniach, że ziarna pyłku omawianej rośliny działają przeciwgrzybiczo wobec Colletotrichum capsici, Curvularia lunata i Helminthosporium oryzae.Późniejsze doniesienia wskazują także, że etanolowy ekstrakt z Xanthium hamuje rozwój Candida albicans, Candida glabrata i Aspergillus fumigatus (58, 70).
Metanolowy ekstrakt Xanthium strumarium działa bakteriobójczo na drobnoustrój zakażający błonę śluzową żołądka – Helicobacter pylori, który przyczynia się do rozwoju wrzodu trawiennego oraz nowotworów żołądka (11, 27, 34, 71). Ekstrakt metanolowy wykazuje bardziej efektywne działanie bakteriobójcze niż antybiotyki zwykle stosowane w eradykacji H. pylori. Działanie przeciwwrzodowe jest uwarunkowane prawdopodobnie występowaniem dwu związków o charakterze flawonoidowym i ksantanolidowym (72). Efekty farmakologiczne, dotyczące bakteriostatycznego i bójczego działania na H. pylori przetworów otrzymanych z Xanthium strumarium L., są niezmiernie ważne i będą przedmiotem dalszych badań in vitro i in vivo.
Kolejnym istotnym elementem działania przetworów rzepienia pospolitego są ich właściwości przeciwwirusowe, a szczególnie ich zdolność do hamowania rozwoju wirusa HIV. Ekstrakt wodny z ziela Xanthium wykazuje zdolność do ochrony limfoblastów T typu MT-2 przed cytopatogennym działaniem wirusa. Mechanizm takiego działania opiera się na utrudnianiu wnikania wirusa do komórki. Testy in vitro, określające długość okresu przeżycia zakażonych komórek, dowiodły znacznej skuteczności ekstraktu wodnego z ziela Xanthium, a jego indeks terapeutyczny wynosił 50 (73).
Ważnym efektem badań farmakologicznych jest wykazanie działania przeciwpasożytniczego. Badania eksperymentalne z 50% etanolowym ekstraktem z liści Xanthium wykazały, że wydłużał on okres przeżycia myszy zakażonych Trypanosoma evansi. Ten sam ekstrakt, jednak w wyższych dawkach (1000 mg/kg), działał toksycznie (28, 29). Ekstrakt z korzeni i łodyg Xanthium jest inhibitorem rozwoju Leishmania infantum, L. mexicana, L. braziliensis, L. donovani oraz L. amazonensis. Działanie to jest prawdopodobnie spowodowane obecnością laktonów seskwiterpenowych (58, 74). Ponadto seskwiterpeny obecne w surowcu – ksantumina i 8-epi-ksantatyna, są inhibitorami wzrostu owadów, co potwierdzono w badaniach wobec Drosophila melanogaster prowadzonych przez Japończyków (75).
Inne badania eksperymentalne z 65% wodno-alkoholowym wyciągiem z Xanthium strumarium prowadzili Kubańczycy (77), którzy wykazali jego działanie diuretyczne, a wyniki porównano z efektami podania preparatu Furosemid. Ekstrakt wodno-etanolowy wykazał silniejsze działanie diuretyczne od furosemidu, natomiast w podobny sposób zwiększał wydalanie sodu i potasu.
Badania diabetologiczne, które prowadzono w Indiach wykazały, że kwas kawowy znajdujący się w owocach Xanthium strumarium L. skutecznie obniża poziom cukru we krwi u szczurów chorych na cukrzycę. Jednak nie zaobserwowano podobnego efektu u zdrowych szczurów, zatem można wnioskować o działaniu kwasu kawowego niezależnym od insuliny. Mechanizm tego działania jest prawdopobodnie zbliżony do biguanidu (22, 77-79).
Związki fenolowe zawarte w surowcu, takie jak katechina, epikatechina i kwas kawowy, działają neuroprotekcyjnie na komórki ziarniste mózgu. Ochraniają je przed apoptozą indukowaną przez wysoki poziom glutaminy. Także inne składniki wyciągów z rzepienia działają neuroprotekcyjnie poprzez inhibicję receptora N-metylo-D-asparaginianowego (NMDA), który pośredniczy w uszkadzaniu i śmierci neuronów (80).
Surowy wyciąg z rzepienia hamuje działanie czynnika jądrowego κB (NF-κB), który stymuluje powstawanie cytokin, czynników wzrostu, hormonów, mitogenów, karcynogenów oraz reguluje ekspresję wielu genów. Jego supresja hamuje powstawanie guza nowotworowego. Preparaty z Xanthium strumarium L. hamują prawdopodobnie jeden z etapów w ścieżce sygnałowej NF-κB. Za to działanie prawdopodobnie odpowiedzialne są związki fenolowe obecne w Xanthium (57, 81, 82). Roussakis (60) badał surowy wyciąg z ziela, który hamował polimeryzację tubuliny, czego następstwem jest zaburzenie proliferacji i śmierć komórki nowotworowej. Ksantanolidy, wyizolowane z liści Xanthium, wykazują w badaniach in vitro znaczące działanie hamujące proliferację nowotworowych linii komórkowych, m.in. linii A549 NSCLC (rak płuc), linii SK-OV-3 (rak jajnika), linii SK-MEL-2 (czerniak skóry), linii XF498 (nowotwór centralnego układu nerwowego) oraz linii HCT-15 (rak okrężnicy) (24, 26, 83, 84). Dodatkowo, ksantanolidy wykazują zdolności do hamowania farnezylotransferazy (FT-azy), blokując swoiście proliferację zależną od białek Ras i zmieniając lokalizację enzymu w błonie komórkowej. Inhibitory FT-azy stanowią jedną ze strategii w walce z onkogennymi białkami Ras (24, 84).
Jak podano, w składzie chemicznym młodych siewek i owoców rzepienia pospolitego występuje związek o nazwie karboksyatraktylozyd (CAT) (6, 52, 81), który jak podaje piśmiennictwo może hamować kiełkowanie nasion (6, 53-55, 85), a także może być toksyczny dla zwierząt przeżuwających, zjadających całe rośliny, a także dla ludzi, którzy zażywają w podwyższonych dawkach owoce, jako leki naturalne (6, 85-89). Największą ilość CAT stwierdzono w kolcach owoców rzepienia, które poddaje się prażeniu lub ekstrahuje wodą w celu usunięcia tego toksycznego czynnika (6).
Xanthium strumarium L. jest częstym składnikiem leków gotowych, stosowanych w chińskiej medycynie (90-94), przykładem takiej receptury jest lek stosowany w schorzeniach górnych dróg oddechowych, w którym Xanthium występuje razem z arcydzięglem i magnolią. Lek ten nosi nazwę Xanthium Formula (Canger San lub Cangerzi San) i zawiera w swoim składzie: Magnoliae flos 30 g, Archangelicae herba 30 g, Xanthii fructus 15 g oraz Menthae Piperitae herba 3 g (33).
Płynny ekstrakt z ziela Xanthium strumarium L. w dawce 5-60 kropli stosowany był w leczeniu wielu schorzeń (34). W Stanach Zjednoczonych opatentowano w ostatnich latach kilka leków zawierających wyizolowane związki chemiczne lub frakcje substancji biologicznie czynnych występujących w Xanthium strumarium L. (79, 95, 96). Mengjun w 2002 r. opatentował recepturę gotowego leku Huodan Biyan w skład którego wchodzi ekstrakt z owoców rzepienia. Lek ten jest stosowany w tradycyjnej medycynie chińskiej w leczeniu stanu zapalnego zatok (95). W 1991 r. Zhang i Zhang (96) opatentowali metodę otrzymywania z Xanthium olejku lotnego używanego w immunoterapii swoistej, w leczeniu reakcji alergicznych. W 1975 r. Turner i Craig opatentowali metodę izolacji z ziela Xanthium strumarium L. związku chemicznego, którym okazał się być kwas kawowy, wykazujący działanie hipoglikemiczne (79).
Jak wynika z przedstawionego przeglądu piśmiennictwa rzepień pospolity, jak i przetwory z niego otrzymane, wykazują wielokierunkowe działanie farmakologiczne. Jako szczególnie cenne należy uznać działanie: przeciwdrobnoustrojowe (25, 26, 61, 68), przeciwgrzybicze (58, 62, 70), bakteriostatyczne i bakteriobójcze działanie przeciwko Helicobacter pylori (27, 71), przeciwpasożytnicze (28, 29, 74), a także działanie neuroprotekcyjne (80).
Zarówno interesujący skład chemiczny, jak i efekty działania farmakologicznego, skłoniły nas do prowadzenia systematycznych badań nad składem jakościowym i ilościowym poszczególnych grup związków farmakologicznie czynnych. Celem prezentowanych badań jest analiza zawartości i składu związków polifenolowych występujących w organach nadziemnych i podziemnych Xanthium strumarium L.
Materiały i metody
Materiał do badań stanowiły części nadziemne i podziemne (ziele, owoce i korzenie) rzepienia pospolitego ( Xanthium strumarium L.) pochodzące z uprawy w Ogrodzie Roślin Leczniczych Akademii Medycznej w Lublinie. Rośliny zebrano jesienią 2005 r., następnie suszono w ciemnym i przewiewnym miejscu, rozdrobniono i przygotowano do badań.
Badania obejmowały analizę wstępną surowca, czyli oznaczanie suchej masy i składników mineralnych (popiołu), a także izolację i oznaczenia ilościowe związków polifenolowych. Badania ilościowe przeprowadzono metodami farmakopealnymi. Oznaczenie zawartości garbników wykonano metodą miareczkowo-wagową, zgodnie z FP IV (97). Natomiast zawartość procentową flawonoidów i fenolokwasów wykonano zgodnie z FP VI (98), przy czym fenolokwasy dodatkowo oznaczono z odczynnikiem Folina-Ciocalteau (99).
Badania chromatograficzne TLC i HPLC dotyczące fenolokwasów występujących w częściach wegetatywnych i generatywnych Xanthium strumarium L. przedstawiono w poprzedniej publikacji (36). Ponadto wykonano badania chromatograficzne metodą TLC w celu identyfikacji flawonoidów oraz fenolokwasów występujących we frakcji garbnikowej badanych surowców.
Ekstrakty flawonoidów i garbników do badań TLC otrzymywano znanymi metodami (100). Przed ich analizą TLC otrzymane ekstrakty oczyszczono metodą ekstrakcji do fazy stałej (SPE). Analiza TLC frakcji flawonoidów i fenolokwasów z frakcji garbnikowej obejmowała dobór optymalnych warunków rozdziału tych związków (101). Wizualizację chromatogramów TLC prowadzono z użyciem VideoScanu firmy Camag (Szwajcaria). Próbki wzorców i ekstraktów nanoszono na płytki Si 60G w sposób ręczny mikropipetą i rozwijano w układzie: chloroform + kwas octowy + metanol + woda (60+32+12+8) (v/v) dla flawonoidów oraz w układzie: octan etylu + kwas mrówkowy + kwas octowy + woda (100+11+11+27) (v/v) dla garbników.
Wyniki i omówienie
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Bown D.: Wielka encyklopedia ziół. Muza, Warszawa, 1999, 222, 365, 372. 2. Pitcher D.: Element Stewardship Abstract for Xanthium strumarium. http://www.tncweeds. ucdavis. edu/esadocs/documnts/xatstr.html. 3. USDA, ARS, National Genetic Resources Program. Germplasm Resources Information Network (GRIN). http://www.ars-grin.gov/cgi-bin/npgs/html/taxlist.pl?Xanthium. 4. Wolski T., Zwolan W.: Rzepień pospolity – chwast o właściwościach leczniczych. Wiad. Ziel. 2002, 11, 20. 5. Broda B., Mowszowicz J.: Przewodnik do oznaczania roślin leczniczych, trujących i użytkowych. PZWL, Warszawa 2000, 708. 6. Dharmananda S.: Safety issues affecting Chinese herbs: the case of Xanthium. http://www.itmonline.org/arts/xanthium.htm. 7. Flora of Taiwan, National Taiwan University. http://www.pick4.pick.uga.edu/mp/20?search =Xanthium+strumarium. 8. Hegi G.: Illustriette Flora von Mittel Europa. Universität München 1954, 498. 9. Lee J.M.: Common Coclebur. Xanthium strumarium.Iowa State University, Agronomy Demartement. http://www.agron.iastate.edu/~weeds/WeedBiolLibrary/u4coclke1.html. 10. Misfud S.: Malta Wild Plants. http://www.maltawildplants.com/ASTR/Xanthium_strumarium.html. 11. Plants For A Future. http://www.scs.leeds.ac.uk/cgi-bin/pfaf/arr_html?Xanthium+ strumarium &CAN=LATIND. 12. Lloyd S.: Bathurst burr. Farmnote. Demartement of Agiculture – Western Australia. http://www.agric.wa.gov.au/agency/Pubns/farmnote/200/f04100.html. 13. Uchytli R.J.: Xanthium strumarium. U.S. Department of Agriculture Forest Service, Rocky Mountain Research Station, Fire Sciences Laboratory. http://www.fs.fed.us/databese/feis/. 14. Varner B.L. i wsp.: Detection of Cockleburs ( Xanthium strumarium L.) in Syberians Using Hyperspectral Imaginery. http://www.nal.usda.gov/ttic/tektran/data/000011/40/00001140 10.html. 15. Bernasconi P., Woodworth A.R.: Gene exhibiting resistance to acetolactate synthase inhibitor herbicides. Unated States Patent, numer: 5, 633, 437. 16. Fiałkowski D.: Flora roślin naczyniowych Lubelszczyzny. Tom 1, LTN. Lublin 227, 1994. 17. Fiałkowski D.: Flora roślin naczyniowych Lubelszczyzny. Tom 1, LTN. Lublin 612, 1995. 18. Mowszowicz J.: Przewodnik do oznaczania krajowych roślin zielarskich. PWRiL, Warszwa 1983, 397. 19. Mowszowicz J.: Krajowe chwasty polne i ogrodowe. Przewodnik do oznaczania. PWRiL, Warszwa 1986, 559. 20. Sarwa A.J.: Wielki leksykon roślin leczniczych. Książka i Wiedza, Warszawa 2001, 386. 21. Świejkowski L., Rośliny lecznicze i przemysłowe – klucz do oznaczania. Libra, Warszawa 1990, 439. 22. Hsu F.L. i wsp.: Cafeic acid as a active principle from the fruit of Xanthium strumarium to lower plasma glucose in diabetic rats. Planta Med. 2000, 66, 288. 23. Kim I.T. i wsp.: Methanol Extract of Xanthium strumarium L. Possesses Anti-inflamatory and Anti-nociceptive Activities. Biol. Pharm. Bull. 2005, 28, 94. 24. Kim Y.S. i wsp.: Two cytotoxic sesquiterpene lactones from the leaves of Xanthium strumarium and their in vitro inhibitory activity on farnesyltransferase. Planta Med. 2003, 69, 375. 25. Mehta P. i wsp.: Antimicrobial properties of some plant extracts against bacteria. Folia Microbiol. 1983, 6, 467. 26. Murillo-Alvarez J.I. i wsp.: Antimicrobial and cytotoxic activity of some medicinal plants from Baja California Sur (Mexico). Pharm. Biol. 2001, 6, 445. 27. Nairman F. i wsp.: Anti- Helicobacter pylori activities of six Iranian plants. J. Etnopharmacol. 2004, 9, 146. 28. Talkal T.S. i wsp.: In vitro and in vivo antitrypanosomal activity of Xanthium strumarium leaves. J. Ethnopharmacol. 1995, 49, 141. 29. Talkal T.S. i wsp.: In vitro and in vivo antitrypanosomal activity of Xanthium strumarium leaves and Parthenium hysterophorus flowers. Indian-Drugs 1995, 32, 433. 30. Herbari Virtual de les Illes Balears. Labolatori de Botŕnica, Department de Biologia, Universitat de les Illes Balears. http://www.herbarivirtual.uib.es/imatges/81912.jpg. 31. Maeterlinck M.: Inteligencja kwiatów. R.Wagner, Warszawa 1948. 32. Dasgupta J., Kundu B.C.: Pharmacognositc studies of Xanthium strumarium Linn. I. Root. Planta Med. 1963, 11, 470. 33. Dharmananda S.: Appendix: Xanthium in traditional and modern Chinese medical practice. http://www.itmonline.org./arts/xanthium.html. 34. Felther H.W.: The Eclectic Materia Medica, Pharmacognosy & Terapeutics. http://www.vu.edu.au/library/pdf/5SciencePostgraduateSubjects.pdf. 35. Khafagy S.M. i wsp.: Phytochemical investigation of Xanthium strumarium.Planta Med. 1974, 26, 75. 36. Zwolan W. i wsp.: Chromatographic analysis of phenolic acids present in vegetative and generative parts of Xanthium strumarium L. Herba Pol. 3/4, 23. 37. Ma Y.T. i wsp.: Thiazinedione from Xanthium strumarium L. Phytochem. 1998, 48, 1083. 38. Sheu S.J. i wsp.: Determination of Xanthium constituents by high performance liquid chromatography and capillary electrophoresis. J. Food & Drugs Anal. 2003, 11, 67. 39. Madej J.: Analiza fitochemiczna części nadziemnych i podziemnych rzepienia pospolitego Xanthium strumarium L. Praca magisterska, AM, Lublin 2004. 40. Ziętek E.; 2005. Analiza steroli i triterpenów w częściach podziemnych i nadziemnych Xanthium strumarium L. Praca magisterska, AM, Lublin. 41. Dharmananda S.: Safety issues affecting Chinese herbs: Pyrrolizidine alkaloids. http://www.itmonline.org/arts/pas.htm. 42. Lipiec M.: Analiza fitochemiczna ziela i owoców rzepienia pospolitego Xanthium strumarium L. Praca magisterska, AM, Lublin 2002. 43. Ahija M.M., Nigam S.S.: Chemical investigation of the essential oil from the leaves of Xanthium strumarium (Linn.). Flavour Ind. 1970, 1, 627. 44. Habibi Z. i wsp.: Composition of the essetial oil of Xanthium brasilicum Vello from Iran. J. Esential Oil Res. 2004, 1, 25. 45. Khafagy S.M., Metwally A.M.: Isolation of a crystalline sesquiterpenic keto-lactone from Xanthium occidentale.Planta Med. 1970, 18, 318. 46. Saxena V.K., Mandal S.K.: A xanthanolide from Xanthium strumarium. Phytochemistry, 1994, 4, 1080. 47. Roth L. i wsp.: Giftpflanzen Pflanzengifte. Nikol, Hamburg 1994, 738. 48. Ahmed A.A. i wsp.: A xanthanolide diol and a dimeric xanthanolide from Xanthium species. Planta Med. 1999, 65, 470. 49. Mahmoud A.A.: Xanthanolides and xanthane epoxide derivatives from Xanthium strumarium. Planta Med. 1998, 64, 724. 50. Malik M.S. i wsp.: Xanthanolides from Xanthium strumarium. Phytochem. 1993, 32, 206. 51. Marco J.A. i wsp.: Xanthanolides from Xanthium:absolute configuration of xanthanol, isoxanthanol and their C-4 epimers. Phytochem. 1993, 34, 1569. 52. Cole R.J. i wsp.: Isolation and redefinition of the toxic agent from cocklebur ( Xanthium strumarium). J. Agricult. Food Chem. 1980, 28, 1330. 53. Hatch R.C. i wsp.: Toxicologic study of carboxyatractyloside (active principle in coclebur – Xanthium strumarium) in rats treated with enzyme indecers and inhibitors and glutathione precursor and depletor. Am. J. Vet. Res. 1982, 43, 111. 54. Luciani S., Varotto R.: Difference between atractyloside and carboxyatractyloside on the binding to the mitochondrial membrane. Febs Letteres, 1975, 56, 194. 55. MacLeod J.K. i wsp.: Two cytotoxic kaurene glycosides from the burrs of Xanthium purgens.J. Nat. Prod. 1990, 53, 451. 56. Dharmananda S.: Gallnuts and the Uses of Tannins in Chinese Medicine. http://www.itmonline.org/arts/gallnuts.htm. 57. Aggarwal B.B. i wsp.: Nuclear Factor – κB: A Holly Grail in Cancer Prevention and Therapt. Current Signal Transduction Therapy 2006, 1, 25. 58. Lavault M. i wsp.: Antileishmanial and antifungal activities of xanthanolides isolated from Xanthium marcoaprum. Fitoterapia 2005, 76, 363. 59. Moon E.Y. i wsp.: Immunomodulating activities of water extract from Xanthium strumarium (II): Immunomodulating effects of the water layer after treated with chloroform. Arch. Pharm. Res. 1991, 14, 217. 60. Roussakis Ch. i wsp.: Cytotoxic activity of xanthatin and the crude extracts of Xanthium strumarium.Planta Med. 1994, 60, 473. 61. Sato Y. i wsp.: A xanthanolide with potent antibacterial activity against methicilin-resistant Staphylococcus aureus. Pharm. Pharmacol. 1997, 49, 1042. 62. Tripathi R.N. i wsp.: Fungitoxicity of pollen grains with special reference to Xanthium strumarium ( Compositae). Grana 1985, 24, 61. 63. Cai Y. i wsp.: Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer. Life Sciences 2004,74, 2157. 64. Hong Ch.H. i wsp.: Evaluation of natural products on inhibition of inducible cyclooxygenase (COX-2) and nitric oxide synthase (iNOS) in cultured mouse macrophage cells. J. Ethnopharmacol. 2002, 83, 153. 65. Kang G.D. i wsp.: Screening and comparison of antioxidant activity of solvent extracts of herbal medicines used in Korea. J. Ethnopharmacol. 2003, 87, 231. 66. Lae H.J. i wsp.: Inhibition of nitric oxide synthesis by 8-epi-xanthatin in PLS-activated macrophages. Yakhak Hoechi 1998, 42, 540. 67. Prieto J.M. i wsp.: Identification of a 5-LOX inhibitor from Xanthium spinosum L. Rev. Fitoterapia. Anual Congres Barcelona. 2002, A056. 68. Shale T.L. i wsp.: Screening of medicinal plants used in Lesotho for anti-bacterial and anti-inflammatory activity. J. Ethnopharmacol. 1999, 67, 347. 69. Coelho de Souza G. i wsp.: Ethnopharmacological studies of antimicrobial remedies in the south of Brazil. J. Ethnopharmacol. 2004, 90, 135. 70. Pinel B. i wsp.: Synthesis of reduced xanthatin derivatives and in vitro evaluation of their antifungal activity. J. Enzyme. Inhibit. Med. Chem. 2005, 20, 575. 71. Li Y. i wsp.: In vitro anti- Helicobacter pylori action of 30 Chinese herbal medicines uses to treat ulcer diseases. J. Ethnopharmacol. 2005, 98, 329. 72. Wang Y.Ch. i wsp.: Screening of anti- Helicobacter pylori herbs deriving form Taiwanese folk medicinal plants. FEMS Immunology and Med. Microbiol. 2005, 43, 295. 73. Abdel-Malek S. i wsp.: Drug leads from the Kallawaya herbalists of Bolivia. 1. Background, rationale, protocol and anti-HIV activity. J. Ethnopharmacol. 1996, 50, 157. 74. Rocha L.G. i wsp.: A review of natural products with antileishmanial activity. Phytomed. 2005, 12, 514. 75. Kawazu K. i wsp.: Xanthium and 8-epi-xanthatin as insect development inhibitors from Xanthium candense Mill. Experientia 1979, 35, 1294. 76. Nieves L.J. i wsp.: Effecto diuretico del Xanthium strumarium L. (guizazo de caballo). Rev. Cubana Planta Med. 1999, 1, 22. 77. Kupiecki F.P. i wsp.: Isolation and characterization of a hypoglycemic compound from Xanthium strumarium. J. Pharm. Sci. 1974, 63, 1166. 78. Li W.L. i wsp: Natural medicines used in the traditional Chinese medical system for therapy of diabetes mellitus. J. Ethnopharmacol. 2004, 92, 1-21. 79. Turner C.E., Craig J.C.: Hypoglycemic compound and method of preparing. Unated States Patent, number: US 3922263. 80. Sucher N.J.: Insights from molecular investigations of traditional Chinese herbal stroke medicines: Implications for neuroprotective epilepsy therapy. Epilepsy & Behavior, 2006, 8, 350. 81. Balachandran P., Govindarajan R.: Cancer–an ayurvedic perspective. Pharm. Res. 2005, 51, 19. 82. Graham J.G. i wsp.: Plants used against cancer – an extension of the work of Jonathan Hartwell. J. Ethnopharmacol. 2000, 73, 347. 83. Ancuceanu R.V.: Pharmacologically Active Natural Compounds for Lung Cancer. Alter. Med. Rev. 2004, 9, 402. 84. Menon G.S. i wsp.: Interaction of microtubules with activ principles of Xanthium strumarium. Phys. Chem. Phys. Med. NMR 2001, 33, 153. 85. Steward M.J., Steenkamp V.: The biochemistry and toxicity of atractyloside. A review. Ther. Drug Monit. 2000, 22, 641. 86. Kephalas T. i wsp.: Production of carboxyatractyloside and atractyloside by cell suspension cultures of Atractylis gummifera. Phytochem. 1999, 51, 53. 87. Gailard Y., Pepin G.: Poisoning by plant material: rewiev of human cases and analytical determination of main toxins by high-performance liquid chromatography – (tandem) mass spectrometry. J. Chromatogr. B 1999, 733, 181. 88. Stuart B.P. i wsp.: Cocklebur ( Xanthium strumarium L. var. strumarium) intoxication in swine: review and redefinition of the toxic principle. Vet. Pathol. 1981, 18, 386. 89. Turgut M. i wsp.: Carboxyatractyloside poisoning in humans. Ann. Ter. Ped. 2005, 25, 125. 90. Ailmets Senses – Treasure of East. http://www.treasureofeast.com/fromulas.html. 91. Balance Healthcare. Products, Services and Support for Profesionals. http://www.balanceheatlhcare.com/subCat.aps?subCat_id=1. 92. China–West #06 Children Xanthium Formula. http://www.nutriwest.com/cat/cw-0006.html. 93. Commitee on Chinese Medicine and Pharmacy, Department of Health, Taiwan. http://www.ccmp.gov.tw/en/information/formula.asp?relno=52&selno=0&no=&PageNo=10. 94. Jade Screen & Xanthium Formula. http://www.spanda.com/herbs/golden/jsx.html. 95. Mengjun Y.: Nano Medicine ´Huodan Biyan´ nad its preparing process. United States Patent Number: CN 1368349. 96. Zhang Y., Zhang J.: Preparation method of Xanthium sibiricum volatile oil pharmaceutical. United States Patent Number: CN 1053364. 97. Farmakopea Polska IV. PZWL, Warszawa 1970. 98. Farmakopea Polska VI. PTFarm. Warszawa 2002. 99. Ibrahim R.K., Towers G.H.N.: The identification by chromatography, of plant phenolic acids. Arch. Biochem. Biophys. 1960, 87, 125. 100. Jerzmanowska Z.: Substancje roślinne, metody wyodrębniania. T.1. PWN, Warszawa 1970. 101. Lewandowska A: Analiza związków fenolowych występujących w rzepieniu pospolitym ( Xanthium strumarium L.) ze szczególnym uwzględnieniem flawonoidów i garbników. Praca magisterska, AM. Lublin 2006.












