© Borgis - Anestezjologia Intensywna Terapia 3/2005, s. 200-206
Piotr Smuszkiewicz1, Tomasz Tyrakowski2, Leon Drobnik1
Płynna wyściółka dróg oddechowych i transport śluzowo-rzęskowy. Czy znieczulenie ogólne może wpływać na ich funkcję?
Airway surface liquid and mucociliary transport. Can general anaesthesia affect their function?
1 Klinika Anestezjologii, Intensywnej Terapii i Leczenia Bólu AM w Poznaniu
kierownik: prof. dr hab. n. med. L. Drobnik
2 Zakład Patobiochemiii i Chemii Klinicznej CM Uniwersytetu im. M. Kopernika w Bydgoszczy
kierownik: prof. dr hab. n. med. T. Tyrakowski
Summary
Mucus clearance is an important component of the lung´s innate defence against disease, and the ability of the airways to clear mucus is strongly dependent on the volume of liquid on airway surfaces. Airway epithelium regulates ion concentration, volume and electric potential of the airways´ surface liquid. Mucus hydration is determined by the volume of liquid present on airway surfaces, which in turn may be modified by active ion transport. The latter can be markedly compromised by various anaesthesia activities, such as decreased temperature and humidity of inspired gases and mechanical ventilation. Halothane, enflurane and isoflurane impair ciliary beat frequency and mucus transport by depressing chloride epithelial ion transport. Propofol increases calcium ion concentration, therefore preserving ciliary transport and mucus clearance and should be recommended for longer sedation in intensive care settings. Mechanical ventilation with large tidal volumes and high oxygen concentration leads to decreased fluid clearance in the lung, increases permeability for small particles and impairs Na-K-ATPase activity. In conclusion, general anaesthesia and mechanical ventilation impair the airway surface liquid function, and can contribute to the development of respiratory complications in the perioperative period.

Mechanizmy oczyszczania dróg oddechowych stanowią efektywną obronę przeciwko wdychanym czynnikom szkodliwym. Barierą pomiędzy światłem dróg oddechowych (środowiskiem zewnętrznym) a tkanką podnabłonkową (środowiskiem wewnętrznym) jest nabłonek dróg oddechowych, w którym znajdują się systemy aktywnego transportu jonów, wydzielania substancji formujących płyn okołorzęskowy ( Periciliary Liquid – PCL) i mucyn oraz wektorowa czynność rzęsek. Nabłonek reguluje płynną wyściółkę dróg oddechowych ( Airway Surface Liquid – ASL) w zakresie stężenia jonów, objętości oraz jej właściwości elektrycznych, określając wielkość przeznabłonkowej różnicy potencjałów, czyli wielkość oddziaływań elektrostatycznych między składnikami ASL a powierzchnią nabłonka [1, 2].
FIZJOLOGIA ASL
Nabłonek dróg oddechowych stanowi heterogenną populację komórek rzęskowych i innych, wyściełających drogi oddechowe. Zintegrowana obrona dróg oddechowych przed wnikającymi do płuc czynnikami szkodliwymi uwzględnia współdziałanie trzech elementów:
A – płynnej warstwy ochronnej (ASL) na powierzchni dróg oddechowych, w sposób ciągły przemieszczającej się z dystalnych do proksymalnych odcinków dróg oddechowych;
B – nabłonka dróg oddechowych, stanowiącego czynnościową i anatomiczną podstawę dla integracji mechanizmów obronnych, także tych, które oddziaływują przez układ nerwowy i hormonalny oraz
C – komórek i mediatorów układu immunologicznego obecnych w drogach oddechowych (Toll – receptory na makrofagach obecnych w ASL, komórkach dendrytycznych i nabłonkowych oraz białka przeciwbakteryjne – lizozym , laktoferyna i beta-defensyny ASL) (ryc. 1). ASL jest wydzieliną komórek nabłonkowych i kubkowych oraz gruczołów podśluzowych. Składa się z dwóch warstw: okołorzęskowej płynnej (PCL), której grubość jest zwykle równa długości rzęsek oraz śluzowej, znajdującej się na powierzchni PCL [3]. Obie warstwy są przemieszczane przez system transportu śluzowo-rzęskowego ( Mucociliary transport – MCT) z podobną prędkością [4], ok. 3 mm min-1 do jamy ustnej, skąd są wykrztuszane lub połykane [5] (ryc. 2). Funkcją żelu, dzięki lepkości, jest przechwytywanie wdychanych cząstek, natomiast PCL pełni rolę nawilżającą, ułatwiając napędzany rzęskami transport śluzu [6]. Śluz zawiera wodę (95%), sole nieorganiczne (1%) i makromolekuły, jak glikoproteiny i lipidy (4%). Glikoproteiny nadają śluzowi lepkość i elastyczność. W aspekcie skuteczności transportu, elastyczność śluzu jest ważniejsza od lepkości.

Ryc. 1. Elementy strukturalne ścianki drogi oddechowej biorące udział w reakcjach oczyszczania i utrzymania drożności.
T – komórka tuczna, M – makrofag, U – komórka nabłonkowa urzęsiona, G – komórka produkująca śluz, L – limfocyt, E – komórka neuroendokrynowa, F – fibroblast, C – chrząstka pierścieniowata oskrzela
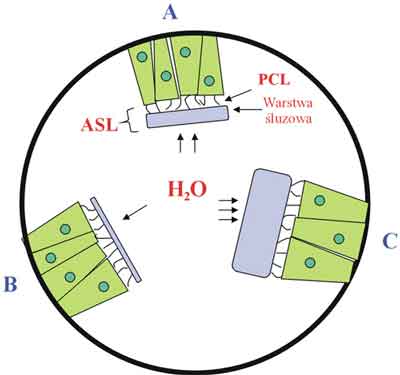
Ryc. 2. Warstwa śluzowa jako rezerwuar płynu.
A – stan fizjologiczny, B – usunięcie płynu z ASL zmniejsza grubość warstwy śluzowej z zachowaniem wysokości PCL,
C – przy zwiększeniu PCL, „dodany” w nadmiarze płyn przemieszcza się do warstwy śluzowej
Biorąc pod uwagę znaczną różnorodność w zakresie pola powierzchni: pęcherzyków płucnych (70 m2 ), dystalnych (ok. 2 m2 ) i proksymalnych (ok. 50-60 cm2 ) dróg oddechowych, utrzymywanie stałej grubości PCL (ok. 5-10 ?m) wymaga ciągłej absorpcji płynu podczas jego dogłowowego przemieszczania [7]. Komórki nabłonka dróg oddechowych wypracowały liczne mechanizmy pozwalające efektywnie kontrolować wysokość ASL, a tym samym utrzymywać skuteczny MCT. Najważniejszymi z nich są bierny transport wody oraz aktywny transport jonów. W warunkach fizjologicznych transport płynu odbywa się dwukierunkowo, z przewagą przepływu ze światła dróg oddechowych do komórek [8]. Aktualne badania nabłonkowych kultur komórkowych wykazały, że płyn może być uzupełniany lub usuwany z warstwy śluzowej bez zmiany wysokości PCL [9]. Stwierdzono, że usunięcie ok. 50% płynu z ASL, prowadzi do zmniejszenia grubości warstwy śluzowej z zachowaniem wysokości PCL. Przy zwiększeniu objętości PCL, cały „dodany” w nadmiarze płyn, przemieszcza się do warstwy śluzowej. Przy łączeniu się dwóch mniejszych oskrzelików w jeden większy, następuje zwiększenie objętości ASL, a nadmiar płynu może być przejściowo zgromadzony w warstwie śluzowej z zachowaniem prawidłowej wysokości PCL i wielkości MCT. Przeciwnie, gdy dochodzi do utraty wody w wyniku nadmiernego parowania, mechanizmy wyrównawcze wybiórczo zmniejszają warstwę śluzową, zachowując wysokość PCL i MCT. Z obserwacji tych wynika, że wielkość warstwy śluzowej jest zmienna oraz, że pełni ona rolę rezerwuaru wody w stosunku do PCL, gwarantując skuteczność MCT [4] (ryc. 2).
ROLA AKTYWNEGO PRZEZNABŁONKOWEGO TRANSPORTU JONÓW W OKREŚLANIU OBJĘTOŚCI ASL
U płodu, głównym rodzajem aktywnego transportu płynu w drogach oddechowych i pęcherzykach płucnych jest wydzielanie Cl-. To przemieszcza izotoniczny roztwór NaCl do światła płuc w okresie płodowym. Po porodzie nabłonki oddechowe zmieniają rodzaj transportu: z sekrecji Cl- na absorpcję Na+, co nasila wchłanianie wody tak, że w ciągu kilku minut pozostaje na powierzchni dróg oddechowych cienka (5-10 ?m) warstewka płynu [10]. Tak więc, przeważający w warunkach fizjologicznych proces absorpcji Na+ i wody z warstwy luminalnej do warstwy podśluzowej stanowi silny mechanizm zabezpieczający drogi oddechowe przed „zalaniem” i utrzymuje ich drożność [6].
Zasadniczym czynnikiem determinującym objętość ASL na powierzchni nabłonka jest stężenie jonów, co w połączeniu z wysoką przepuszczalnością dla wody, szybko przywraca i utrzymuje objętość ASL w prawie izotonicznym stanie [11]. Ilość i stężenie jonów w ASL na nabłonku dróg oddechowych jest określona w części przez ruch płynu wzdłuż jego powierzchni oraz w części przez aktywny transport jonów w danym regionie. Podobnie jak w przypadku komponenty śluzowej, również PCL reguluje swoją wielkość – nabłonek szybko wchłania nadmiar PCL aż do momentu gdy osiągnie fizjologiczną wysokość ok. 7 ?m [4]. Liczne badania, w oparciu o pomiary przeznabłonkowej różnicy potencjałów jako wskaźnika aktywnego transportu jonów oraz stosowanie inhibitorów transportu Na+ (amilorid) i Cl- (bumetanid), pozwalają zrozumieć regulację absorpcji PCL jako funkcję jej objętości i wysokości [9]. Podstawowym procesem reabsorpcji nadmiaru PCL jest transport jonu Na+ do wnętrza komórki nabłonkowej. Gdy objętość PCL osiągnie fizjologiczną wysokość, wchłanianie płynu ulega zwolnieniu. Zahamowanie przewodności dla Na+ generuje mechanizm sekrecyjny dla jonów Cl-, który indukuje napływ płynu i zwiększenie objętości PCL [12]. Oba procesy (absorpcji i sekrecji) zależne są od znajdujących się w błonie apikalnej kanałów jonowych – chlorkowych i sodowych [1].
Energii dla obu torów transportu dostarcza ATP-aza Na-K, bezpośrednio dla transportu Na+, a pośrednio przez układ współtransportowy Na-K-2Cl, (wrażliwy na bumetanid) dla transportu Cl- [1]. Informacje, które kontrolują aktywność tych kanałów są zakodowane w samej PCL. I tak dla kanału nabłonkowego Na+, związkami kontrolującymi jego funkcję są prawdopodobnie zewnątrzkomórkowe nukleotydy jak np. ATP, który w badaniach doświadczalnych wykazuje efekt hamujący poprzez interakcję z receptorem purynergicznym 2 [13]. Kanał chlorkowy należy do rodziny transporterów wiążących ATP i zawiera dwie domeny wiążące nukleotydy. Jest on aktywowany przez mechanizm transdukcji związanej z cAMP, przez aktywację cyklazy adenylowej, zależnej od białka G, hydrolizę cAMP, fosfodiesterazę oraz aktywność kinaz i fosfataz białkowych [14]. Oprócz regulacji zależnej od cAMP, kanał chlorkowy wykazuje zależność od aktywności białkowej kinazy C, która reguluje mechanizm otwarcia. Aktualne wyniki badań sugerują, że miejscowe powstawanie adenozyny, reagującej ze swoim receptorem błonowym, białkami Gs i cyklazą adenylową, sprzyja energooszczędnemu procesowi otwarcia kanału [15]. Jest to istotne z punktu widzenia potencjału oksydacyjno-redukcyjnego komórek, gdyż zmiany w ich metabolizmie wpływają na procesy otwierania i zamykania kanału chlorkowego [16].
W ostatnich latach zwraca się uwagę na kanały potasowe oraz ich udział w procesach transportu przeznabłonkowego i współtworzenia płynnej wyściółki dróg oddechowych. Przynajmniej 3 zróżnicowane biofizycznie i farmakologicznie kanały K są zaangażowane w błonowe przewodnictwo jonów K+: cAMP-zależny, Ca-zależny i tzw. Maxi kanał K o dużej przewodności [16]. Podstawnoboczny przepływ K+ jest kluczowy dla procesów sekrecji i absorpcji, a jego zahamowanie nieselektywnymi blokerami redukuje transport wszystkich jonów. Kanał K+ usuwa jony potasu wchodzące do komórki w czasie wymiany na Na+ lub Cl- oraz przyczynia się do zachowania komórkowego potencjału błonowego, istotnej siły elektrochemicznej, napędzającej bierny przezbłonowy ruch jonów [17] (ryc. 3).

Ryc. 3. Przeznabłonkowy transport jonów w drogach oddechowych.
Transport jonów sodowych – faza absorpcyjna.
Transport jonów chlorkowych – faza sekrecyjna.
FUNKCJA RZĘSEK
Rzęski oddechowe posiadają wzorzec rytmicznych uderzeń. Każdy cykl składa się z 2 aktywnych składowych: 1 – efektywnego uderzenia, podczas którego w pełni wyprostowana rzęska porusza się prostopadle do powierzchni nabłonka oraz 2 – faza regeneracyjna, w której ugięta rzęska porusza się mniej lub bardziej równolegle do powierzchni komórek, bocznie i wstecznie aż do pozycji wyjściowej. Czas trwania 2 fazy jest 2-3-krotnie dłuższy niż pierwszej. Pomiędzy nimi następuje krótka faza spoczynkowa, zanim rzęska rozpocznie fazę regeneracyjną. Czas trwania przerwy zależy od częstotliwości uderzeń rzęsek ( Ciliary Beat Frequency – CBF). Uginanie rzęsek wywoływane jest ślizganiem się mikrotubul względem siebie, jako wyraz sprzężenia mechaniczno-chemicznego (podobnie jak system aktyna-miozyna w mięśniach). Energia potrzebna do uderzeń rzęsek pochodzi z hydrolizy ATP przy udziale ATP-azy zawartej w ramionach wewnętrznych struktur rzęsek-dynein. Prędkość ruchów ślizgowych mikrotubul i częstotliwość uderzeń rzęsek zależy od ilości ramion dynein i stężenia ATP.
CBF zwiększa się od obwodowych odcinków dróg oddechowych w kierunku proksymalnym. W większych drogach oddechowych, jak nos, tchawica i główne oskrzela, CBF wynosi 13-27 Hz, w mniejszych – małe oskrzela i oskrzeliki – 7-12 Hz [18].
Aktywność rzęsek regulowana jest przez humoralne i hormonalne układy przekaźnikowe:
1. autokrynno-parakrynny układ tlenek azotu (NO) – cGMP-białkowa kinaza G zwiększa CBF („regulacja w górę”) [19, 20];
2. stymulacja purynergiczna – indukowany ATP wzrost stężenia Ca+2 aktywuje kaskadę przekaźnikową, obejmującą cyklazę adenylową i cAMP-zależną kinazę białkową A [21];
3. stymulacja receptorów adenozynowych A3 zwiększając stężenie Ca+2 stymuluje CBF [22];
4. wazopresyna wydzielana przez nabłonek oddechowy, poprzez receptory V1b stymuluje CBF mobilizując Ca+2 z zapasów wrażliwych na thapsigarginę [23];
5. neuropeptyd Y zmniejsza CBF poniżej podstawowego poziomu przez aktywację izoformy kinazy białkowej C (nPKC) i ATP-azę; jest to autonomiczny eferentny neurotransmiter, hamujący MCT [24];
6. substancja P – SP (tachykininy) poprzez receptory NK1 (neurokininowe) powoduje wzrost CBF i MCT, zależny od wielkości destrukcji tego białka wokół receptorów [25];
7. regulacja opioidowa – b-endorfiny wywierają efekt hamujący na CBF i MCT;
8. układ GABA-ergiczny – pobudzanie receptorów GABA zmienia stężenie Ca+2 śródkomórkowego i zmniejsza CBF [26].
NEUROPEPTYDY I LOKALNE UKŁADY REGULUJĄCE
Reakcje obronne dróg oddechowych podlegają złożonym procesom regulacyjnym. Oprócz oddziaływań nerwowych i hormonalnych, które dostosowują funkcję dróg oddechowych do aktualnego obciążenia ustroju, istnieją lokalne mechanizmy regulacyjne odpowiedzialne za scalenie elementów czynności dróg oddechowych (napięcie mięśni gładkich, wydzielanie śluzu i transport jonów przez nabłonek) w skuteczną reakcję fizjologiczną [1]. Dla wymienionych zagadnień, w tym wydzielania płynu przez nabłonek oddechowy, szczególne znaczenie ma unerwienie czuciowe przewodzone głównie przez nerw błędny [27]. Istotnymi składowymi są capsaicyno-wrażliwe receptory włókien C, odpowiadające na bodźce drażniące receptory szybko adaptujące i mięśniowe receptory wolno adaptujące. Receptory te, zbiorczo nazywane receptorami kaszlu, generują sygnały aferentne. W szczególnym centrum zainteresowania znajdują się niezmielinizowane zakończenia włókien C, które pod wpływem bodźców drażniących wydzielają neuropeptydy tj. tachykininy (neurokininy – NKA, NKB, substancja P – SP), peptyd związany z genem kalcytoninowym – CGRP, naczyniowo-aktywny peptyd jelitowy, peptyd histydyno-metioninowy [28, 29]. Uwolnienie neuropeptydów z żylakowatości neurosekrecyjnych tych włókien, powoduje zmiany przeznabłonkowego transportu jonów, tym samym wpływając na ilość i jakość ASL.
Na podstawie badań wykonanych po pobudzeniu nerwowych receptorów dróg oddechowych przypuszcza się, że w czasie kaszlu występują lokalne zmiany transportu jonów w drogach oddechowych, ułatwiające oczyszczanie dróg oddechowych przez korzystne zmiany ilościowe ASL. Zmiany transportu jonów w fazie wydechowej kaszlu mogą zmniejszać przyczepność śluzu, do ściany oddechowej i tym samym ułatwiać ewakuację śluzu natomiast w fazie wdechowej kaszlu, zmiany transportu jonów mogą ułatwiać wdech przez zmniejszenie płynnej wyściółki i zwiększenie efektywnego przekroju dróg oddechowych. Tę hipotezę nazwano jonowym wsparciem kaszlu ( cough ionic support reaction) [30] (ryc. 4).
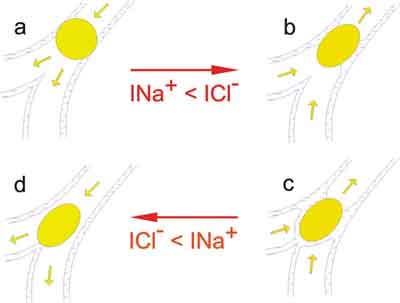
Ryc. 4. Sugerowana rola procesów transportu jonów w oczyszczaniu dróg oddechowych przez kaszel.
INa+ i ICl- – wypadkowe strumienie jonów sodowych i chlorkowych;
a i b – pobudzenie wydzielania chlorków zwiększa płynną wyściółkę i ułatwia odklejenie śluzu od ściany drogi oddechowej;
c i d – pobudzenie reabsorbcji sodu w czasie kaszlu zmniejsza płynną wyściółkę, udrażnia drogi oddechowe zablokowane przez złogi śluzu i zwiększa ilość powietrza dochodzącego poza przeszkodę. Oba procesy przebiegając naprzemiennie mają wartość przystosowawczą, ponieważ zwiększają efektywność kaszlu. Strzałki oznaczają ruch powietrza w drogach oddechowych.
Tachykininy mają różnorodny wpływ na funkcję dróg oddechowych poprzez receptory NK1 (głównie aktywowane przez SP) oraz receptory NK2 (aktywowane przez NKA). Tachykininy wywołują uogólnioną odpowiedź skurczową w drogach oddechowych. Reakcja skurczowa na NKA jest silniejsza w małych oskrzelikach, co wskazuje na ich silniejszy wpływ na dystalne drogi oddechowe, podczas gdy na reakcje skurczowe w proksymalnych drogach oddechowych istotniejszy wpływ ma unerwienie cholinergiczne. Mechaniczne usunięcie lub uszkodzenie nabłonka oddechowego nasila skurcz oskrzeli w odpowiedzi na tachykininy, głównie z powodu utraty obojętnej neuropeptydazy (NEP) zawartej w tymże nabłonku, która jest kluczowym czynnikiem odpowiedzialnym za degradację tachykinin [31]. Substancja P stymuluje sekrecję śluzu z gruczołów podśluzowych i komórek kubkowych poprzez aktywację receptorów NK1. Tachykininy wzmagają również neurotransmisję cholinergiczną ułatwiając uwalnianie acetylocholiny z zakończeń nerwów cholinergicznych oraz przyspieszając przekaźnictwo zwojowe. Tachykininy są rozkładane przez 2 enzymy – enzym konwertujący angiotensynę (ACE) i NEP. ACE jest głównie zlokalizowana w komórkach śródbłonka naczyniowego, degradując peptydy wewnątrznaczyniowe, podczas gdy NEP jest ważna dla metabolizmu tachykinin w drogach oddechowych. Aktywność NEP jest zredukowana w infekcjach wirusowych, u palaczy tytoniu i przy zwiększeniu osmolarności [32]. Wspólnie z SP wydzielany jest CGRP. Peptyd ten rozszerza naczynia, głównie oskrzelowe i sprzyja zwiększeniu przepływu krwi w odpowiedzi na stymulację czuciowych zakończeń nerwowych w drogach oddechowych. Oprócz tachykinin i CGRP, unerwienie dróg oddechowych zawiera inne neuropeptydy, które uczestniczą w wywoływaniu zjawisk neurogennych. Są to galanina, cholecystokinina i enkefaliny oraz sekretoneuryna [31].
ASPEKTY ANESTEZJOLOGICZNE
Aktualnie zwraca się większą uwagę na zachorowalność związaną ze znieczuleniem ogólnym. Najważniejszym i najczęstszym problemem w okresie pooperacyjnym są powikłania oddechowe, głównie u chorych z grupy wysokiego ryzyka oraz po długotrwałym znieczuleniu ogólnym – opisywana częstość powikłań wynosi 6-21% [33]. Przypadki pooperacyjnych infekcji płucnych i niedodmy są oczywiście wieloczynnikowe, jednak zależą w głównej mierze od właściwego usuwania wydzieliny. Wymaga to efektywnego kaszlu oraz sprawnego transportu śluzowo-rzęskowego. O ile w okresie pooperacyjnym kaszel i odkrztuszanie wydzieliny są doceniane, o tyle działania w czasie znieczulenia ogólnego zmierzające do jak najmniejszego upośledzenia transportu śluzu nie zawsze są respektowane. Już wiele lat temu Gamsu i wsp. [34] wykazali zmniejszenie transportu śluzu w okresie pooperacyjnym. Klirens śluzu może być zmniejszony w wyniku zmian jego lepkości lub objętości, a także przez zmniejszenie częstości uderzeń rzęsek lub przez oba mechanizmy. Zmniejszenie objętości śluzu pod wpływem anestetyków wydaje się mało prawdopodobne; obserwowano raczej jego nadmierną produkcję. Upośledzenie transportu śluzowo-rzęskowego w czasie znieczulenia ogólnego jest zwykle wywołane zmniejszeniem CBF. Z logarytmicznej zależności pomiędzy CBF a MCT wynika, że skromna redukcja funkcji rzęsek np. o 20%, zmniejsza transport śluzu aż o 50%.
Wiele elementów związanych z prowadzeniem znieczulenia ogólnego i wentylacji zastępczej oddziaływuje na transport śluzowo-rzęskowy.
1. Temperatura i wilgotność mieszaniny oddechowej
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
29 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
69 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
129 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 78 zł
Piśmiennictwo
1. Tyrakowski T: Drogi oddechowe; w: Patofizjologia (red.: Maśliński S, Ryżewski J) PZWL, Warszawa, 2002.
2. Boucher R: Chairman´s Summary. Proc Am Thorac Soc 2004; 1: 2-3.
3. Hirsh A: Altering airway surface liquid volume: inhalation therapy with amiloride and hiperosmotic agents. Advanced Drug Delivery Reviews 2002; 54: 1445-1462.
4. Boucher R: Regulation of airway surface liquid volume by human airway epithelia. Eur J Physiol 2002; 445: 495-498.
5. Wanner A, Salathe M, O´Riordan TG: Mucociliary clearance in the airways AJRCCM 1996; 154: 1868-1902.
6. Phillips JE, Yeates DB: Bidirectional transepithelial water transport: chloride-dependent mechanisms. J Membrane Biol 2000; 175: 213-221.
7. Boucher R: Human airway transport. AJRCCM 1994; 150: 271-281.
8. Widdicombe JH, Widdicombe JG: Regulation of human airway surface liquid. Respir Physiol 1995; 99: 3-12.
9. Tarran R, Grubb BR, Gatzy JT, Davis CW, Boucher R: The relative roles of passive surface forces and active ion transport in the modulation of airway surface liquid volume and composiotion. J Gen Physiol 2001; 118: 223-236.
10. Strang LB: Fetal lung liquid: secretion and reabsorption. Physiol Rev 1991; 71: 991-1016.
11. Matsui H, Davis CW, Tarran R, Boucher R: Osmotic water permeabilities of cultured, well-differentiated normal and cystic fibrosis airway epithelia. J Clin Invest 2000; 105: 1419-1427.
12. Willumsen NJ, Davis CW, Boucher RC: Intracellular Cl activity and cellular Cl pathways in cultured human airway. Am J Physiol 1989; 256: C1033-C1044.
13. Mall M, Wisser A, Gonska T, Calenborn D, Kuehr J, Brandis M, Kunzelmann K: Inhibition of amiloride-sensitive epithelial Na absorption by extracellular nucleotides in human normal and cystic fibrosis airway. Am J Respir Cell Mol Biol 2000; 23: 755-761.
14. Stutts MJ, Gabriel SE, Price EM, Sarcadi B, Olsen JC, Boucher RC: Pyridine nucleotide redox potential modulates cystic fibrosis transmembrane conductance regulator Cl conductance. J Biol Chem 1994; 269: 8667-8674.
15. Huang P, Lazarowski ER, Tarran R, Milgram SL, Boucher RC: Compartmentalized autocrine signalig to cystis fibrosis transmembrane conductance regulator at the apical membrane of airway epithelial cells. Proc Natl Acad Sci USA 2001; 98: 14120-14125.
16. Schultz BD, Singh AK, Devor DC, Bridges RJ: Pharmacology of CFTR Chloride Activity. Physiol Rev 1999; 79 (suppl 1): 109-144.
17. Calvin U Cotton: Basolateral potassium channels and epithelial ion transport. Am J Respir Cell Mol Biol 2000; 23: 270-272.
18. Van der Baan B: Ciliary function. Acta Oto-Rhino-Laryngologica Belg 2000; 54: 293-298.
19. Shirakami Li D, Zhan G, John RA: Regulation of ciliary beat frequency by nitric oxide-cyclic guanosine monophosphate signalling pathway in rat airway epithelial cells. Am J Respir Cell Mol Biol 2000; 23: 175-181.
20. Runer T, Lindberg S: Ciliostimulatory effects mediated by nitric oxide. Acta Otolaryngol 1999; 119: 821-825.
21. Lieb T, Frei W, Frohock J, Bookman R, Salathe M: Prolonged increase in ciliary beat frequency after short-term purinergic stimulation in human airway epithelial cells. J Physiol 2002; 538: 633-646.
22. Taira M, Tamaoki J, Nishimura K, Nakata J, Kondo M, Takemura H, Nagai A: Adenosine A(3) receptor-mediated potentiation of mucociliary transport and epithelial ciliary motility. Am J Physiol Lung Cell Mol Physiol 2002; 282: L556-62.
23. Tamaoki J, Kondo M, Takeuchi S, Takemura H, Nagai A: Vasopressin stimulates ciliary motility of rabbit tracheal epithelium: role of V1b receptor-mediated Ca+2 mobilization. Am J Respir Cell Mol Biol 1998; 19: 293-299.
24. Wong L, Park C, Yeates D: Neuropeptyde Y inhibits ciliary beat frequency in human cells via nPKC, independently of PKA. Am J Physiol 1998; 275: C440-8.
25. Smith RP, Shellard R, di Benedetto G, Magnus C, Mehta A: Interaction between calcium, neutral endopeptidase and the substance P mediated ciliary response in human respiratory epithelium. Eur Respir J 1996; 9: 86-92.
26. Johnston M, Matts S, Drake A: In vitro effects of diazepam on human ciliary function. Acta Otolaryngol 1997; 117: 856-9.
27. Pendry YD: Neuronal control of airways smooth muscle. Pharmac Ther 1993; 57: 171-202.
28. Barnes PJ: Neuroeffector mechanism: the interface between inflammation and neuronal responses. J Allergy Clin Immunol 1996; 98: 73-83
29. Maggi CA: Tachykinins and calcitonin gene-related peptide (CGRP) as co-transmitters released from peripherial endings of sensory nerves. Prog Neurobiol 1995; 45: 1-98.
30. Tyrakowski T, Wojciechowska I, Banach B, Mościbroda A, Greczko I: Elektrofizjologiczne badania miejscowych zmian transportu jonów w ścianie tchawicy in vitro.Ann Acad Med Stetin 1997; 43: 99-111.
31. Barnes P: Neurogenic inflammation in the airways. Respiration Physiology 2001; 125: 145-154.
32. Di Maria G, Bellofiore S, Gepetti P: Regulation of airway neurogenic inflammation by neutral endopeptidase. Eur Respir J 1998; 12: 1454-1462.
33. Raphael J, Butt M: Comparison of isoflurane with propofol on respiratory cilia. Br J Anaesth 1997; 79: 473-475.
34. Gamsu G, Singer M, Vincent H, Berry S, Nadel J: Post-operative impairment of mucus transport in the lung. AJRCCM 1976; 114: 673-679.
35. Pliss LB, Ingenito EP, Ingram RH, Pichurko B: Assesment of bronchoalveolar cell and mediator response to isocapnic hiperpnoea in asthma. Am Rev Respir Dis 1990; 142: 73-78.
36. Winters L, Yeats B: Interaction between ion transporters and the mucociliary transport system in dog and baboon. J Appl Physiol 1997; 83: 1348-1359.
37. Daviskas E, Anderson S, Gonda I, Ebrel S, Meikle S, Seale J, Bautovich: Changes in mucociliary clearence during and after isocapnic hyperwetylation with dry air asthmatic and healthy subjects. Eur Respir J 1995; 8: 742-751.
38. Grosso A, Jaquet P, Brawand P, Desousa R: Anion-induced dynamic behavior of apical water channels in vasopressin-sensitive epithelia exposed to mercury. Am J Physiol 1994; 266: C1577-C1585.
39. Adir Y, Factor P, Dumasius V, Ridgen K, Sznajder J: Na, K-ATPase Gene transfer increases liquid clearence during ventilation-induced lung injury. AJRCCM 2003; 168: 1445-1448.
40. Saldias F, Lecuona E, Comellas A, Ridge K, Rutschmann D, Sznajder J: Beta-adrenergic stimulation restores rat lung ability to clear edema in ventilator-associated lung injury. AJRCCM 2000; 162: 282-287.
41. Lecuona E, Saldias F, Comellas A, Ridge K, Guerrero C, Sznajder J: Ventilator-associated lung injury decreases lung ability to clear edema in rats. AJRCCM 1999; 159: 603-609.
42. Factor P, Mendez M, Mutlu G, Dumasius V: Acute hyperoxic lung injury does not impede adenoviral-mediated alveolar gene transfer. AJRCCM 2002; 165: 521–526.
43. Cervin A, Lindberg S: Changes in mucociliary activity may be used to investigate the airway-irritating potency of volatile anaesthetics. Br J Anaesth 1998; 80: 475-480.
44. Caterina M, Schumacher M, Tominaga M, Levine J, Julius D: The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature 1997; 389: 816-824.
45. Pizov R, Takahashi M, Hirshman C, Croxton T: Halothane inhibition of ion transport of the tracheal epithelium. Anesthesiology 1992; 76: 985-989.
46. Tyrakowski T, Smuszkiewicz P, Drobnik L, Marzec M, Młodzik-Danielewicz N, Lelińska A, Kaczorowski P: Effects of halotane and izoflurane on airways stimulated transepithelial ion transport. Pol J Pharmacol 2005; 57: w druku.
47. Mutoh T, Tsubone H, Nishimura R, Sasaki N: Effects of volatile anesthetics on vagal C-fiber activities and their reflexes in anesthetized dogs. Respiration Physiology 1998; 112: 253-264.
48. Mutoh T, Tsubone H, Nishimura R, Sasaki N: Responses of laryngeal capsaicin-sensitive receptors to volatile anestetics in anesthetized dogs. Respir Physiol 1998; 111: 113-125.
49. Hann H, Hall A, Raphael J, Langton J: An investigation into the effects of midazolam and propofol on human respiratory cilia beat frequency in viro. Intensive Care Med 1998; 24: 791-794.
50. Shirakami G, Dechun L, Zhan X, Johns R: Propofol stimulates ciliary motility via the nitric oxide-cyclic GMP pathway in cultured rat tracheal epithelial cells. Anesthesiology 2000; 93: 482-488.
51. Stanek A, Brambrink A, Latorre F, Bender B, Kleemann P: Effects of normobaric oxygen on ciliary beat frequency of human respiratory epithelium. Br J Anaesth 1998; 80: 660-664.
52. Alexopoulos C, Jansson B, Lindholm C: Mucus transport and surface damage after endotracheal intubation and tracheostomy. An experimental study in pigs. Acta Anaesthesiol Scand 1984; 28: 68-76.
53. Keller C, Brimacombe J: Bronchial mucus transport velocity in paralyzed anesthetized patients: a comparison of the laryngeal mask airway and cuffed tracheal tube. Anesth Analg 1998; 86: 1280-1282.




