© Borgis - Postępy Fitoterapii 2/2008, s. 90-95
*Krzysztof Marciniec1, Barbara Włodarczyk-Marciniec2
Przeciwnowotworowe własności czosnku
ANTICANCER PROPERTIES OF GARLIC
1Wydział Farmaceutyczny, Katedra Chemii Organicznej, Śląski Uniwersytet Medyczny w Katowicach
Kierownik Katedry: prof. dr hab. n. chem. inż. Andrzej Maślankiewicz
2Zakład Epidemiologii Nowotworów, Centrum Onkologii, Instytut im Marii Skłodowskiej-Curie oddział w Gliwicach
Kierownik Zakładu: prof. dr hab. n. med. Brunon Zemła
Summary
Garlic has a long history as a popular spice added to several preparations as well as medicinal plant. Epidemiological and laboratory studies have shown that garlic consumption reduces cancer incidences in the stomach, colon, mammary, cervical etc. The anticancer properties of garlic can be attributed to the sulfur compounds present in, or generate from garlic. Although garlic produces more than 20 kinds of organosulfur compounds from a few sulfur-containing amino acids e.g. allicin, diallyl disulfide, diallyl trisulfide, ajoenes. Allyl sulfur compounds are the major active constituens found in crushed garlic. Research has revealed that garlic and its lipid- or water soluble components have many pharmacologic properties; however, studies also demonstrate that heating has negative influence on these beneficial effects.
The present paper reviews the biological functions of garlic in the limited study field of its anticancer effect. Before describing those effect we will discuss briefly some characteristic of garlic e.g. composition of fresh garlic and its chemistry.

Czosnek pospolity ( Allium sativum L.) jest stosowany w medycynie od tysięcy lat. Już Egipcjanie znali jego własności bakteriobójcze, a Hipokrates polecał go jako lekarstwo w schorzeniach układu pokarmowego. Siła lecznicza, którą przypisuje się tej roślinie, stanowi niejedną legendę. Według podań czosnek leczy większość schorzeń. Za jego swoiste własności odpowiadają organiczne pochodne siarki wchodzące w skład olejku czosnkowego, których prekursorami są tioaminokwasy (alliina, metyloalliina, propyloalliina). Cebulka produkuje je w celu ochrony przed zakażeniami wywołanymi przez bakterie, czy grzyby. Ponadto związki te, wykazując charakterystyczny zapach i smak, chronią czosnek przed zjedzeniem przez zwierzęta (1-3).
Prowadzone aktualnie badania, nad kierunkami działania substancji chemicznych występujących w czosnku, potwierdzają jego unikalne własności i wykazują m.in. działanie przeciwbakteryjne (4), przeciwgrzybicze (5), przeciwzakrzepowe (6) czy przeciwutleniające (7). Z kolei badania epidemiologiczne wykazują wyraźną zależność między dietą bogatą w czosnek, a niską zachorowalnością na nowotwory układu pokarmowego (8). Również doświadczenia wykonane na zwierzętach potwierdziły chemoprewencyjne właściwości czosnku w stosunku do szeregu kancerogenów (tabela 1) (9).
Tabela 1. Własności chemoprewencyjne czosnku przedstawione na wybranych modelach eksperymentalnych.
| Rodzaj nowotworu | Model eksperymentalny | Użyty kancerogen |
| żołądek | myszy | benzo(a)piren (10) |
| płuca | myszy | benzo(a)piren (11) |
| wątroba | myszy | benzo(a)piren, aflatoksyna (10, 12) |
| okrężnica | linie komórkowe | azoksymetan, 5-fluorouracyl (13, 14) |
| żołądek | badania epidemiologiczne | (15, 16) |
| skóra | myszy | policykliczne węglowodory aromatyczne (17) |
| pęcherz | myszy | (18) |
| sutek | szczury | 7,12-dimetylobenzo-(a)antracen, N-nitrozometylomocznik (19, 20) |
| szyjka macicy | myszy | metylocholantren (21) |
| otrzewna | myszy | komórki rakowe (8) |
Chemia czosnku
Badania nad ustaleniem składu chemicznego czosnku (tabela 2) (22) sięgają XIX wieku, gdy Semmler (1892) wyodrębnił, na drodze destylacji z parą wodną, charakterystycznie pachnący olejek (23). Świeża cebulka zawiera dużą liczbę różnych związków chemicznych, których wydzielenie uzależnione jest od zastosowanych warunków ekstrakcji (24-26).
Tabela 2. Skład chemiczny czosnku.
| Składnik | Zawartość (%) |
| woda | 63,00 |
| węglowodany | 28,60 |
| białka | 6,40 |
| potas | 0,4 |
| fosfor | 0,1 |
| wapń | 0,1 |
| lotne związki zapachowe | 0,07 |
| tłuszcze | 0,06 |
| witamina C | 0,02 |
W przypadku destylacji z parą wodną, gdy ekstrakcję związków czynnych z kondensatu poprzedza gotowanie czosnku, otrzymuje się: sulfid diallilowy (DAS), disulfid diallilowy (DADS), trisulfid diallilowy (DATS), sulfid dipropylowy (DPS), disulfid dipropylowy (DPDS), ponadto sulfidy: dimetylowy oraz allilowometylowy; disulfidy: dimetylowy, allilowopropylowy, allilowometylowy; trisulfidy: dimetylowy, allilowometylowy, metylowopropylowy oraz tiosulfinian diallilowy i dwutlenek siarki (27). Olejek czosnkowy otrzymany na tej drodze wykazuje własności przeciwutleniające, ale nie przejawia właściwości przeciwdrobnoustrojowych i przeciwzakrzepowych (27).
Łagodniejsze techniki służące wydzieleniu pochodnych siarkoorganicznych z czosnku, takie jak ekstrakcja (np. alkoholem etylowym) w temperaturze pokojowej prowadzą do uzyskania allicyny (S-tlenku disulfidu diallilowego, S-allilo-2-propenotiosulfinianu) odpowiedzialnej za charakterystyczny zapach czosnku. Ekstrakcja etanolem w temperaturze poniżej 0°C pozwala na otrzymanie, pozbawionego nieprzyjemnego zapachu, prekursora allicyny – alliiny czyli (+)S-tlenku-S-allilocysteiny. Źródłem alliiny w czosnku jest oligopeptyd γ-L-glutamylo-S-allilocysteina (GSAC), z którego na drodze enzymatycznej hydrolizy uwalniana jest S-allilocysteina (SAC). Aminokwas ten (SAC), ulegając następczej reakcji utleniania, przechodzi w alliinę.
Badania nad wydzieleniem i własnościami alliiny, przeprowadzone przez Stolla i Seebecka (28) wykazały, że związek ten jest łatwo rozpuszczalny w wodzie i nie wykazuje działania antybiotycznego. Enzym alliinaza występujący w różnych odmianach czosnku, który uaktywnia się w rozdrobnionym produkcie, wywołuje szybki rozkład alliiny do wykazującej antybiotyczne działanie allicyny. Allicyna ulega następnie szeregowi różnych przemian, prowadzących do powstania znacznej liczby aktywnych biologicznie pochodnych. Niektóre z tych przemian przedstawiono na rycinie 1.
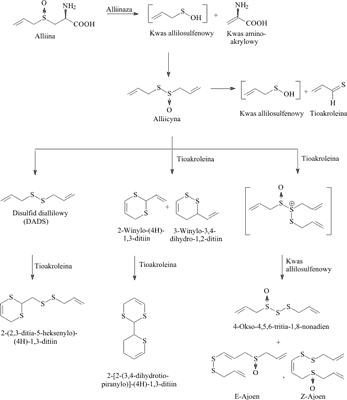
Ryc. 1. Wybrane kierunki transformacji alliiny.
Alliina stanowi 83% ogólnej ilości aminokwasów znajdujących się w czosnku. Na S-tlenek-S-metylocysteiny (metyloalliinę) przypada 13%, a na S-tlenek-S-propylocysteiny (propyloalliinę) 2% (ryc. 2).
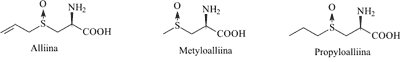
Ryc. 2. Prekursory związków siarkoorganicznych czosnku.
Metyloalliina i propyloalliina ulegają pod wpływem alliinazy analogicznym przemianom jak alliina, prowadzącym m.in. do wspomnianych już symetrycznych i niesymetrycznych sulfidów, disulfidów i trisulfidów z podstawnikami metylowymi i propylowymi.
Przeciwnowotworowe działanie czosnku
W ramach przeprowadzonych badań (zarówno in vitro jak i in vivo) (10-21) wiele grup badawczych wykazało antyproliferacyjne działanie czosnku względem różnego rodzaju komórek nowotworowych. Sundaram i Milner (29) udowodnili silniejsze działanie zarówno olejku czosnkowego, jak i disulfidu diallilowego, w porównaniu z 5-fluorouracylem i mitomycyną C w stosunku do kilku linii komórek nowotworowych. Inne badania (30) przeprowadzono na szczurach z wszczepionym guzem Morrisa (Morris hepatoma). Pierwszej grupie zwierząt podawano liofilizowany czosnek w ilości 2,5% całej diety, w grupie drugiej preparat stanowił 5% diety, zaś grupa trzecia stanowiła grupę kontrolną, której nie podawano preparatu czosnku. Stwierdzono zmniejszenie rozmiaru guza proporcjonalnie do ilości zastosowanego w diecie preparatu. Lau i wsp. (8) stwierdzili hamowanie wzrostu komórek nowotworowych pod wpływem substancji wydzielonych z czosnku w początkowych fazach kancerogenezy: w fazie inicjacji i promocji, a Khanum i wsp. (31) potwierdzili osłonowe działanie świeżego czosnku oraz olejku czosnkowego, które stanowiły 4% diety badanych szczurów, w stosunku do podawanego zwierzętom kancerogenu – azoksymetanu.
W pracach zespołu Sadhana i wsp. (32) badano wpływ olejku czosnkowego na hamowanie wzrostu raka skóry u myszy, indukowanego benzo(a)pirenem. Autorzy stwierdzili zmniejszenie częstotliwości występowania nowotworu u badanych zwierząt, proponując równocześnie mechanizmy działania preparatu m.in. polegające na hamującym działąniu w stosunku do lipooksygenazy, czy cyklooksygenazy.
Mechanizmy działania
Pochodne allilowe jako induktory enzymów II fazy detoksykacji
Powyżej zamieściliśmy fragment artykułu, do którego możesz uzyskać pełny dostęp.
Mam kod dostępu
- Aby uzyskać płatny dostęp do pełnej treści powyższego artykułu albo wszystkich artykułów (w zależności od wybranej opcji), należy wprowadzić kod.
- Wprowadzając kod, akceptują Państwo treść Regulaminu oraz potwierdzają zapoznanie się z nim.
- Aby kupić kod proszę skorzystać z jednej z poniższych opcji.
Opcja #1
24 zł
Wybieram
- dostęp do tego artykułu
- dostęp na 7 dni
uzyskany kod musi być wprowadzony na stronie artykułu, do którego został wykupiony
Opcja #2
59 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 30 dni
- najpopularniejsza opcja
Opcja #3
119 zł
Wybieram
- dostęp do tego i pozostałych ponad 7000 artykułów
- dostęp na 90 dni
- oszczędzasz 28 zł
Piśmiennictwo
1. Mahady GB, Matsuura H, Pendland SL. Allixin, a phytoalexin from garlic, inhibits the growth of Helicobacter pylori in vitro. Am J Gastroenterol 2001; 96:3454-5. 2. Amonkar SV, Banerji A. Isolation and characterization of larvicidal principle of garlic. Science 1971; 174:1343-4. 3. Amonkar SV, Reeves EL. Mosquito control with active principle of garlic. J Econ Entomol 1970; 63:1172-5. 4. Yoshida H, Katsuzaki H, Ohta R i wsp. An organosulfur compound isolated from an oil-macerated garlic extract, and its antimicrobal effect. Biosci Biotechnol Biochem 1999; 63:588-590. 5. Yoshida S, Kasuga S, Hayashi N i wsp. Antifungal activity of ajoene derived from garlic. Appl Environ Microbiol 1987; 53:615-7. 6. Ariga T, Tsuji K, Seki T i wsp. Antithrombotic and antineoplastic effects of phyto-organosulfur compounds. Biofactors 2000;13:251-5. 7. Halliwell B, Gutteridge JMC, Cross CE. Free radicals, antioxidants and human disease: Where are we now? J Lab Clin Med 1992; 119:598-620. 8. Lau BHS, Tadi PP, Tosk JM. Allium sativum (garlic) and cancer prevention. Nutr Res 1990; 10:937-48. 9. Khanum F, Anilakumar KR, Viswanathan KR. Anticarcinogenic properties of garlic: A review. Crit Rev Food Sci Nutr 2004; 44:479-88. 10. Srivastava SK, Xun H, Hong X i wsp. Mechanism of differential efficacy of garlic organosulfides in prewenting benzopyrene-induced cancer in mice. Cancer Lett 1997; 118:61-7. 11. Singh SV, Pann SS, Srivastava SK i wsp. Differential induction of NAD(P)H: quinone oxidoreductase by anticarcinogenic organosulfides from garlic. Biochem Biophys Res Comm 1998; 244:917-20. 12. Soni KB, Lahiri M, Chackradeo P i wsp. Protective effect of food additives on aflatoxin induced mutagenicity and hepatocarcinogencity. Cancer Lett 1997; 115:129-33. 13. Reddy BS, Rao CV, Rivenson A i wsp. Chemoprevention of colon carcinogenesis by organosulfur compounds. Cancer Res 1993; 53:3493-8. 14. Sundaram SG, Milner JA. Diallyl disulfide induced apoptosis of human colon tumor cells. Carcinogenesis 1996; 17:669-73. 15. You WC, Blot WJ, Chang YS i wsp. Allium vegetables and reduced risk of stomach cancer. J Natl Cancer Instit 1989; 81:162-4. 16. Haixiu X, Rui S, Hongzhou N i wsp. A five year prospective study on the relationship between garlic and gastric cancer. Chinese J Cancer Res 1989; 1:60-2. 17. Singh A, Shukl Y. Antitumor activity of diallyl sulfide on polycyclic aromatic hydrocarbon-induced mouse skin carcinogenesis. Cancer Lett 1998; 131:209-14. 18. Masa CL, Torrey RR, Wookey JL i wsp. Superiority of intravesical immunotherapy with Corynebacterium parvum and Allium sativum in control of murine bladder cancer. J Urol 1987; 137:359-62. 19. Liu J, Lin RI, Milner JA. Inhibition of 7,12-dimetylobenzo(a)antracene-induced mammary tumors and DNA adducts by garlic powder. Carcinogenesis 1992; 13:1847-51. 20. Lin XY, Lin RI, Milner JA. Dietary garlic suppresses DNA adducts caused by N-nitroso compounds. Carcinogenesis 1994; 15:349-52. 21. Hussain SP, Jannu LN, Rao AR. Chemopreventive action of garlic on methylcholantrene-induced carcinogenesis in the uterine cervix of mice. Cancer Lett 1990; 49:175-80. 22. Ambrose DCP, Sreenarayanan VV. Studies on the dehydration of garlic. J Food Sci Technol 1998; 35:242-4. 23. Semmler F. Über das ätherische Öl das Knoblauchs. Arch Pharm 1892; 230:434-48. 24. Block E. The chemistry of garlic and onions. Sci Am 1985; 252:114-9. 25. Block E, Naganathan S, Putman D i wsp. Allium chemistry: HPLC analysis of thiosulfinates from onion garlic, wild garlic (ramons), leek, scallion, shallot, elephant (great-headed) garlic, chive and Chinese chive. Uniqely high allyl to methyl ratios in some garlic samples. J Agric Food Chem 1992; 40:2418-30. 26. Mochizuki E, Yammamoto T, Komiyann Y i wsp. Identification of pallium products Rusing flame photometricdetection gas chromatography and distribution patterns of volatile sulfur compounds. J Agric Food Chem 1998; 46:5170-6. 27. Abraham KO, Shankaranarayana ML, Raghavan B i wsp. Allium – varietes, chemistry and analysis. Lebensm – Wiss U Technol 1976; 9:193-200. 28. Stoll A, Seebeck E. Über Alliin, die genuine Muttersubstanz des Knoblauchöls. Helv Chim Acta 1948; 31:189-210. 29. Sundaram SG, Milner JA. Diallyl disulfide inhibits the proliferation tumor cells in culture. Biochim Biophys Acta 1996; 1315:15-20. 30. Criss WE, Fakunle J, Knight E i wsp. Inhibitor of tumor growth with low dietary protein and with dietary garlic extracts. Fed Proc 1982; 41:281-9. 31. Khanum F, Anilakumar KR, Sudarshanakrishna KR i wsp. Effects of feeding fresh garlic and garlic oil on detoxyifying enzymes an micronuclei formation in rats treated with azoxymethane. Int J Vit Nutr Res 1998; 68:208-13. 32. Sadhana AS, Rao AR, Kucheria K i wsp. Inhibitory action of garlic oil on the initiation of benzo(a)pyrene-induced skin carcinogenesis in mice. Cancer Lett 1988; 40:193-7. 33. Sheweita SA, El-Gabar Abd M, Bastawy M. Carbon tetrachloride-induced changes in the activity of phase II drug-metabolizing enzyme in the liver of male rats: role of antioxidants. Toxicology 2001; 165:217-24. 34. Fukao T, Hosono T, Misawa S i wsp. Chemoprotective effect of diallyl trisulfide from garlic against carbon tetrachloride-induced acute liver injury of rats. Biofactors 2004; 21:171-4. 35. Fukao T, Hosono T, Misawa S i wsp. The effects of allil sulfides on the induction of phase II detoxification enzymes and liver injury by carbon tetrachloride. Food Chem Toxicol 2004; 42:743-9. 36. Wu CC, Sheen LY, Chen HW i wsp. Differential effects of garlic oil and its three major organosulfur components on the hepatic detoxification system in rats. J Agric Food Chem 2002; 50:378-83. 37. Wu CC, Sheen LY, Chen HW i wsp. Effects of organosulfur compounds from garlic oil on the antioxidation system in rat liver and red blood cells. Food Chem Toxicol 2001; 39:563-9. 38. Yang CS, Chhabra SK, Hong JY i wsp. Mechanism of inhibition of chemical toxicity and carcinogenesis by diallyl sulfide (DAS) and related compounds from garlic. J Nutr 2001; 131:1041S-5S. 39. Wargowich MJ, Woods C, Eng VWS i wsp. Chemoprewention of N-nitroso, methylbenzylamine-induced esophageal cancer in rats by the naturally occurring thioether, diallyl sulfide. Cancer Res 1988; 48:6872-5. 40. Okada Y, Tanaka K, Fujita I i wsp. Antioxidant activity of thiosulfinates derived from garlic. Redox Rep 2005; 10:96-102. 41. Wu CC, Sheen LY, Chen HW i wsp. Effects of garlic oil and its organosulfur compounds on the activities of hepatic drug-metabolizing and antioxidant enzymes in rats fed high- and low-fat diets. Nutr Cancer 1999; 35:160-6. 42. Hosono T, Fukao T, Ogihara Y i wsp. Diallyl trisulfide supresses the proliferation and induces apoptosis of human colon cancer cells through oxidative modification of tubulin. J Biol Chem 2005; 289:41487-93. 43. Sakamoto K, Lawson LD, Milner JA. Allyl sulfides from garlic supress the in vitro proliferation of human A549 lung tumor cells. Nutr Cancer 1997; 29:152-6. 44. Li M, Ciu JR, Ye Y i wsp. Antitumor activity of Z-ajoene, a natural compound purified from garlic: antimitotic and microtubule-interaction properties. Carcinogenesis 2002; 23:573-9. 45. Seki T, Tsuji K, Hayato Y i wsp. Garlic and onion oils inhibit proliferation and induce differentiation of HL-60 cells. Cancer Lett 2000; 160: 29-35. 46. Xiao D, Choi S, Johnson DE i wsp. Diallyl trisulfide-induced apoptosis in human prostate cancer cells involves c-Jun N-terminal kinase and extracellular-signal regulated kinase-mediated phosphorylation of Bcl-2. Oncogene 2004; 23:5594-606. 47. Xiao D, Herman-Antosiewicz A, Antosiewicz J i wsp. Diallyl trisulfide-induced G(2)-M phase cell cycle arrest in human prostate cancer cells in caused by reactive oxygen species-dependent destruction and hyperphosphorylation of Cdc 25 C. Oncogene 2005; 24:6256-68. 48. Antosiewicz J, Herman-Antosiewicz A, Marynowski SW i wsp. c-Jun NH2-Terminal kinase signaling axis regulates diallyl trisulfide–induced generation of reactive oxygen species and cell cycle arrest in human prostate cancer cells. Cancer Res 2006; 66:5379-86. 49. Choi S, Singh SV. Bax and bak are required for apoptosis induction by sulforaphane, a cruciferous vegetable-derived cancer chemopreventive agent. Cancer Res 2005; 65:2035-43. 50. Ariga T, Seki T. Antithrombotic and anticancer effects of garlic-derived sulfur compounds: A review. Biofactors 2006; 26:93-103. 51. Council of Europe. Flavouring substances and natural sources of flavouring. Partial agreement in the social and public health field. pp. 200. Maissoneuve, List 1. No. 485, Ed. S.A. Strassbourg.


